Статьи
Антиандроген II поколения одобрен для лечения M0КРРПЖ
Неуклонный рост уровня ПСА на фоне проводимой стандартной гормональной терапии у пациентов с неметастатическим РПЖ является не только поводом для волнения пациента, но и проблемой для врача из-за отсутствия принятых стандартов лечения и эффективных лечебных опций. К тому же биохимическое прогрессирование примерно у трети больных в течение 2 лет реализуется в костные метастазы. Независимыми факторами неблагоприятного прогноза М0 КРРПЖ могут быть исходный уровень ПСА, скорость прироста ПСА и время удвоения ПСА (PSA-DT). В ряде исследований показана их корреляция с временем до развития костных метастазов, выживаемостью без метастазирования и общей выживаемостью. NCCN предлагает следующий алгоритм выбора терапии в зависимости от скорости нарастания ПСА (см. рис. 1).
До сих пор не существовало препаратов с одобренными показаниями для применения у пациентов с М0 КРРПЖ, что объяснялось отсутствием убедительной доказательной базы. С появлением двух крупных рандомизированных исследований III фазы ситуация изменилась.
STRIVE: ВПЕРВЫЕ ИССЛЕДУЯ НЕМЕТАСТАТИЧЕСКИЙ КРРПЖ
Энзалутамид стал первым препаратом, показавшим достоверную эффективность у больных неметастатическим КРРПЖ.
Опубликованные в 2016 году результаты клинического исследования II фазы STRIVE показали снижение относительного риска прогрессирования и смерти на 76 % при лечении энзалутамидом по сравнению с бикалутамидом (ОР=0,24, P=0,001).
Энзалутамид продемонстрировал преимущество в отношении всех показателей эффективности: выживаемости без прогрессирования (медиана не достигнута против 8,6 мес, P<0,001), времени до ПСА- прогрессирования (медиана не достигнута против 11,1 мес, Р=0,001), частоты достижения 50 % ПСА-ответа (91 % против 42 %, Р=0,001) и выживаемости без радиологического прогрессирования (медианы не достигнуты в обеих группах, Р<0,001 ).
Исследователи не отметили значимых различий в частоте токсичности 3–4 степени между обеими группами. Важно отметить, что все пациенты в исследовании продолжали получать постоянную гормональную терапию агонистами лютеинизирующего гормона рилизинг-гормона (ЛГРГ).
Клиническое значение полученных результатов становится еще важнее, если учитывать, что в STRIVE проводилось прямое рандомизированное сравнение энзалутамида не с плацебо, а с бикалутамидом. Именно результаты STRIVE наглядно показали ограниченную эффективность бикалутамида в сравнении с терапией энзалутамидом.
Примечательно, что изначально не было поставлено цели изменить клинические рекомендации по лечению неметастатического КРРПЖ. В исследование II фазы STRIVE было включено почти в два раза больше пациентов с наличием метастатического КРРПЖ (n=257), чем с М0 КРРПЖ (n=139). Преимущества энзалутамида были подтверждены в обеих категориях пациентов независимо от наличия отдаленных метастазов, однако такой важный показатель эффективности, как общая выживаемость больных, в исследовании не оценивался. На основании результатов STRIVE можно было только выдвинуть гипотезу о возможном преимуществе при назначении энзалутамида у больных М0 КРРПЖ. В дальнейшем эта гипотеза была подтверждена данными клинического исследования III фазы.
Ряд экспертов обратили внимание на режим дозирования бикалутамида в исследовании. Так, в России бикалутамид может быть назначен в двух разных суточных дозах — 50 мг или 150 мг. К сожалению, при проведении исследования не существовало выбора дозировки: в отличие от большинства стран мира, в США выдано разрешение на применение бикалутамида только в дозе 50 мг в сутки.
Согласно текущим клиническим рекомендациям, применение бикалутамида ограничено краткосрочным курсом (7–30 дней) исключительно для профилактики синдрома вспышки у больных метастатическим РПЖ в первый месяц гормональной терапии (АДТ) агонистами ЛГРГ. Следует избегать монотерапии бикалутамидом у всех больных метастатическим РПЖ (степень рекомендации А). В 2018 году появилась дополнительная рекомендация NCCN: следует избегать назначения бикалутамида у пациентов, получающих терапию абиратероном.
SPARTAN — ИССЛЕДОВАНИЕ, ИЗМЕНИВШЕЕ РЕКОМЕНДАЦИИ NCCN
Первым исследованием III фазы с включением только пациентов с М0 КРРПЖ стал протокол SPARTAN, в котором изучали эффективность и безопасность терапии новым антиандрогеном апалутамидом в сравнении с плацебо у больных неметастатическим КРРПЖ из группы высокого риска прогрессирования (с быстрым временем удвоения уровня ПСА).
Апалутамид относится к нестероидным конкурентным ингибиторам андрогенных рецепторов (АР) II поколения. Аналогично энзалутамиду, апалутамид не только прямо блокирует лиганд- связывающий домен АР, но и препятствует его внутриклеточной транслокации, связыванию с ДНК и транскрипции генов. В ранее проведенном исследовании II фазы апалутамид показал длительный ПСА-ответ у пациентов с М0 КРРПЖ, имеющих 1–2 фактора высокого риска прогрессирования (исходный уровень ПСА ≥8 нг/мл, время удвоения ПСА ≤10 мес).
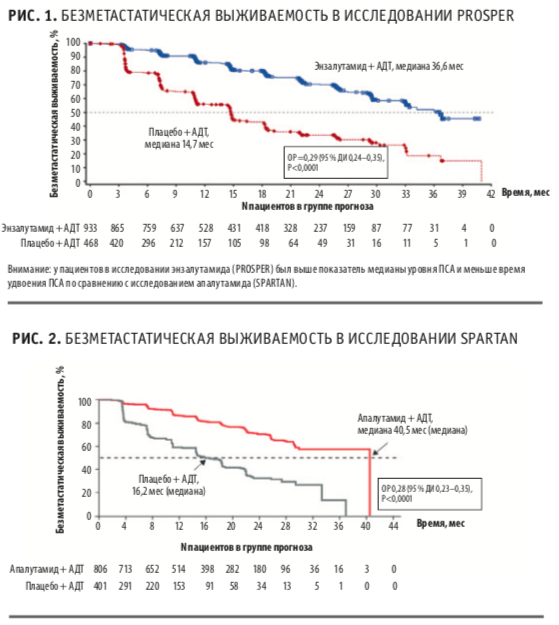
В многоцентровое исследование III фазы SPARTAN с 2013 по 2016 гг. были включены 1207 пациентов с М0 КРРПЖ и PSA-DT≤10 мес, однако допускалось наличие метастазов в регионарных лимфатических узлах (N1, у 16,5 %). Медиана уровня ПСА была одинаковой в группах апалутамида и плацебо: 7,78 нг/мл и 7,96 нг/мл соответственно. Показатель времени удвоения ПСА был также сопоставим: 4,4 мес и 4,5 мес в группах апалутамида и плацебо соответственно. Все пациенты были рандомизированы 2:1 в группу апалутамида (n=806) или плацебо (n=401), помимо которых проводилась постоянная гормонотерапия аналогами ЛГРГ или была выполнена хирургическая кастрация.
Предшествующее радикальное местное лечение (простатэктомия, лучевая терапия) проводилось у 76,6 % пациентов. Отсутствие метастазов подтверждалось данными остеосцинтиграфии и мультиспиральной компьютерной томографии четырех зон (грудной клетки, брюшной полости, малого таза, головного мозга). Контрольные обследования проводились каждые 16 недель.
Главная и вторичные точки исследования показали преимущество апалутамида. Медиана выживаемости без метастазирования в группе апалутамида составила 40,5 мес, а плацебо — 16,2 мес (Р<0,0001). Эффективность апалутамида наблюдалась независимо от возраста, статуса ECOG, исходного уровня ПСА и числа предшествующих линий гормонотерапии. Наличие регионарных метастазов и сверхкороткий PSA-DT<6 мес не влияли на эффективность апалутамида.
Пользу апалутамида также продемонстрировали данные о времени до наступления клинического прогрессирования, времени до метастазирования и выживаемости без прогрессирования (для всех показателей, Р<0,001). При обнаружении метастазов всем пациентам назначался абиратерона ацетат, так что была возможность оценить эффективность последующего лечения.
Во второй линии выживаемость без прогрессирования была также выше среди пациентов, получавших в первой линии апалутамид (ОР=0,49, 95 % ДИ 0,36–0,66). При промежуточном анализе общей выживаемости (по данным 24 % событий) выявлена тенденция в пользу апалутамида (ОР=0,70, 95 % ДИ 0,47–1,04, Р=0,07). Анализ показал снижение относительного риска развития отдаленных метастазов и летальных исходов при приеме апалутамида на 72 %.
К медиане наблюдения 20,3 мес 61 % пациентов продолжали получать апалутамид, в то время как плацебо — лишь 30 %. Отмена лечения вследствие развития побочных явлений потребовалась для 10,6 % пациентов в группе апалутамида и 7,0 % в группе плацебо. Нежелательные явления, которые чаще регистрировались по сравнению с плацебо, включали кожную сыпь (23,8 % против 5,5 %), гипотиреоз (8,1 % против 2 %) и переломы костей (11,7 % против 6,5 %).
Независимый комитет в июле 2017 г. признал клиническую эффективность апалутамида, учитывая убедительную доказательность данных по эффективности и безопасности, полученных в исследовании SPARTAN. Члены комитета рекомендовали раскрыть рандомизацию и предоставить всем пациентам из группы плацебо возможность принимать апалутамид.
Сразу после публикации результатов исследования SPARTAN FDA одобрило применение апалутамида в дозе 240 мг в сутки у пациентов с неметастатическим КРРПЖ. Изменения также внесены в стандарты лечения NCCN: новой опцией лечения неметастатического КРРПЖ теперь может быть апалутамид (уровень доказательности 1). Важно помнить при назначении апалутамида о необходимости поддерживающей терапии метаболизма костной ткани.
ИССЛЕДОВАНИЕ III ФАЗЫ PROSPER: ЭНЗАЛУТАМИД ДОКАЗАЛ ЭФФЕКТИВНОСТЬ
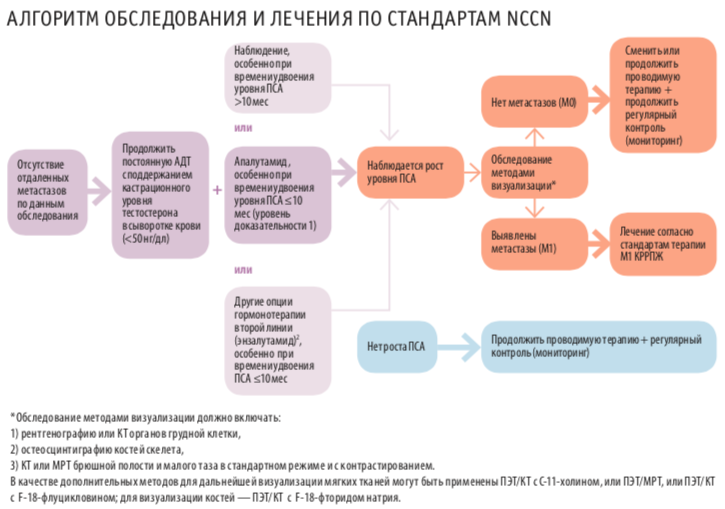
Результаты еще одного крупного исследования III фазы, PROSPER, были представлены на ежегодной конференции ASCO GU 2018 вместе с результатами исследования SPARTAN. Назначение энзалутамида при М0 КРРПЖ улучшало основной и все дополнительные показатели эффективности в исследовании. Относительный риск развития отдаленных метастазов и летальных исходов достоверно снижался при приеме энзалутамида на 71 % по сравнению с плацебо.
В исследование был включен 1401 пациент с М0 КРРПЖ и высоким риском прогрессирования (скорость удвоения ПСА ≤ 10 мес, уровень ПСА ≥ 2 нг/мл). Средний возраст составил 74 года (диапазон 50–95). Медиана уровня ПСА была выше в группе энзалутамида — 11,1 нг/ мл (диапазон 0,8–1071), чем плацебо — 10,2 нг/мл (диапазон 0,2– 467,5). Показатель времени удвоения ПСА был сопоставим: 3,8 мес (диапазон 0,4–37,4) и 3,6 мес (0,5–71,8) соответственно. Стоит отметить, что у пациентов в исследовании энзалутамида (PROSPER) был выше показатель медианы уровня ПСА и меньше время удвоения ПСА по сравнению с исследованием апалутамида (SPARTAN).
Прием энзалутамида значительно увеличивал медиану выживаемости без метастазирования (36,6 мес против 14,7 мес, P<0,0001), времени до ПСА-прогрессирования (37,2 мес против 3,9 мес, P<0,0001) и времени до начала следующей линии противоопухолевой терапии (39,6 мес против 17,7 мес, Р<0,0001). Медианы общей выживаемости не достигнуты в обеих группах на момент проведения анализа. Относительный риск смерти при приеме энзалутамида был ниже на 20 %, чем в группе плацебо.
Профиль безопасности энзалутамида признан удовлетворительным, неожиданных проявлений токсичности не отмечено. Частота вынужденного прерывания лечения в связи с неконтролируемыми нежелательными явлениями оказалась практически одинаковой в обеих группах: 10 % при терапии энзалутамидом и 8 % при плацебо.
С высокой долей вероятности уже этим летом в клинические рекомендации лечения неметастатического КРРПЖ будет включен и энзалутамид. После публикации окончательных данных исследования PROSPER, которая планируется в июне, со стороны FDA и Европейского агентства лекарственных средств (EMA) можно будет ожидать ускоренного расширения показаний к применению этого препарата. С позиции доказательной медицины энзалутамид и апалутамид имеют сопоставимую эффективность у категории пациентов с неметастатическим КРРПЖ. Однако апалутамид пока разрешен только в США и не имеет регистрации в странах Европы. Очевидно, что, в отличие от энзалутамида, который включен Минздравом России в список ЖНВЛП на 2018 год, он еще не скоро войдет в клиническую практику в России.
А энзалутамид уже в ближайшем будущем может стать первым препаратом с высоким уровнем доказательности, доступным для лечения пациентов с неметастатическим КРРПЖ в России. Впрочем, возможно, будет выбор из двух эффективных и хорошо переносимых препаратов.

















