Статьи
Диабетическая ретинопатия: диалог эндокринолога и офтальмолога
Круглый стол под вынесенным в заголовок статьи названием состоялся в рамках междисциплинарного научно-практического совещания «Офтальмология и эндокринология». Ведущие эксперты в данном вопросе — доктора медицинских наук Т.Ю. Демидова, Г.Р. Галстян и Д.В. Липатов обсудили актуальные проблемы лечения диабетической ретинопатии (ДР) и диабетического макулярного отека (ДМО), а также пути их решения. Помимо эндокринологов в совещании приняли участие офтальмологи, специализирующиеся в данной области.
 Первой слово взяла профессор Т.Ю. Демидова. Татьяна Юльевна обратилась к данным Федерального регистра сахарного диабета (ФРСД), согласно которым в 2022 году в стране было 4,872 млн пациентов с этим диагнозом, то есть 3,3 % населения страны. Однако на самом деле таких больных в 1,5–2 раза больше — их численность превышает 10 млн человек. По результатам исследования NATION (2013–2015), диабетом страдают 6 % россиян, причем СД 2-го типа диагностирован только у 54 % пациентов среди всех поставленных на учет с этим заболеванием.
Первой слово взяла профессор Т.Ю. Демидова. Татьяна Юльевна обратилась к данным Федерального регистра сахарного диабета (ФРСД), согласно которым в 2022 году в стране было 4,872 млн пациентов с этим диагнозом, то есть 3,3 % населения страны. Однако на самом деле таких больных в 1,5–2 раза больше — их численность превышает 10 млн человек. По результатам исследования NATION (2013–2015), диабетом страдают 6 % россиян, причем СД 2-го типа диагностирован только у 54 % пациентов среди всех поставленных на учет с этим заболеванием.
Что же касается ДР, то здесь действует правило одной трети: треть пациентов с СД уже имеют ДР, и у каждого третьего больного наблюдается макулярный отек. Ожидается, что в 2045 году в мире будет уже 160 млн пациентов с ДР и 45 млн больных СД с угрозой потери зрения.
Существует пять основных факторов риска ДР и ДМО, рассматриваемых в качестве высокоспецифических нейрососудистых осложнений СД. Это плохой контроль гликемии, ее вариабельность, артериальная гипертензия, высокая длительность СД (свыше 10 лет) и дислипидемия.
С 2010 по 2022 год распространенность ДР у российских пациентов снизилась на 4 % при СД 1-го типа и на 5 % при СД 2-го типа. Так, например, в 2010 году диагноз ДР был поставлен 39 % больных СД 1-го типа, а в 2022 году—35 %. В 2010 году ДР страдали 17 % больных СД 2-го типа, а в 2022 году— лишь 12 %. По данным ФРСД, в 2022 году в России было свыше 652 тыс. пациентов с ДР и более 230 тыс.— с ДМО. К сожалению, специалистам приходится наблюдать быстрый рост распространенности ДМО по мере усугубления ДР. Так, у больных с непролиферативной ДР макулярный отек наблюдается в 2–6 %, препролиферативной — в 20–63 %, а с пролиферативной — уже в 70–74 % случаев. Без лечения каждому десятому пациенту с СД угрожает слепота.
Долгие годы прошли в ожидании завершения работы российских экспертов — офтальмологов и диабетологов над клиническими рекомендациями (КР) «Сахарный диабет: ретинопатия диабетическая, диабетический макулярный отек». Наконец, в 2023 году они были утверждены Минздравом России. Вот как в этом документе отражены последние представления о патогенезе ДР и ДМО.
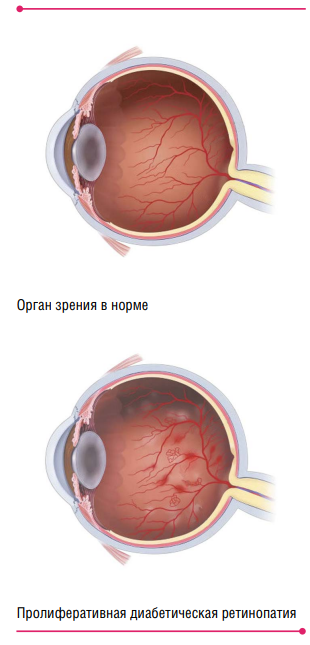
ДР—заболевание из группы ишемических ретинопатий. Они характеризуются значительным нарушением капиллярной перфузии, развитием внутриглазных новообразованных сосудов и отеком сетчатки. Окклюзия и отек — основные патологические проявления ДР. Причем окклюзия поражает в основном периферические отделы сетчатки, а отек—ее центральную часть, макулярную зону. Окклюзия сосудов ведет к появлению неперфузируемых зон сетчатки. В ответ на их появление начинается мощный выброс ангиогенных факторов и воспалительных цитокинов. В условиях гипергликемии (главным образом под влиянием глюкозотоксичности) развивается каскад патологических биохимических процессов. В результате образуются конечные продукты гликирования и активные формы кислорода (АФК), вызывающие повреждение сосудистой стенки и гибель эндотелиальных клеток. Поражению эндотелия сосудов способствуют также резкое усиление ретинального кровотока в условиях гипергликемии и воздействие АФК. Оксидативный стресс индуцирует экспрессию воспалительных цитокинов и молекул клеточной адгезии, способствующих миграции лейкоцитов и лейкостазу.
Повреждение эндотелия (потеря перицитов — клеток, формирующих каркас стенки сосуда), усиление агрегации элементов крови, активация факторов коагуляции приводят к окклюзии капилляров и ретинальной ишемии. Последняя запускает гиперэкспрессию эндотелиального фактора роста сосудов (VEGF-А)—ключевого звена диабетического поражения сетчатки—макулярного отека и неоваскуляризации. Но есть и другой патогенетический механизм. Воздействуя на эндотелиальные белки плотных межклеточных контактов, VEGF-А способствует повышению сосудистой проницаемости, что усиливает накопление экстрацеллюлярной жидкости и белков в ткани сетчатки. Жидкость, которая проходит через стенку капилляров, в норме должна реабсорбироваться пигментным эпителием и соседними капиллярами сетчатки. Когда же диффузия превышает потенциальные возможности реабсорбции пигментного эпителия и капилляров, развивается ДМО.
Повышенная экспрессия VEGF-А также инициирует процесс ангиогенеза: новообразованные сосуды растут по задней поверхности стекловидного тела — задней гиалоидной мембране. И очень важно, что стенки таких сосудов неполноценны. Это приводит к выходу за пределы сосудов компонентов плазмы и цельной крови. В результате в зонах неоваскуляризации начинается быстрое разрастание соединительной ткани. Поскольку она всегда стремится к сокращению, а адгезия фиброваскулярного конгломерата к задней поверхности стекловидного тела очень плотная, развивается отслойка стекловидного тела с множественными разрывами новообразованных сосудов и развитием кровоизлияний как перед поверхностью сетчатки, так и в полость стекловидного тела. Рецидивирующие кровоизлияния, рубцевание задних отделов стекловидного тела ведут к образованию патологических витреоретинальных сращений, которые могут вызвать тракционную отслойку сетчатки.
Современные представления о патогенезе ДР позволяют выделить пять основных процессов в ее развитии:
• формирование микроаневризм;
• патологическая сосудистая проницаемость;
• сосудистая окклюзия;
• неоваскуляризация и фиброзная пролиферация;
• сокращение фиброваскулярной ткани и стекловидного тела.
Несколько слов о скрининге ДР. Точнее, о начале и периодичности осмотров больных СД офтальмологом, как этого требует последняя версия КР. Хотя подобный скрининг выполняет офтальмолог, однако состояние глаз пациента с диабетом—зона ответственности и эндокринолога тоже. Внедрение скрининговых программ имеет принципиальное значение для профилактики слепоты и слабовидения вследствие диабетического поражения глаз. Идеальный метод скрининга ДР и ДМО—стереоскопическое фотографирование стандартных полей сетчатки и оценка состояния макулярной зоны с помощью оптической когерентной томографии (ОКТ).
При СД 1-го типа риск развития ДР в течение первых 5 лет незначителен. Поэтому первый осмотр пациента офтальмологом следует провести не позднее чем через 5 лет от дебюта заболевания.
В связи с отсутствием острого начала и другими особенностями СД 2-го типа в течение ряда лет он может оставаться недиагностированным, что значительно увеличивает риск ДР. Около 20 % больных СД 2-го типа имеют признаки ДР в момент постановки диагноза и должны быть сразу осмотрены офтальмологом.
Беременность ассоциируется с риском быстрого прогрессирования ДР при СД 1-го и 2-го типа. Поэтому офтальмологическое обследование женщин с СД, которые хотели бы стать мамами, нужно проводить на этапе планирования беременности, в первом ее триместре и далее каждые 3 месяца. Также необходимо пройти офтальмологический осмотр на первом году после родов. Зато женщины с гестационным СД, где риска развития ДР практически нет, не нуждаются в скрининге ДР.
Офтальмологическое обследование детей должно начинаться с 11-летнего возраста при длительности заболевания СД 1-го типа более 2 лет или с началом пубертата при длительности СД более 2 лет. Последующие осмотры при СД 1-го и 2-го типа у взрослых и детей проводятся в соответствии со стадией ДР, но не реже чем раз в год.
ПУТЬ ПАЦИЕНТА
«Путь пациента с диабетической ретинопатией от барьеров к решениям»,—так назвал свое выступление на круглом столе профессор Г.Р. Галстян. По его мнению, сложившаяся практика ведения пациентов с ДМО в системе ОМС далеко не совершенна. На пути больного с ДМО стоят следующие серьезные барьеры:
• недооценка пациентами симптомов заболевания;
• нерегулярность диспансеризаций;
• позднее обращение к офтальмологу;
• отсутствие федерального тарифа ОМС на ОКТ глаз;
• низкая оснащенность ЛПУ аппаратами для ОКТ;
• дефицит как квалифицированных кадров офтальмологов, так и финансирования в рамках системы ОМС;
• отсутствие четкой маршрутизации пациента с ДМО;
• доступность анти-VEGF-терапии только в учреждениях 2-го или 3-го уровня;
• отсутствие заинтересованности государственных ЛПУ в проведении всего курса такого лечения после нескольких первых инъекций, вследствие чего на плечи желающих получить антиVEGF-терапию в полном объеме нередко ложится тяжелое финансовое бремя, что становится причиной низкой приверженности лечению значительной части больных;
• низкая приверженность терапии в связи с большим объемом повторных исследований, без которых невозможно оформить повторную госпитализацию для последующих интравитреальных инъекций.
В связи с ограничением доступности исследований по полису ОМС заметно страдает своевременность диагностики ДМО, которую могут получить бесплатно лишь половина (52 %) пациентов, частично бесплатно — 31 %, платно—11 %. А 3,8 % исследований недоступны пациентам даже на коммерческой основе! В день обращения диагноз ДМО ставится только 37 % больных, в срок до двух недель—30 %, дольше—32 %. Чаще всего (в 54 % случаев) пациенты сами оплачивают ОКТ до начала лечения, в 25 % случаев они делают это в ходе терапии, а в 12 % случаев лабораторные анализы для госпитализации доступны больным только платно. Отказы в бесплатном анти-VEGF-лечении они получают лишь в 0,8 % случаев, лазерная коагуляция сетчатки производится бесплатно только в 76 %, а интравитреальные инъекции глюкокортикостероидов—в 38 % случаев.
Отдельная проблема связана с тем, что 40 % пациентов вынуждены получать инъекции анти-VEGF-препаратами в круглосуточном стационаре. Чуть меньше (а именно 38 %) больных лечатся подобным образом в дневном стационаре, и только 22 %—амбулаторно, что более удобно для них. Причем перед каждой госпитализацией человек, как уже говорилось, обязан сдать множество анализов, даже если он выписался из больницы всего месяц назад. Пациентам затруднительно каждый месяц собирать анализы, брать направления. Выписавшись из стационара, они уже через 2 недели вынуждены снова обходить все инстанции. Естественно, это тяжело для людей со сниженной остротой зрения и другими проблемами со здоровьем. В итоге приверженность анти-VEGF-терапии оказывается удручающе низкой: 57 % больных прерывают ее, даже если она бесплатная.
Для решения этих проблем необходимо совершенствовать нормативную базу (КР, стандарты лечения, порядки проведения профилактических и реабилитационных мероприятий). Гагик Радикович предложил внести ОКТ в число обязательных процедур для диагностики и мониторинга состояния пациента, в критерии качества оказания медицинской помощи.
Также необходимы:
• тарификация исследований ОКТ согласно стандартам лечения;
• уточнение в нормативных документах длительности и регулярности лечения с использованием интравитреальных инъекций;
• создание отдельного регистра пациентов с ДР и ДМО (с возможностью сохранения изображений глазного дна и макулы в цифровом формате).
Следует расширять и диагностические возможности офтальмологической службы, в частности:
• увеличить число аппаратов для ОКТ, в том числе с режимом ангиографии в крупных медицинских организациях;
• шире использовать фоторегистрацию глазного дна;
• внедрить массовые скрининговые системы с применением искусственного интеллекта и специального оборудования, которое может использовать средний медицинский персонал, по специальным тарифам.
ПОДХОД К ЛЕЧЕНИЮ
Сказанное профессором Г.Р. Галстяном о многочисленных недостатках ведения больных с ДМО продолжил доктор медицинских наук Д.В.Липатов. Дмитрий Валентинович подчеркнул, что несоблюдение режима анти-VEGF-терапии ведет к ее недостаточной результативности и необоснованным расходам государства и пациентов. По данным многочисленных клинических исследований, для оптимального результата необходимы 7–10 инъекций в год. А в нашей стране в пересчете на одного пациента с ДМО ежегодно выполняется только 2,15 условной инъекции. А ведь современная анти-VEGF-терапия в корне изменила подход к борьбе с заболеваниями сетчатки у пациентов с СД. При этом все еще остаются возможности изучения дополнительных путей патогенеза, а значит, и создания инновационных препаратов для антиангиогенной терапии.
Эволюция зарегистрированных в РФ анти-VEGF-лекарств выглядит следующим образом. В 2012 году был одобрен первый анти-VEGF-препарат ранибизумаб, представляющий собой фрагмент гуманизированного антитела (АТ) к эндотелиальному фактору роста сосудов. Ранибизумаб избирательно связывается с VEGF-А, предотвращая его взаимодействие с рецепторами на поверхности клеток эндотелия. В результате подавляется неоваскуляризация и пролиферация таких клеток.
В 2016 году Минздравом России был одобрен афлиберцепт. Этот рекомбинантный белок действует как растворимый рецептор-ловушка. Он связывает уже не только VEGF-А, но и плацентарный фактор роста, причем с более высокой аффинностью, чем их естественные рецепторы. Таким образом, это лекарство существенно ингибирует связывание и активацию VEGF-рецепторов.
В 2022 году Минздрав одобрил бролуцизумаб, фрагмент гуманизированного АТ, который является его наименьшей функциональной единицей. Это позволяет вводить в одной дозе больше молей вещества, чем при применении зарегистрированных ранее АТ к VEGF-А, и к тому же с потенциальной возможностью более длительного действия, более высокой пенетрацией в ткани. Бролуцизумаб с высокой аффинностью связывается с целым пулом различных изоформ VEGF-А, тем самым препятствуя взаимодействию VEGF-А сразу с несколькими его рецепторами. Эти три средства одобрены Минздравом России и включены в КР-2023 по ведению больных с ДР и ДМО. Также в январе 2023 года в нашей стране был одобрен и уже продается в аптеках, хотя еще и не включен в КР, фарицимаб, препарат анти-VEGF-терапии нового поколения. Он представляет собой гуманизированное биспецифическое АТ, ингибирующее два различных пути, нейтрализуя ангиопоэтин Ang-2 и VEGF-А. Ангиопоэтины—это белковые факторы роста, стимулирующие ангиогенез. В результате гиперпродукции Ang-2 снижается стабильность сосудов, что способствует дестабилизации эндотелия, потере клеток перицитов и патологическому ангиогенезу. Тем самым эти молекулы усиливают транссудацию и воспаление. Ang-2 также повышает чувствительность кровеносных сосудов к VEGF-А с их дальнейшей дестабилизацией. Ang-2 и VEGF-A отличаются синергизмом действия в отношении увеличения проницаемости сосудов и стимуляции неоваскуляризации.
Двойное ингибирование Ang-2 и VEGF-A фарицимабом снижает проницаемость сосудов и воспаление их стенок, подавляет патологический ангиогенез и восстанавливает стабильность сосудов. Блокируя оба пути, Ang-2 и VEGF-A, фарицимаб стабилизирует сосуды в большей степени, чем препараты, ингибирующие только VEGF-A.
Долгосрочная эффективность и безопасность фарицимаба подтверждена данными крупных глобальных исследований YOSEMITE и RHINE (2020–2021), выполненных при участии 1891 пациента с ДМО (в том числе 38 больных из семи офтальмологических центров России). Работы продемонстрировали стойкое двухлетнее улучшение зрения под влиянием терапии фарицимабом. Так, были получены сопоставимые результаты улучшения максимально корригированной остроты зрения при использовании фарицимаба, вводимого один раз каждые 16 недель, по сравнению с афлиберцептом, вводимым однократно каждые 8 недель. Более высокие функциональные результаты терапии фарицимабом по сравнению с афлиберцептом обусловлены более существенным уменьшением толщины центральной зоны сетчатки и отсутствием интраретинальной жидкости. Таким образом, пациентам с СД необходимы своевременный скрининг и регулярные осмотры у эндокринолога и офтальмолога. А сами ДМО и ДР требуют устойчивого и эффективного лечения, чтобы снизить нагрузку на пациентов и систему здравоохранения в целом. Использование новых методов терапии и механизмов воздействия на патологический процесс (блокирование двух путей патогенеза) ведет к ангиостабилизации. Это позволяет улучшить краткосрочные и отдаленные результаты лечения и обеспечить адекватный контроль за активностью заболевания при более редких инъекциях.

Александр Рылов, к.м.н.
Читайте также
- Сахарный диабет 2‑го типа и хроническая сердечная недостаточность: диагностика и лечение на амбулаторном этапе
- Действуем сегодня ради лучшего завтра
- Ключевые обновления в российских клинических рекомендациях по остеопорозу
- Инсулиномы: такие разные, но в то же время такие одинаковые
- Дефицит андрогенов у мужчин с инсультами: известное и неизвестное
- Организация вакцинации против пневмококковой инфекции пациентов с сахарным диабетом в Москве

















