Статьи
Эффективность моноклонального антитела пролголимаб при терапии метастатической меланомы: клиническое исследование MIRACULUM
В июне 2021 г. на сателлитном симпозиуме VII Петербургского международного онкологического форума «Белые ночи» российские и зарубежные эксперты представили результаты клинического исследования MIRACULUM — оценку 3-летней эффективности оригинального иммуноонкологического препарата пролголимаб при метастатической/неоперабельной меланоме. Результаты исследования опубликованы в апрельском выпуске Европейского онкологического журнала (European Journal of Cancer, EJC).
ЛУЧ НАДЕЖДЫ
На меланому приходится наибольшее число летальных исходов среди злокачественных новообразований (ЗНО) кожи. В последние 10 лет пациентов с этим диагнозом стало на 40 % больше. В одном только 2019 г. зарегистрировано свыше 11 тыс. новых случаев. Значительным достижением в борьбе с болезнью стала возможность блокировать иммунные контрольные точки (ИКТ) посредством ингибирования рецептора программируемой клеточной смерти 1-го типа PD-1 или его лиганда PD-L1. Применение терапевтических моноклональных антител (МКАТ) к PD-1, включая пембролизумаб и ниволумаб, способствовало существенному улучшению прогноза при распространенной меланоме. Лекарственные препараты данной группы занимают ведущее место в лечении рассматриваемой онкологической патологии.
ЧТО НОВОГО В МОЛЕКУЛЕ
Разработанный биотехнологической компанией BIOCAD пролголимаб (раннее название — ВCD-100) входит в группу ингибиторов PD-1. В отличие от аналогов он создан на основе изотипа иммуноглобулина IgG1 модифицированным генно-инженерным способом с Fcфрагментом, содержащим молчащую мутацию LALA — двойную замену лейцин → аланин в позициях 234 и 235. Благодаря ей пролголимаб не связывается с макрофагальными Fcγрецепторами, что позволяет защищать популяцию активированных Т-лимфоцитов от потенциального антителозависимого клеточного фагоцитоза (АЗКФ) макрофагами с усилением противоопухолевого эффекта.
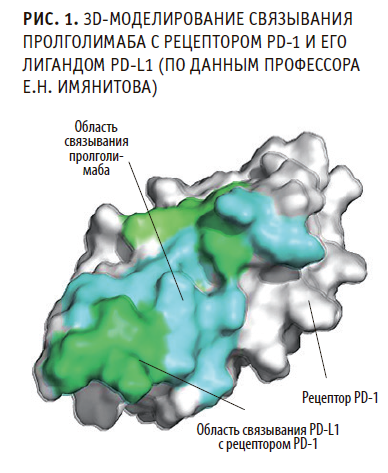 Важнейшая отличительная черта новой улучшенной молекулы заключается в способности блокировать одновременно оба (а не один из двух, как в случае IgG4-антител — ниволумаба и пембролизумаба) сайта связывания (эпитопа) лиганда PD-L1 с одноименным рецептором (рис. 1). Такой биофармакологический феномен стал возможен благодаря иному строению Fab-фрагмента. В результате достигается более высокая насыщаемость PD-1- рецепторов.
Важнейшая отличительная черта новой улучшенной молекулы заключается в способности блокировать одновременно оба (а не один из двух, как в случае IgG4-антител — ниволумаба и пембролизумаба) сайта связывания (эпитопа) лиганда PD-L1 с одноименным рецептором (рис. 1). Такой биофармакологический феномен стал возможен благодаря иному строению Fab-фрагмента. В результате достигается более высокая насыщаемость PD-1- рецепторов.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Клиническое исследование (КИ) MIRACULUM проходило с августа 2017 по февраль 2019 г. в 21 исследовательском центре. Дизайн разработан спонсором — компанией BIOCAD, осуществлявшей также сбор и анализ данных. Это первое исследование II фазы, посвященное изучению ингибитора PD-1 на основе IgG1 c модифицированной Fc-молчащей областью. В публикации EJC представлены окончательный анализ результатов по истечении 1 года наблюдения и дополнительная оценка эффективности на протяжении 2-летнего периода.
В протокол вошли 126 пациентов старше 18 лет из России и Белоруссии с неоперабельной/метастатической меланомой II–IV стадий. Все они ранее:
- не получали лечения или получили ≤2 линий системной химиотерапии (ХТ);
- не подвергались таргетной терапии (ингибиторами BRAF/MEK либо другими ингибиторами тирозинкиназы), а также назначению анти-PD-1-/анти-CTLA-4-препаратов;
- характеризовались соматическим статусом 0–1 балл по шкале ECOG;
- не страдали аутоиммунными заболеваниями.
Доля участников, ранее леченных в связи с распространенным процессом, по условию КИ должна была составлять не более 30 %. После рандомизации на две равные группы (n = 63) в 1-й группе она оказалась 27 %, во 2-й — 25,4 %, так что данное условие было соблюдено. Критериям включения удовлетворяли в том числе больные с метастазами в ЦНС (головной мозг) на фоне стабильного течения и с некожными формами меланомы. Кроме того, в КИ вошли 8 человек с вовлечением роговицы, характеризующимся практически полным отсутствием ответа на любой вид системного лечения.
Важно подчеркнуть, что исследуемые в целом относились к категории неблагоприятного прогноза. Почти у половины из них статус по ECOG составлял 1 балл, более чем у трети больных определялся повышенный уровень активности ЛДГ, около 25 % ранее получали ≥1 линию предшествующей системной терапии по поводу распространенного заболевания, и, наконец, ~20 % имели метастазы в головной мозг.
В рамках КИ все пациенты получили ≥1 внутривенное введение пролголимаба — 1мг/кг массы тела (МТ) 1 раз в 2 недели (1-я группа) или 3мг/кг МТ 1 раз в 3 недели (2-я группа). Режимы дозирования выбирались на основании результатов фазы I и фармакокинетического моделирования. Межгрупповые демографические и исходные клинические характеристики участников были сбалансированы. Доли испытуемых, ранее не получавших/получавших лечение, составили 73,0/27,0 % в 1-й и 74,6/25,4 % во 2-й группе соответственно. Значимых различий исходного размера опухоли (ИРО) между группами не выявлено.
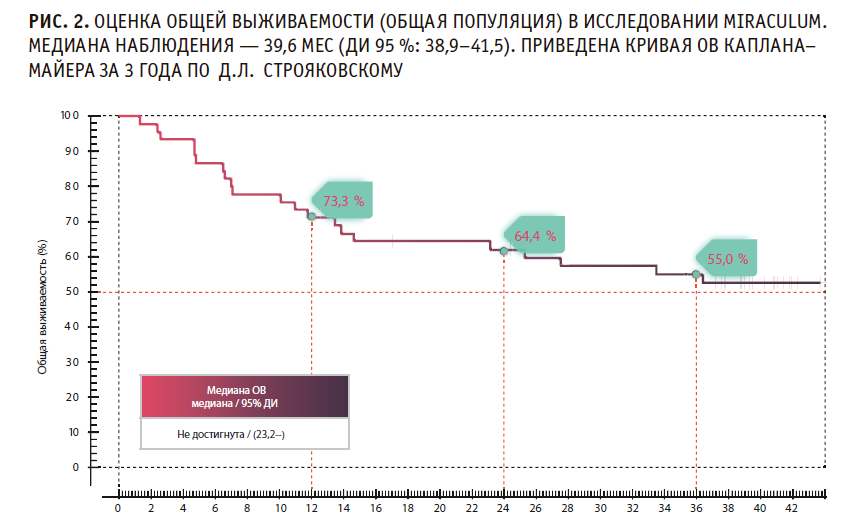
На момент закрытия базы данных по истечении 1 года первичная конечная точка (ПКТ) достигнута в обеих группах. Это продемонстрировало достижение объективного ответа (ОО) на фоне монотерапии пролголимабом у 42 из 126 пациентов с распространенной меланомой, получивших ≥1 дозу препарата. Медиана наблюдения оказалась равной 39,6 мес (95 % ДИ: 38,9–41,5). 3-летняя общая выживаемость (ОВ) пациентов с метастатической меланомой, получавших пролголимаб в режиме 1мг/кг 1 раз в 2 недели, составила 43,1 %, медиана ОВ — 26,1 мес (95 % ДИ: 18,3 — НД (не достигнута)). ОВ у пациентов с метастатической меланомой кожи, получавших препарат в 1-й линии терапии, составила 55 %, при этом медиана показателя не достигнута (95 % ДИ: 23,2 — НД).
Согласно данным подгруппового анализа, среди лиц с мутацией в гене BRAF 3-летняя ОВ была равной 46,7 %, а медиана ОВ — 14,7 мес (95 % ДИ: 7,0 — НД); у пациентов без мутации ОВ составила 69,6 % на фоне отсутствия достижения медианы этого показателя. У больных с метастазами в ЦНС ОВ составила 40 % при медиане 19,6 мес (95 % ДИ: 7,1 — НД), без метастазов — ОВ равнялась 60,2 %, медиана не достигнута (95 % ДИ, 27,6 — НД).
Хотя дизайн протокола не предполагал прямого сравнения, оба режима дозирования пролголимаба продемонстрировали эффективность, сходную с таковой у других МКАТ к PD-1/PD-L1 при распространенной меланоме. В большинстве случаев ответ имел стойкий характер, сохраняясь на момент закрытия базы данных по истечении 2 лет наблюдения независимо от клинической группы.
Показана тенденция к меньшей частоте ОО и ОВ в группе с режимом дозирования 3мг/кг МТ, что потенциально может быть обусловлено существенными межгрупповыми различиями по параметру ИРО. Установлено, что ИРО выступает в качестве независимого предиктора ОВ у получавших пембролизумаб пациентов с меланомой, а также оказывает значимое негативное влияние на частоту ОО.
Говоря о ключевых ограничениях MIRACULUM, прежде всего следует отметить относительно небольшой объем выборки и отсутствие группы сравнения, получавшей альтернативную терапию. Результаты более длительного наблюдения с включением контрольной группы больных ожидаются в ходе продолжающихся испытаний III фазы у пациентов с распространенным немелкоклеточным раком легкого (НМРЛ) и раком шейки матки (РШМ). Еще одно ограничение — использование ПКТ, не характеризующей такой параметр, как выживаемость. Тем не менее нужно констатировать, что частота ОО позиционируется в качестве ПКТ в исследованиях II фазы ингибиторов ИКТ (включая МКАТ к PD-1/PD-L1). Кроме того, несмотря на относительно малый размер выборки для ретроспективного подгруппового анализа, ОО регистрировался во всех терапевтических группах.
Вне зависимости от ограничений оба режима дозирования продемонстрировали клиническую активность в группе неблагоприятного прогноза. ОО получен в том числе у участников с метастазами в головной мозг (8 из 26 пациентов) и среди имеющих PD-L1- негативные опухоли (4 из 26).
ПРОФИЛЬ БЕЗОПАСНОСТИ
Что касается изучения профиля безопасности, то оно не выявило нежелательных явлений (НЯ), ранее не встречавшихся при применении препаратов этого класса. Большинство НЯ проявились в первые 6 мес применения пролголимаба. В ходе исследовательского протокола не получено новых сведений относительно безопасности в сравнении с предыдущими публикациями, которые посвящены другим анти-PD-1-препаратам. Большая часть зарегистрированных НЯ, связанных с лечением, относилась к 1–2-й степени тяжести, что свидетельствовало о приемлемом профиле безопасности пролголимаба при распространенном поражении. Только 2 участника вышли из исследования по причинам, связанным с терапией НЯ. Ни один из имевших место летальных исходов не был расценен как обусловленный токсичностью препарата.
Вопрос о том, действительно ли терапевтические МКАТ к PD-1/PD-L1 с молчащей эффекторной функцией, включая антителозависимый клеточный фагоцитоз, опосредованный перекрестным связыванием с Fcγ-рецепторами, обладают преимуществами по сравнению с традиционными IgG4-препаратами (пембролизумаб и ниволумаб), будет продолжать изучаться.
Показатели ОВ в общей популяции больных с метастатической меланомой кожи, получавших пролголимаб в первой линии терапии, по результатам исследования MIRACULUM представлены на рис. 2.
ГЛАВНЫЕ ВЫВОДЫ
При непрямом сравнении популяция рассматриваемого КИ как по общесоматическим критериям, так и по распространенности опухоли и предлеченности больных была значительно хуже по сравнению с таковой в ходе изучения зарубежных ранее зарегистрированных ИКТ. Тем не менее в ходе работы получены данные
Пролголимаб продемонстрировал биологические преимущества in vitro в сравнении с другими IgG4 ИКТ. Таким образом, МКАТ с мутацией LALA может обладать более высоким терапевтическим потенциалом при лечении меланомы. Особенно важно, что новый лекарственный препарат показал значимо лучшую эффективность по сравнению со стандартной терапией другими ингибиторами PD-1/PD-L1 (пембролизумаб, ниволумаб) именно у пациентов с неоперабельной/метастатической (распространенной) меланомой, имеющих резистентность к стандартной терапии и, соответственно, — неблагоприятный прогноз. При этом эффект пролголимаба отмечен во всех клинических группах вне зависимости от мутации в гене BRAF и наличия метастазов в ЦНС.
К настоящему времени в отношении пролголимаба запущена программа FORA RWE (Real World Evidence — система получения доказательств в условиях рутинной клинической практики) с проспективным сбором данных по его применению в клинической практике. Можно констатировать весьма хорошую переносимость пролголимаба, подтверждаемую онкологами на основании имеющегося опыта назначения препарата.
Результаты КИ получили одобрение со стороны зарубежных специалистов. В частности, д-р Александр Эггермонт (Alexander M.M. Eggermont), профессор Университетской клиники Утрехта и главный редактор EJC, высоко оценил данные протокола, назвав их обнадеживающими и демонстрирующими эффективность несколько большую по сравнению с аналогичными веществами. «Мы видим 3-летние данные и наблюдаем устойчивый глубокий ответ, — сказал ученый. — Налицо абсолютное совпадение результатов первого, второго и третьего года наблюдения».
- Применение пролголимаба в 1 линии лечения в минимальном режиме дозирования (1мг/кг массы тела каждые 2 недели) позволило достичь:
- 3-летней общей выживаемости 43 % во всей популяции пациентов (метастатическая меланома, включая некожные локализации);
- 3-летней общей выживаемости 55 % в популяции пациентов с меланомой кожи (1 линия терапии).
- Эффект пролголимаба отмечен во всех клинических группах больных меланомой независимо от наличия мутации в гене BRAF и метастазов в ЦНС.
- Появление первого российского анти-PD1-препарата пролголимаба позволит значительно увеличить доступность иммунотерапии для пациентов с меланомой, в том числе имеющих неудовлетворительный прогноз.
БОЛЬШИЕ ПЕРСПЕКТИВЫ
Появление отечественного высокотехнологичного лекарственного средства — всегда значимое событие. В случае пролголимаба все этапы разработки заняли сравнительно небольшой срок (около 7 лет). Зарубежные публикации и позитивные оценки иностранных экспертов свидетельствует о высоком качестве и актуальности результатов работы российских ученых. В 2020 г. препарат зарегистрирован в РФ для лечения неоперабельных и метастатических форм меланомы у взрослых (в минимальном режиме дозирования 1мг/кг МТ 1 раз в 2 недели).
Помимо собственно фармакологических качеств одним из значительных преимуществ пролголимаба должна стать его доступность для российских пациентов. Включение нового средства в список ЖНВЛП и программу высокозатратных нозологий (ВЗН) позволит уменьшить нагрузку на бюджет здравоохранения.
Существующая программа исследований пролголимаба включает КИ у пациентов с меланомой, НМРЛ и РШМ. Предстоит изучить действие препарата в составе комбинаций иммуноонкологических средств при ряде других типов ЗНО. Перспективными могут стать исследования, посвященные сравнению эффективности пролголимаба и еще одного представителя класса ингибиторов PD-1/PD-L1 — атезолизумаба. Следует думать, что в ближайшем будущем новое средство войдет в состав схем двойной и тройной комбинированной терапии пациентов с нерезектабельной/метастатической меланомой, в том числе при неудовлетворительном прогнозе. Кроме того, официально объявлено о планах вывода медикамента на европейский рынок.
Юрий Никулин, к. м. н.
Читайте также
- Мы снова всех опередили, но вот в чем?
- Комбинированная иммунотерапия метастатического рака почки
- Новые возможности лечения больных неметастатическим кастрационно- резистентным раком предстательной железы
- Хавьер Кортес: о новых трендах и лечении рака молочной железы в Испании
- Московский онкологический форум — знаковое событие столичного здравоохранения
- «Мы здесь не из-за денег». Медицина в XXI веке: бизнес или предназначение?
- Генетическая панель РАМ-100 — новая идеология в молекулярной диагностике рака молочной железы
- Первичная профилактика фебрильной нейтропении при химиотерапевтическом лечении

















