Статьи
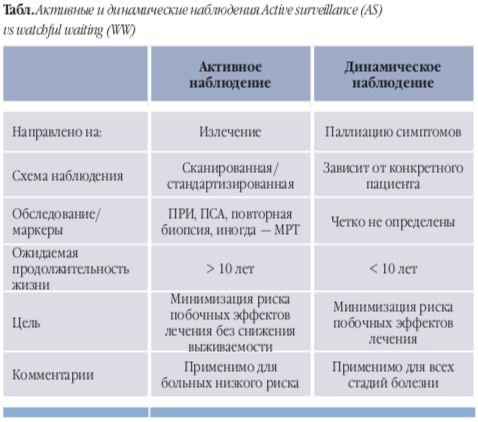
Энтузиазм и опасения активного наблюдения
— Мы должны научиться выбирать пациентов, для которых активное наблюдение станет еще более активным, и выделять тех, кому можно минимизировать его бремя, — отметил в интервью УС профессор Б. Томбаль, обозначая основной вектор развития в тактике АН.
После завершения исследования ProtecT одновременно возросли и энтузиазм, и опасения: по показателю 10-летней канцер-специфичной выживаемости наблюдение оказалось столь же эффективным, как и лечение. Однако без лечения частота метастазирования увеличивается вдвое (6% vs 2–3%); клиническое прогрессирование также гораздо чаще наблюдалось в группе наблюдения (23% vs 9%).
Разумно предположить, что при более длительном наблюдении выявится и расхождение по показателю канцер-специфичной выживаемости. Однако это гипотеза. В целом же данные по активному наблюдению, длящемуся 20 лет и более, малочисленны и часто противоречивы. Поэтому и основной вопрос научного сообщества таков: как наблюдать так, чтобы после не сокрушаться? И как выявить тех, за кем надо наблюдать активнее активного?
Биопсия во время АН
Протокол ProtecT мировые эксперты называют «наблюдением низкой активности» — он не предусматривал проведения биопсий простаты через определенные временные интервалы. «Проведение биопсий в процессе наблюдения могло смягчить риски прогрессирования и метастазирования», — считают Fuad F. Elkhoury с соавторами [1]. И вряд ли с этим мнением возможно спорить.
Современные достижения, коснувшиеся в частности визуализации и биопсии, позволяют разрешить многие спорные вопросы как на этапе назначения лечения/наблюдения, так и при самом наблюдении.
— В ProtecT за пациентами следили только по показателю ПСА, но в настоящее время существует множество возможностей более внимательно и точно фиксировать динамику заболевания, и эти возможности надо использовать, — продолжает проф. Б. Томбаль.
В текущем году Chang и соавторы опубликовали данные по оценке ценности так называемых отслеживающих биопсий (tracking biopsies) — то есть изучения биоптата, забранного из той же точки опухоли, что и при первичной биопсии. Всего в протокол вошло 352 пациента, находящихся под активным наблюдением, у которых по данным предшествующей фьюжн-биопсии был обнаружен РПЖ низкого или промежуточного риска. Спустя год после включения в протокол АН пациентам была проведена систематическая биопсия простаты и фьюжн-биопсия из отслеживаемых опухолевых очагов[2].
Всего т. н. апгрейдинг группы риска РПЖ был зафиксирован у 91 пациента, более чем у половины из них — только благодаря отслеживающей биопсии. Авторы отмечают, что у 23% мужчин с РПЖ промежуточного риска в ходе этого исследования был обнаружен РПЖ >4+3, в результате чего они были исключены из протокола АН.
«Отслеживающая биопсия увеличивает эффективность и безопасность АН, позволяя исключить пациентов, более не подходящих для АН», — заключили авторы исследования.
Прецизионность такого подхода в текущем году подтвердили Palapattu с сооавторами, проведя молекулярный анализ биоптатов при первичной и повторной фьюжн-биопсии, проведенной через год [3]. Ученые показали, что 96% биоптатов содержат те же самые клоны клеток. И хотя исследование включило всего 26 больных РПЖ низкого риска, все же результаты молекулярной диагностики заслуживают доверия и позволяют говорить о высокой точности «слежения» за раком.
Биопсия до начала АН
— До недавнего времени результаты рандомной биопсии считались достаточными для выбора тактики активного наблюдения, — отмечает И. И. Абдуллин. — Однако почти 30% пациентов, находившихся под активным наблюдением, позже потребовалось лечение. Наиболее частой причиной смены тактики ведения больного является выявление более агрессивного рака. Эти цифры очень близки к цифрам upgrade у пациентов с суммой по Глисону 6 баллов после радикальной простатэктомии. По мнению И. И. Абдуллина, объясняет отмеченную тенденцию не то, что опухоль становится более злокачественной, а банальное невыявление более злокачественного очага при первичной биопсии.
В 2016 году American Urological Association приняла консенсусное мнение, согласно которому при отрицательной первой биопсии и сохранении подозрения на наличие опухоли последующие биопсии должны быть проведены в режиме фьюжн.
— Я думаю, что в ближайшее время будет принято аналогичное решение о том, что активное наблюдение может предлагаться только по результатам фьюжн-биопсии, — считает И. И. Абдуллин.
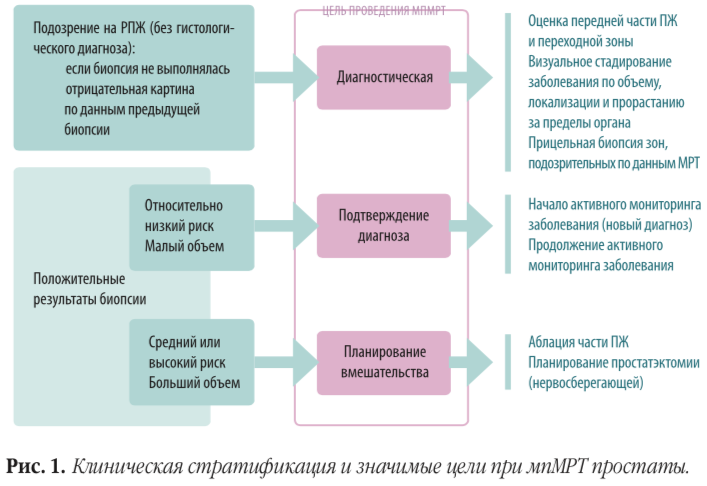
Переходный этап — рутинное применение мпМРТ для отбора пациентов, что уже сейчас многими экспертам рассматривается как допустимая опция.
— Рекомендации не дают четкого ответа на вопрос о роли мпМРТ, — говорит А. В. Говоров. — Я считаю, что выполнять МРТ при отборе пациентов для АН необходимо, но достаточная доказательная база по этой проблеме отсутствует.
И, опять же, назначая потенциальному кандидату для АН МРТ, мы должны быть уверены, что специалист лучевой диагностики хорошо понимает цель назначенного исследования и оценит состояние простаты должным образом с использованием шкалы PIRADS. К сожалению, большинство врачей лучевой диагностики к этому пока не готовы. По опыту российских экспертов, не всегда специалисты лучевой диагностики даже знакомы со шкалой PIRADS.
С четвертым компонентом
— Одно из наиболее значимых изменений в тактике АН и актуальный тренд — это возможность применения у пациентов промежуточного риска с суммой Глисона 7 (3+4), — считает И. И. Абдуллин. — В ряде исследований продемонстрировано, что у пациентов этой группы вероятность перехода к лечению не выше, чем среди пациентов низкого риска.
С 2016 и 2017 гг. в соответствии с рекомендациями American Urological Association, Society of Urologic Oncology, American Society for Clinical Oncology и National Comprehensive Cancer Network тактика активного наблюдения считается допустимой и приемлемой в группе пациентов промежуточного риска [4,5].
— Это возможно, — говорит в беседе с УС А. В. Говоров. — Но, говоря о российских пациентах, я категорически против включения в протоколы активного наблюдения больных промежуточного риска, что в немалой степени связано с проблемами адекватности патоморфологической оценки, постановки верного диагноза и последующего наблюдения.
Стоит отметить, что не единичны работы, в которых актуализируется именно проблема оптимального протокола наблюдения и применения дополнительных методов исследования при АН за пациентами промежуточного риска. Так, Patel HD с коллегами (2017) показали, что у четверти из 608 мужчин с диагнозом РПЖ промежуточного риска и небольшим объемом простаты при проведении немедленной простатэктомии обнаружены неблагоприятные характеристики опухоли, в том числе экстракапсулярная инвазия [6].
Опасения высказывают и Musunuru HB с коллегами (2016), подчеркивая, что при 15-летнем периоде наблюдения выживаемость без прогрессирования и канцерспецифическая выживаемость в группе промежуточного риска (ПСА 10–20 нг/мл и/или Глисон 3+4) падают до 82% и 89%, в то время как в группе низкого риска эти показатели остаются на уровне 95% и 97% соответственно [7].
В другом исследовании продемонстрировано, что у пациентов, допущенных по рекомендациям NCCN к АН при наличии показателя Глисона 4 втрое увеличиваются риски развития местно-распространенного заболевания, умножаются риски метастазирования и другие неблагоприятные исходы [8].
Авторы приведенных работ отмечают: АН ассоциировано с риском для больных РПЖ с Глисоном 3+4, поэтому при выявлении показателя Глисона GS4 предпочтительно активное лечение, а не наблюдение. Но одновременно эксперты делают оговорку и о том, что в приведенных исследованиях биопсия проводилась только под контролем УЗИ, что изначально в трети случаев дает ошибочную оценку заболевания [9]. А в работе Patel HD (2017) не была проведена уточняющая биопсия простаты. Поэтому, несмотря на увеличение риска прогрессирования, большинство пациентов с Глисоном 3+4 длительное время находятся в стабильном состоянии и могут оставаться на АН при условии повышенной настороженности со стороны специалистов.
— На мой взгляд, при промежуточном риске активное наблюдение может проводиться только в рамках одобренного и утвержденного клинического исследования, — считает А. В. Говоров. — Какова оптимальная схема такого протокола — предмет отдельной дискуссии.
Без Глисона 4
По мнению А. В. Говорова, в РФ проблематичным остается даже вопрос применения АН для пациентов низкого риска, то есть без наличия показателя Глисона 4. И для РФ включение пациентов в протокол АН — это удел высокоспециализированных центров и опытных онкологов.
В клинических рекомендациях EAU от 2017 г. говорится, что «идеальным кандидатом» для активного наблюдения является пациент с ожидаемой продолжительностью жизни >10 лет, клинической стадией РПЖ Т1–Т2, ПСА ≤ 10 нг/мл, суммой Глисона ≤ 6, у которого при биопсии выявлено ≤ 2 позитивных столбиков, и при этом опухоль занимает ≤ 50% длины любого из пораженных столбиков.
— Я не могу сказать, что в РФ четко соблюдаются даже приведенные выше рекомендации, — отмечает А. В. Говоров. — Далеко не всегда первичная биопсия простаты выполняется правильно, с получением гистологического материала хорошего качества (и в доста-точном количестве), с правильной оценкой суммы Глисона и числа пораженных столбиков. Процентную оценку пораженной опухолью ткани в гистологическом заключении можно встретить крайне редко. При этом достоверный «инструмент» или калькулятор расчета ожидаемой продолжительности жизни российского мужчины также отсутствует, что требует принятия индивидуального решения в каждом конкретном случае.
Именно поэтому, уверен А. В. Говоров, даже наблюдение пациентов низкого риска — удел специализированных центров и опытных специалистов.
— Преждевременным будет введение АН «в массы», даже при условии включения только пациентов низкого риска, — считает А. В. Говоров.
Ссылаясь на опыт клиники урологии МГМСУ им. А. И. Евдокимова, он отмечает, что при выполнении радикальной простатэктомии больным, соответствующим критериям включения в протокол АН, по результатам послеоперационного патоморфологического исследования неблагоприятные характеристики опухоли (сумма Глисона >6, экстракапсулярная инвазия, положительный хирургический край и пр.) имеются более чем у половины пациентов.
В конечном счете важнейшим фактором безопасности и эффективности АН является комплаентность пациентов. Так, по данным Luckenbaugh и соавторов (2017), в течение 2-летнего наблюдения лишь менее трети пациентов следуют протоколу АН, проявляя наибольшую «халатность» в отношении проведения повторных биопсий [10].
Поэтому для распространения АН уверенность должна быть не только в системе здравоохранения, но и в самих пациентах.
Критерии Эпштейна и МРТ
Разработанные много лет назад критерии Эпштейна не утрачивают своей актуальности при первичном отборе пациентов для АН.
— Число российских центров, где выполняется фьюжн-биопсия или проводится МРТ простаты с экспертной оценкой соответствующего уровня, невелико, — объясняет А. В. Говоров. — Поэтому и критерии Эпштейна не уходят из практики.
— Использование мпМРТ-картирования для прицельной биопсии позволяет более точно определить истинный grade опухоли, а также увеличивает число положительных столбиков и процент поражения столбика, — продолжает И. И. Абдуллин.
Однако при проведении таргетной биопсии пациенты, подходящие для АН, могут «выйти за границы дозволенного». Например, количество положительных столбиков может быть больше двух именно из-за прицельного забора биоптата из опухолевого очага. По этой же причине и процентная оценка опухолевого поражения в образце может значительно возрастать.
«Из критериев Эпштейна при внедрении мпМРТ выживает только оценка по шкале Глисона», — считают Fuad F. Elkhoury с соавторами.
К результатам мпМРТ нельзя относиться как к непоколебимой истине, обращают внимание эксперты. Так, имеются данные о том, что определенные структурные элементы/составляющие/компоненты клинически значимого рака менее детектируемы при помощи мпМРТ.
В 2017 году Truong и соавторы показали, что очаги с преобладанием криброзных структур плохо видны при мпМРТ [11].
— Есть исследования, продемонстрировавшие наличие клинически значимого рака в МРТ-негативных зонах, — продолжает И. И. Абдуллин. — В EMC фьюжн- биопсия стала рутинной процедурой, и у ряда пациентов с PI-RADS 5 из патологического МРТ очага было получено заключение «хронический простатит». Аналогичные описания имеются и в литературе.
Имеются и такие примеры, когда у пациента с PI-RADS 4 по данным прицельной биопсии выявляется опухоль с Глисоном 6. Что делать с таким пациентом?
— Ситуация неоднозначная, и в этом случае должны быть оценены возраст пациента, данные ПСА, семейный анамнез, количество забранных столбиков при биопсии, — отвечает А. В. Говоров. — Я считаю, что при наличии двух противоречащих друг другу харак-теристик заболевания мы должны всегда ориентироваться на более неблагоприятный параметр; и я бы пациенту с PIRADS 4 активное наблюдение не предложил.
Заключение
По мнению экспертов, преждевременны оптимистичные ожидания того, что мпМРТ и фьюжн-биопсия полностью вытеснят традиционные методы отбора пациентов и наблюдения за ними.
Пока экспертное сообщество не готово отказываться от рандомной биопсии, но и критерии включения в протоколы АН, как и само АН претерпевают изменения. Основным правилом остается обдуманное и осознанное решение о выборе тактики АН как со стороны врача, так и со стороны пациента.
— Давайте помнить, что мы обсуждаем возможность АН у российских пациентов, у которых в 2016 г. при первичном установлении диагноза РПЖ стадии Т3 и Т4 были выявлены в 42,5% случаев (Каприн А. Д., 2017), — завершает А. В. Говоров. — В Москве ситуация несколько лучше (32,2%), однако эта цифра также далека от показателей, характеризующих эпидемиологию РПЖ в западных странах.
Список литературы находится в редакции.

















