Статьи
Эозинофильные заболевания желудочно-кишечного тракта у детей
Бережная Ирина Владимировна
К.м.н., доцент кафедры педиатрии с курсом поликлинической педиатрии имени Г.Н. Сперанского ФГБОУ ДПО «РМАНПО» Минздрава России, Москва
Скоробогатова Екатерина Владимировна
К.м.н., зав. отделением гастроэнтерологии ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Епифанова Елена Игоревна
Морфолог ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Кошурникова Анастасия Сергеевна
К.м.н., зав. отделением эндоскопии ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Гончарова Людмила Викторовна
Педиатр ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Радченко Елена Равильевна
Гастроэнтеролог ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
ЦИФРЫ ВПЕЧАТЛЯЮТ
Пищевой аллергией (ПА) страдают примерно около 5 % детей и до 3–4 % взрослых. В рамках Национального месяца осведомленности об астме и аллергии в США проводился опрос 2 тыс. взрослых о том, как атопические заболевания влияют на качество жизни американцев сегодня. Оказалось, что 59 % респондентов сталкиваются с атопическими проявлениями, 44 % страдают поллинозом, 12 % — аллергией на шерсть домашних животных, 12–15 % — лекарственной и пищевой аллергией. При этом около 15 % респондентов сообщают о гастроинтестинальных расстройствах в виде болей в животе без четкой локализации, тошноты, рвоты, неустойчивого стула.
В недавнем канадском перекрестном исследовании с анкетированием более 3 тыс. семей выяснилось, что частота ПА только на один продукт составляет более 8 %. Хотя теоретически аллергическую реакцию может спровоцировать практически любая пища, большинство таких эпизодов вызывают коровье молоко, соя, пшеница, яйца, арахис, орехи, плавниковая рыба, моллюски и кунжут. Так, распространенность ПА среди взрослых в регионе Мекка (Саудовская Аравия) составляет 17,5 %. В России же ПА встречается с частотой 6–10 %, а у детей с уже состоявшимся атопическим маршем она возрастает до 30–35 %. Дети с бронхиальной астмой (БА) страдают ПА в 4–8 % случаев. Примерно у половины пациентов с ПА часто возникают аллергические реакции с острыми респираторными симптомами.
ПА может протекать по немедленному типу в виде острых анафилактических реакций с потенциально фатальными последствиями. Так, например, по данным британской прессы, в 2018 году зафиксировано два случая смерти подростков от употребления в пищу кунжута и орехов. В Австралии от острой анафилактической реакции на молоко умерла шестилетняя девочка до приезда скорой медицинской помощи. Чаще всего ПА протекает по IgE-неопосредованному типу, ее клинические проявления неспецифичны, что затрудняет своевременную диагностику и начало терапии.
В масштабном эпидемиологическом международном исследовании астмы и аллергии у детей (International Study of Asthma and Allergies in Chilhood, ISAAC) астмоподобные симптомы у 6–7-летних участников встречались с частотой от 2,4 до 37,6 % (минимум—в Индии и Индонезии, максимум—в Австралии и Бразилии). Ценность исследования заключается не только в оценке распространенности атопических заболеваний в мире, но и разработке стандартизации критериев диагностики БА, аллергического ринита (АР) и атопического дерматита (АД). Распространенность астмоподобных симптомов у подростков составила от 0,8 до 32,6 % (минимум — в Китае и Индии, максимум — в Австралии, Бразилии, Новой Зеландии, Ирландии и Великобритании). Наибольшая частота атопии дыхательных путей (БА и астмоподобных заболеваний) в развитых странах, включая Россию, объясняется особенностями питания. Исследование ISAAC в нашей стране проходило в нескольких крупных городах (Москва, Томск, Новосибирск). По сведениям департамента мониторинга анализа и стратегического развития здравоохранения Минздрава России, в 2017 году у нас зарегистрированы 262793 ребенка с БА, или 1028,6 случая БА на 100 тыс. детей до 14 лет.
По данным крупного международного исследования Global Asthma Report — 2018, около 1150 человек в мире ежедневно умирают от БА, что сопоставимо со смертностью от малярии (1175). А Международный анализ глобального бремени болезней (Global Burden of Disease, GBD) 2013 года говорит о том, что пациенты с БА не получают адекватного лечения и это приводит к ранней инвалидизации, хотя существуют общепринятые критерии диагностики и терапии.
ЭОЗИНОФИЛЬНЫЕ ПОРАЖЕНИЯ
Данных о распространенности эозинофильных поражений желудочнокишечного тракта (ЖКТ) на фоне атопии и ПА нет. Хотя разрозненные сведения и публикуются, общепринятые критерии постановки диагноза до сих пор отсутствуют, как и регистр этой группы пациентов.
Эозинофильные гастроинтестинальные заболевания (ЭГИЗ)—это воспалительные состояния ЖКТ с эозинофилией тканей и дисфункцией или повреждением конечных органов с грубым нарушением функции, приводящим к инвалидизации. Первичные ЭГИЗ связаны с атопией и другими аллергическими состояниями, а вторичные — с основными системными заболеваниями или гиперэозинофильным синдромом.
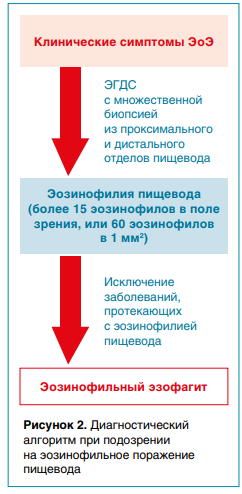
В 2022 году впервые опубликовали согласительный документ при участии 91 мирового эксперта. Эти рекомендации международного консенсуса по номенклатуре ЭГИЗ предлагают разделить эозинофильные поражения ЖКТ по этажам—эозинофильный эзофагит (ЭоЭ), эозинофильный гастрит (ЭоГ), эозинофильный дуоденит (ЭоД), эозинофильный энтерит (ЭоЭт), эозинофильный колит (ЭоК), а кроме того, отказаться от аббревиатуры диагноза «эозинофильный гастроэнтерит». На сегодня это единственный согласительный документ, в котором есть только соглашение по аббревиатуре, но нет консенсуса по количеству эозинофилов для постановки диагноза.
В спектре ЭГИЗ ЭоЭ наиболее распространен и изучен. ЭоГ, ЭоЭт и ЭоК встречаются относительно редко. Эозинофильная инфильтрация печени, желчного дерева и (или) поджелудочной железы также может возникать, имитируя другие воспалительные и злокачественные состояния. Однако истинная распространенность эозинофильных поражений ЖКТ до настоящего момента неизвестна из-за недостаточной диагностики и отсутствия общепризнанных критериев постановки диагноза.
Первичные ЭГИЗ представляют собой гетерогенную группу расстройств, характеризующихся эозинофильным воспалением при отсутствии известных причин эозинофилии, избирательно поражающих различные сегменты ЖКТ. В то время как детский ЭоЭ является заболеванием с четким определением с установленными рекомендациями, ЭоГ, ЭоЭт и ЭоК остаются клинической загадкой, подтверждения которой основаны на ограниченном числе описанных случаев. Крупные перекрестные исследования в США выявляют распространенность ЭоГ и ЭоЭт в диапазоне от 1,5 до 6,4 и от 2,7 до 8,3 на 100 тыс. человек соответственно, в то время как распространенность ЭоК колеблется от 1,7 до 3,5 на 100 тыс.
ЭГИЗ возникают в результате комплексного воздействия факторов генетической предрасположенности и окружающей среды, а также дисбактериоза кишечника. Клинически ЭГИЗ может проявляться различными и неспецифическими желудочно-кишечными симптомами в зависимости от пораженного участка ЖКТ и глубины распространения эозинофильного воспалительного инфильтрата.
Диагностика ЭГИЗ основана на:
- повторяющихся желудочно-кишечных симптомах;
- увеличении числа эозинофилов при высокой мощности поля в образцах биопсии;
- отсутствии вторичных причин желудочно-кишечной эозинофилии.
Единые общепринятые рекомендации по клиническому ведению пациентов с ЭГИЗ пока отсутствуют. Данные клинических разборов и небольших неконтролируемых серий случаев свидетельствуют о пользе диетической коррекции и кортикостероидных препаратов в качестве первой линии терапии. Существуют три различные модели течения ЭГИЗ: впервые выявленная проблема на фоне острого поражения, рецидивирующее и хроническое течение заболевания.
АТАКА НА ПИЩЕВОД
ЭоЭ — наиболее изученное заболевание с эозинофильным повреждением слизистой оболочки пищевода. По данным обзора 2017 года, распространенность ЭоЭ в Европе составляет 1 случай на 2 тыс. человек, однако, учитывая неспецифичность жалоб и недостаточную настороженность специалистов, на начальных стадиях поражения полного обследования не проводится.
Впервые ЭоЭ описали Landres и соавт. в 1978 году у пациентов с дисфагией, но единые консенсусные рекомендации по его диагностике и лечению появились лишь через 29 лет (2007). Это привело к более частому выявлению данной патологии: ЭоЭ сегодня уже не является редким казуистическим диагнозом. Он оказался наиболее частой, если не основной, причиной непроходимости пищи и дисфагии у детей и молодых людей.
Популяционные исследования в Северной Америке и Европе показали, что ежегодная заболеваемость ЭоЭ колеблется от 2,1 случая на 100 тыс. человек в Нидерландах до 12,8 на 100 тыс.— в США. С 2016 года эпидемиология ЭоЭ в среднем оценивается в 7 случаев на 100 тыс. взрослых и 5 — на 100 тыс. детей. Средняя распространенность в популяции— 22,7–30,7 случая на 100 тыс. жителей, что уже выходит за рамки орфанной патологии.
ЭоЭ — эозинофильное воспалительное повреждение пищевода у людей с генетической предрасположенностью, которое сочетает дисфункцию эпителия пищевода и аномальный Т-хелперный иммунный ответ второго типа (Th2) на аллергены окружающей среды и приводит к поражению пищевода и нарушению его моторики с вторичным ремоделированием и фиброзом. Тяжесть течения заболевания зависит от глубины эозинофильной инфильтрации стенки пищевода. Клинические симптомы варьируют от легкой формы дисфагии до полной обструкции просвета пищевода с нарушением глотания и развитием эрозивно-язвенного поражения, приводящими к нутритивной недостаточности и другим тяжелым осложнениям.
ГЕНЕТИЧЕСКИЙ АСПЕКТ
Эозинофильная тканевая инфильтрация развивается не у каждого пациента с атопией, что позволяет говорить о генетической предрасположенности к ЭоЭ. Множественные полногеномные исследования показали, что нет единого локуса, ответственного за развитие заболевания. Большинство идентифицированных генетических локусов влияют на функции эпителиального барьера и Th2-опосредованные иммунные ответы. Генетическую связь проследили у педиатрических пациентов. Оказалось, что у 10 % родителей детей с ЭоЭ были стриктуры пищевода, а у 8 % эозинофильное повреждение пищевода подтверждалось биопсией. При полногеномном секвенировании (GWAS) основная причинно-значимая роль отводилась ассоциации множественных вариантов в локусе стромального лимфопоэтина тимуса (TSLP).
Результаты расширенного GWAS-исследования, включающего 936 случаев и 4312 контролей, выявили четыре новых локуса, связанных с ЭоЭ.
- Ген стромального лимфопоэтина тимуса (TSLP), расположенный в хромосоме 5q22, ассоциирован с аллергической сенсибилизацией, БА и АР. При его мутации нарушается синтез тимического стромального лимфопоэтина, а мутация гена, локализующегося в половых хромосомах Xp22.3 и Yp11, кодирует синтез рецептора к тимическому стромальному лимфопоэтину (TSLPR). Большую распространенность ́ ЭоЭ у мужчин связывают с мутацией гена в половых хромосомах Xp22.3 и Yp11, приводящей к гиперэкспрессии гена TSLP в слизистой оболочке пищевода.
- Десмоглеин-1 (DSG1), подавляемый интерлейкином-13 (IL-13), приводит к дисфункции эпителиального клеточного барьера. DSG1 рассматривают как ключевой трансмембранный белок десмосом, обеспечивающий структурную целостность слоев клеток (сохраняющий плотность межклеточных контактов) за счет филаментов, связывающих их воедино. IL-13 также влияет на хемотаксис эозинофилов и индуцирует эотаксин-3 (CCL26), периостин (POSTN) и ген стромального лимфопоэтина тимуса (TSLP). Генетический полиморфизм контролирующих метаболизм филаггрина (FLG), десмоглеина 1 (DSG1), кальпаина 14 (CAPN14) и даже SPINK 5-го и 7-го типов ассоциирован с нарушением эпителиального барьера слизистой оболочки пищевода и ее интенсивной инфильтрацией эозинофилами у пациентов с ЭоЭ. Доказано, что продукция IL-13 служит пусковым механизмом развития заболевания на фоне активации Т-хелперов 2-го типа и мастоцитов.
- Ингибитор сериновых пептидаз Kazal типа 5 и 7 (SPINK5 и SPINK7) участвует в патогенезе ЭоЭ, влияя на неконтролируемую активность сериновых протеаз.
- Кальпаин-14 (CALPN14)—протеолитический фермент, специфичный для пищевода и индуцируемый IL-13, изменяет ответ DSG1, в результате которого происходит потеря экспрессии DSG1 и нарушение барьерной функции эпителия. В этот каскад включен также FLG в качестве основного эпителиального белка. В процессе выраженного цитокинового ответа при ЭоЭ синтез FLG подавляется. В результате повышенная проницаемость тканей пищевода и поглощение антигена приводят к аномальному Th2-иммунному ответу при участии цитокинов IL-4, IL-5 и IL-13. IL-5— один из ключевых цитокинов, секретируемый Th2-клетками, тучными клетками и эозинофилами, способствует пролиферации, выживанию, активации и хемотаксису эозинофилов. Быстрый рост заболеваемости и распространенности ЭоЭ свидетельствует о первостепенной роли факторов окружающей среды в его патогенезе. Воздействие аллергенов окружающей среды играет важную роль в развитии и обострении ЭоЭ, например, в сезон пыльцы, осенью, в условиях холодного или сухого воздуха.
Примерно у 75 % пациентов с ЭоЭ присутствуют какие-либо атопические проявления. M.A. Ruffner с коллегами продемонстрировали прямую корреляцию между АД, IgE-опосредованной ПА и БА у пациентов с ЭоЭ. У детей с IgE-опосредованной ПА, особенно поливалентной, ЭоЭ развивается в 9 раз чаще, чем у педиатрических пациентов без атопического марша. При пероральной иммунотерапии больных ПА риск развития ЭоЭ возрастает на 2,7–5,3 %. ЭоЭ тесно связан с БА и гиперреактивностью бронхов. Поражение дыхательных путей (ДП) у пациентов с ЭоЭ встречается в 3 раза чаще, чем в группе сравнения, а высокий уровень s-IgE значительно повышает риск поражения ДП у больных с ЭоЭ.
НА ЧТО ОБРАТИТЬ ВНИМАНИЕ
Клинические проявления, особенно в раннем периоде развития ЭоЭ, малоспецифичны. Ребенок раннего возраста может капризничать, отказываться от еды, существует риск нарушения дыхания в виде кратковременного апноэ, задержки физического развития и возникновения дефицитных состояний. Клинические проявления и прогрессирование симптомов ЭоЭ представлены на рисунке 1. Клинические симптомы ЭоЭ малоспецифичны, особенно у младенцев и детей младшего возраста. Поэтому диагноз устанавливается со средней задержкой в 3–5 лет, что увеличивает риск развития фиброза на 5 % с каждым годом промедления.
Существуют опросники для школьников и подростков:
- Долго ли пережевываешь пищу?
- Встаешь из-за стола последним?
- Пьешь много воды во время еды, чтобы облегчить глотание?
- Избегаешь определенные продукты (хлеб, рис или мясо)?
- Режешь еду на очень мелкие кусочки?

КЛИНИЧЕСКИЙ СЛУЧАЙ
Мальчик, 11 лет, госпитализирован с жалобами на снижение аппетита, икоту, слюнотечение, боли в верхнем отделе живота, чаще в ночное время.
Аллергоанамнез не отягощен, проявлений АД, поллиноза и обструктивных приступов не было. Острые респираторные инфекции—1–2 раза в год. Родился путем планового кесарева сечения, с 3 недель жизни находился на искусственном вскармливании стандартной молочной формулой. С полутора месяцев—нарастание срыгиваний, периодов беспокойства, недостаточная прибавка в весе.
Первые проявления дисфагии и отказа от еды — в 8 лет, после перенесенной острой кишечной инфекции. Течение заболевания тяжелое с лихорадкой и рвотой вплоть до развития синдрома Мэллори—Вейса. Получал инфузионную терапию, антибактериальный препарат широкого спектра действия. Выписан с рекомендацией соблюдать диету с исключением фруктов, красных продуктов. Назначен ингибитор протонной помпы на 3 недели.
Далее в течение 3 лет фиксировались неоднократные обращения к специалистам с жалобами на боль при глотании, отказ от некоторых продуктов (не ест мясо и хлеб), обратили внимание на недостаточную прибавку веса. За 3 года дважды госпитализировался в хирургическое отделение, где при проведении комплексного обследования выявлено нарушение пассажа по пищеводу, вплоть до застревания пищи и отказа от еды. Диагноз «рубцовый стеноз пищевода I степени. Эзофагит фибринозный. Дефицитная анемия легкой степени».
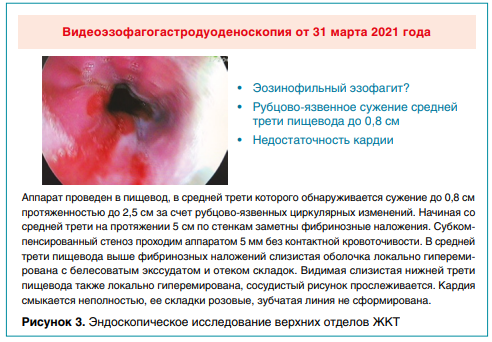
При проведении эзофагогастродуоденоскопии (ЭГДС) в верхней и средней трети пищевода обнаружен густой налет фибрина, видимая слизистая ярко гиперемирована, отечна, с выраженной контактной кровоточивостью, аппаратом непроходима. Проводилось бужирование пищевода до № 40.
Контрольная ЭГДС через 8 дней после первого бужирования пищевода — слизистая очагами ярко гиперемирована. На расстоянии 27 см от зубов пищевод циркулярно сужен, проходим, диаметр стеноза — 1,0–1,2 см протяженностью 2,0–3,0 см.
Выписан с рекомендацией приема антацидного препарата и регулярным бужированием пищевода раз в месяц.
Проблема заключалась в недооценке состояния и отсутствии настороженности по развитию ЭоЭ у ребенка с неотягощенным аллергоанамнезом, не было проведено морфологическое исследование в биоптатах. При обследовании в 11 лет у ребенка выявлены те же изменения в пищеводе, которые были описаны в предыдущей ЭГДС (рис. 3).
По данным морфологического исследования, эозинофильная инфильтрация составила более 50 эозинофилов в поле зрения при увеличении 400×, с гиперплазией базального слоя, удлинением сосочков, дистрофическими изменениями, повреждением и десквамацией эпителиальных клеток.
Данный клинический пример наглядно показывает недооценку жалоб и клинических проявлений у ребенка, проведение инвазивных процедур без оценки морфологических изменений слизистой пищевода, что привело к поздней диагностике заболевания и выраженному фиброзу нижней трети пищевода с нарушением функции.
ВНУТРЕННИЙ РЕГИСТР
ЭоЭ ассоциирован с атопическими заболеваниями: 26–50 % пациентов с этим диагнозом страдают БА, 30–90 % — АР, 19–55 %—АД и 9,8–68 %—IgE-опосредованной ПА. С ЭоЭ связаны и другие неатопические заболевания, такие как воспалительные заболевания кишечника, болезни соединительной ткани, аутизм, синдром дефицита внимания и гиперактивности, глютеновая болезнь и другие моногенные заболевания. Причем в 21–25 % случаев у подобных пациентов нет сопутствующего АЗ, поскольку они могут быть представлены другим ЭоЭ-фенотипом. Больные с возможными ассоциированными заболеваниями должны регулярно проходить обследование на ЭоЭ. В 2021 году на базе ДГКБ имени З.А.Башляевой Департамента здравоохранения Москвы создан внутренний регистр пациентов с эозинофильным поражением ЖКТ, в который вошли более 300 детей в возрасте от месяца до 17 лет. Это позволило получить клинические, эндоскопические и морфологические критерии постановки диагноза, основываясь на российских и зарубежных рекомендациях.
ПОДХОДЫ К ЛЕЧЕНИЮ
Цели терапии ЭоЭ:
- достижение клинической (купирование дисфагии) и гистологической ремиссии заболевания;
- предотвращение развития осложнений (стриктуры пищевода).
Разработано несколько диетических стратегий:
- целевая элиминационная диета, основанная на тестировании на аллергию с целью распознавания потенциальных аллергенов и исключения их из рациона;
- эмпирическая элиминационная диета или элиминационная диета с шестью продуктами, при которой исключаются те из них, которые чаще всего вызывают аллергические реакции (большая шестерка — коровье молоко, яйца, соя, пшеница, арахис и лесные орехи, рыба и моллюски);
- элементарная диета, полностью исключающая все потенциально аллергенные пищевые белки.
Наиболее распространенные топические стероиды представлены пероральным использованием флутиказона пропионата и вязкого будесонида, что является нецелевым применением противоастматических средств. Препарат применяется натощак примерно за 30–40 минут до еды на определенном носителе для образования вязкой основы с возможностью прилипания к стенке пищевода. Длительность приема топического стероида в терапии ЭоЭ постоянно обсуждается экспертами. Как правило, она составляет не менее 8–12 недель, однако в некоторых случаях может продолжаться до 1–2 лет без снижения дозы.
На базе детской городской клинической больницы имени З.А. Башляевой формируется центр компетенций по диагностике и терапии эозинофильных заболеваний ЖКТ у детей.
Список литературы находится в редакции

















