Статьи
Физиология эректильной функции
Эректильная функция — один из важнейших аспектов мужского здоровья, поскольку ее состояние во многом определяет качество жизни. О механизмах эрекции — вплоть до молекулярных взаимодействий — на основе фундаментальных данных и научных исследований последних лет в статье участника конкурса.
Краткая история изучения вопроса
Первые исторические упоминания об изучении эрекции датируются VIII веком до н. э. Народы древней Индии считали, что состояние эректильной функции в первую очередь зависит от психо-эмоционального состояния мужчины, в частности, от того, насколько красивую женщину он видит перед собой. Также они были уверены, что функциональные расстройства возникают из-за "совершения полового акта с уродливой женщиной". В древнем Китае ученые и философы полагали, что на эрекцию напрямую влияет гармония двух начал — Инь и Ян [1]. Древнегреческий целитель, врач и философ Гиппократ на основе египетских папирусов выдвинул теорию, что эрекция возникает за счет пневм — "невидимых воздушных живительных субстанций", протекающих в пенисе [2].
В эпоху Средневековья на территории Европы под влиянием церкви любые исследования человеческой анатомии подвергались запрету, поскольку тело считалось неприкосновенным. О детальном изучении эректильных механизмов тогда никто не задумывался ввиду возведенной в абсолют целомудренности.
Ключевым моментом в истории исследования эрекции явилась эпоха Возрождения, а именно 1477 г., когда великий ученый Леонардо да Винчи впервые описал анатомию пениса у двух трупов людей, казненных через повешение. Он заметил, что у этих мужчин пенисы были эрегированы, и при вскрытии обнаружил, что они были наполнены кровью. Леонардо акцентировал внимание на красном оттенке головки эрегированного пениса, что свидетельствовало о полнокровии, в то время как у неэрегированного пениса поверхность головки всегда более бледного оттенка [2-4]. Будучи талантливым художником, Леонардо зарисовал свои наблюдения (рис. 1).
Рис. 1. Строение пениса согласно Леонардо да Винчи. Интересно, что художник изобразил в нем два канала: один — для мочи, другой — для семени.
Его записи послужили причиной возникновения интереса научного общества того времени к изучению анатомии человека в целом.
Следующим значимым этапом стало исследование Конрада Экхарда в 1863 г. Зная, что эрекция связана с наполнением органа кровью и увеличением его в объеме, ученый смог вызвать ее у беспородного кобеля, стимулируя ветви крестцовых нервов, тем самым впервые доказав регуляторный компонент нервной системы [5]. Через 75 лет группа ученых под руководством J.H.Semans провела фундаментальное исследование влияния определенных отделов нервной системы на эректильную и эякуляторную реакции. Они вызывали раздражение отдельных тазовых нервов и сплетений у кота и фиксировали последующую реакцию, представив результаты в виде схемы (рис 2) [6].
Рис. 2. Схема, обобщающая результаты эксперимента J.H. Semans и соавт. (1938). Указаны точки стимуляции и вызванная реакция.
В последующем урологическое научное общество сфокусировалось на сосудистом компоненте эрекции, а именно на устройстве веноокклюзионного механизма. Окончательную точку в этом вопросе поставили G.R. Fournier и соавт. в 1987 г., продемонстрировавшие его детально на живых беспородных собаках при помощи вивисекции (рис. 3) [7]. Также эта работа считается отправной точкой в стандартизации современных исследований по изучению фундаментальных механизмов эректильной функции в норме и при патологии на основе экспериментальных моделей животных.
В этом же году в Советском Союзе была защищена первая по специальности "урология" диссертация, тема которой — "Диагностика и лечение эректильной импотенции". Ее автором был нынешний заведующий кафедрой урологии РостГМУ, заслуженный деятель науки РФ, д.м.н., профессор М.И. Коган. До этого момента в СССР изучение проблем эректильной функции было прерогативой психологов [8].
Рис. 3. Схема G.R. Fournier и соавт. (1987), демонстрирующая состояние синусов кавернозных тел пениса в покое и эрегированном состоянии после интракавернозной инъекции папаверина.
Функционально-анатомические аспекты
Основными функциональными анатомическими образованиями, обеспечивающем эрекцию, являются кавернозные тела, представляющие собой парные цилиндрические структуры внутри полового члена (рис. 4). Они плотно прилегают друг к другу на протяжении 3/4 своей длины, граница между ними представлена неполной соединительнотканной перегородкой [9, 10]. Снизу (к вентральной поверхности) и параллельно к кавернозным телам прилежит спонгиозное (губчатое) тело, внутри которого проходит уретральная часть мочеиспускательного канала. Снаружи кавернозные тела ограничены белочной оболочкой, представляющей собой двухслойную структуру с несколькими подслоями [9]. Фиксацию кавернозных тел обеспечивают их проксимальные концы — ножки, которые прикрепляются к седалищно-кавернозной мышце в области сочленения ветвей седалищной и лобковой костей таза. Дистально они заканчиваются закругленными концами у головки пениса. Собственно кавернозные тела состоят из ячеек (синусов), гладкомышечных клеток, эластических и коллагеновых волокон, терминальных ветвей кавернозных артерий и нервов [11]. Структурно-функциональной единицей кавернозных тел является ячейка, ограниченная гладкомышечными трабекулами, соединительнотканными волокнами и рыхлой ареолярной тканью [11-12].
Рис. 4. Функциональная анатомия пениса. Представлены структуры, играющие ключевую роль в механизме эрекции.
Все вышеперечисленные структуры так или иначе задействованы в работе веноокклюзионного механизма, который запускается рефлекторно при возникновении сексуальных стимулов и последующих двигательных нисходящих сигналов из головного мозга через парасимпатическую нервную систему. Далее в культуре пенильных тканей из холинергических эфферентных волокон выделяется нейромедиатор ацетилхолин, вызывающий расслабление гладкомышечных трабекул ячеек кавернозных тел. Это, в свою очередь, приводит к расширению ячеек и их наполнению артериальной кровью, блокированию субтунических венул из-за их сдавления между увеличившимися в объеме кавернозными телами и малорастяжимой белочной оболочкой. В результате и возникает венозная окклюзия [9, 13]. Схематично этот механизм показан на рис. 5.
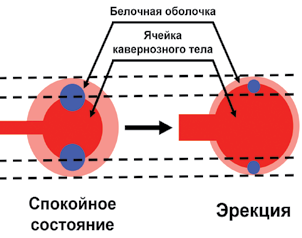
Рис. 5. Схема, демонстрирующая веноокклюзионный механизм: во время эрекции увеличивается объем ячеек кавернозного тела — "диаметр ячейки выходит за пределы внутренних пунктирных линий"; диаметр белочной оболочки же "не выходит за пределы внешних пунктирных линий", что в итоге не оставляет свободного пространства субтуническим венулам и приводит к их окклюзии. Именно из-за этого у большинства мужчин при эрекции пенис в большей степени увеличивается в длине и в меньшей — в диаметре.
Приведенное выше описание соответствует тканевому уровню эректильного механизма, однако этой информации недостаточно для понимания полноценной картины регуляторных реакций, поддерживающих эректильную функцию в норме.
Молекулярно-биохимические аспекты
Монументальным биохимическим компонентом эрекции является сосудорасширяющая каскадная система NO-цГМФ [14, 15]. В 1980 г. R.F. Furchgott и соавт. опубликовали работу, в которой описали неизвестный ранее эндотелиальный фактор, способствующий релаксации сосудов наравне с ацетилхолином [16]. Параллельно F. Murad и соавт. провели несколько серий экспериментальных исследований на крысах, где продемонстрировали взаимосвязь между применением нитровазодилататоров и повышением концентрации оксида азота (NO) и цГМФ в тканях сосудов при их расширении [17-19]. Немного позже, в 1987 г., L.J. Ignarro и соавт. впервые установили, что тот самый естественный эндотелиальный сосудорасширяющий фактор, описанный R.F. Furchgott и соавт., в действительности является NO [20]. Через несколько лет, в 1990 г., научная группа под руководством этого же ученого продемонстрировала повышенную реактивность гладкомышечных клеток кавернозных тел пениса к NO и их последующую релаксацию с запуском эрекции [21]. И уже в следующем году F. Holmquist и соавт. описали эту реакцию на образцах человеческих кавернозных тел [22].
Подобное стремительное проведение исследовательских работ демонстрирует неоспоримую заинтересованность ученых изучаемой проблемой. В заключениях последних описанных статей авторы предполагали, что в скором времени на основе результатов их работ будет разработан эффективный способ лечения расстройств эрекции [21-22]. Интуиция их не подвела, ведь через несколько лет действительно был найден один из лучших на сегодняшний момент способов улучшения эректильной функции. Но это была не заслуга полученных ранее теоретических и фундаментальных знаний, а дело случая.
В 1992 г. в Великобритании группа исследователей начала апробацию силденафила — селективного блокатора фосфодиэстеразы 5-го типа при лечении сердечно-сосудистой патологии. Вместо ожидаемого эффекта улучшения коронарного кровообращения ученые отметили улучшение эрекции у включенных в исследование пациентов. В течение следующих четырех лет были проведены детальные экспериментальные и клинические исследовательские работы по изучению фармакологических свойств силденафила и безопасности его применения. В результате в 1996 г. был запатентован препарат Виагра [23], предназначенный для лечения эректильной дисфункции, а также были опубликованы результаты исследования, обосновывающие его фармакодинамику посредством прямого влияния на систему NO-цГМФ [24, 25].
Примечательно, что в 1998 г. трое ранее упомянутых американских физиологов — R.F. Furchgott, L.J. Ignarro и F. Murad — получили Нобелевскую премию по физиологии и медицине "За открытие роли оксида азота как сигнальной молекулы в регуляции сердечно-сосудистой системы", однако многие ученые сходятся во мнении, что решение Нобелевского комитета частично или в большей мере было основано на описании этими учеными основных механизмов, на которые направлено действие силденафила [26]. Возможно, это мнение также послужило основой для ошибочного причисления некоторыми изданиями этих ученых к изобретению Виагры [27-29].
Эректильный каскад
На сегодняшний день основные каскады молекулярно-биохимических реакций, регулирующих эректильный механизм, раскрыты почти полностью. При восприятии человеком сексуальных стимулов из холинергических волокон выделяется ацетилхолин, а из неадренергических нехолинергических (НАНХ) — NO. Ацетилхолин через мускариновый рецептор 3-го подтипа, расположенный на поверхности гладкомышечной клетки, активирует аденилатциклазу, повышающую уровень цАМФ, а также взаимодействует с рядом прилегающей эндотелиальной клеткой, способствуя синтезу инозитолтрифосфата (ИФ3) из фосфатидилинозитол-4,5- бисфосфата (ФИ (4,5) Ф2), что, в свою очередь, активирует синтез молекул NO из L-аргинина при помощи NO-синтазы (NOS). Выделившийся NO индуцирует выработку гуанилатциклазой цГМФ. Далее циклические монофосфатные молекулы (цГМФ и цАМФ) снижают концентрацию внутриклеточного Ca2+ посредством блокирования Ca2+-каналов и транспортировки остаточных ионов в эндоплазматический ретикулум (ЭР). В результате при недостатке Ca2+ гладкомышечная клетка расслабляется (рис. 6) [30-35].
Рис. 6. Каскад молекулярно-биохимических реакций, приводящих к расслаблению гладкомышечных трабекул ячеек кавернозных тел (эрегированное состояние пениса).
Критическая регуляторная роль фосфодиэстеразы 5-го типа (ФДЭ-5) заключается в гидролизе молекул цГМФ, тем самым угнетается весь каскад реакций. Соответственно, действие ингибиторов ФДЭ-5 имеет ровно противоположный эффект [36-38].
При отсутствии сексуальных стимулов ингибирующий регуляторный контроль над эректильной функцией переходит к каскаду реакций, который индуцируется эфферентными симпатическими волокнами, внутренними миогенными и эндотелиальными (эндотелины, простагландины) факторами. Выделившись из адренергического волокна, норадреналин связывается с α-рецептором и осуществляет комплекс эффектов: блокирует аденилатциклазу, через ИФЗ-сигнальный путь увеличивает концентрацию внутриклеточного Ca2+ с последующей активацией кальмодулина и модулирует обменный механизм белка RhoA и гуанозинфосфатных молекул, способствуя синтезу Rho-киназ (RhoK). Все это в совокупности приводит к повышению интенсивности фосфорилирования легких цепей миозина (ЛЦМ) киназами легких цепей миозина (КЛЦМ) и к последующему сокращению гладкомышечных клеток трабекул кавернозных тел (рис. 7) [35, 39-43].
Рис. 7. Каскад молекулярно-биохимических реакций, приводящих к сокращению гладкомышечных трабекул ячеек кавернозных тел (расслабленное состояние пениса).
Новые возможности
Знание сигнальных путей, регулирующих физиологическое состояние ячеек кавернозных тел, позволяет создавать новые химические, физические и механические способы коррекции нарушений эректильной функции. Самым показательным примером является изобретение силденафила. Если бы до обнаружения его эффекта не были проведены исследовательские работы по изучению фундаментальных механизмов влияния NO на гладкомышечные стенки сосудов и трабекул кавернозных тел, то клинические испытания стагнировали бы из-за отсутствия данных о фармакодинамике препарата. В итоге он бы вышел на рынок немного позже реального времени.
Все современные доклинические апробации новых методов лечения ориентируются на определение трех основных биохимических и иммуногистохимических маркеров в пенильных тканях — NOS, цГМФ и TGF-β1 — до и после проведенной экспериментальной терапии на лабораторных животных [44-46]. В первую очередь такая тенденция основана на вышеописанных фундаментальных данных о молекулярной физиологии эрекции: исследователи предполагают, что при воздействии разрабатываемого ими метода лечения повысится экспрессия NOS и цГМФ, вырабатывающихся в биохимической реакции индукции эрекции, а TGF-β1 снизится, поскольку сигнальные пути этого фактора (SMAD и non-SMAD) задействованы в патологическом замещении гладкомышечных клеток соединительнотканными элементами в кавернозных телах, что снижает эластичность пениса и работоспособность веноокклюзионного механизма. С этой целью исследователи заведомо моделируют у животных состояния, ассоциированные с эректильной дисфункцией, для контролируемого снижения показателей NOS и цГМФ, повышения TGF-β1 и дальнейшего посттерапевтического сравнения [47-50].
В будущем эти знания помогут в генной инженерии, поскольку таргетное воздействие на генетический аппарат клетки с целью увеличения экспрессии того или иного белка в перспективе поможет сохранению нормального процесса молекулярной регуляции эректильных механизмов. Уже сейчас ведутся исследования по созданию "прививки" от органической эректильной дисфункции: научные группы под руководством C.A. Podlasek в своих работах описали снижение процесса фиброзирования кавернозных тел пениса крысы после инъекций самоорганизующегося пептидного амфифильного нановолоконного гидрогеля-доставщика белка Sonic Hedgehog.
Теоретически они обосновали это явление прямым воздействием сигнальных путей гена и белка Sonic Hedgehog на каскадные системы NO-цГМФ и TGF-β1, а также на VEGF, действие которого направлено на поддержание нормальной морфологии эндотелия пенильных сосудов [51-52]. Вполне возможно, что клиническая апробация этого способа модулирования молекулярных взаимодействий в перспективе приведет к созданию самого эффективного метода профилактики эректильной дисфункции, ассоциированной со старением.
Список литературы находится в редакции

















