Статьи
Герминативные мутации в онкологии
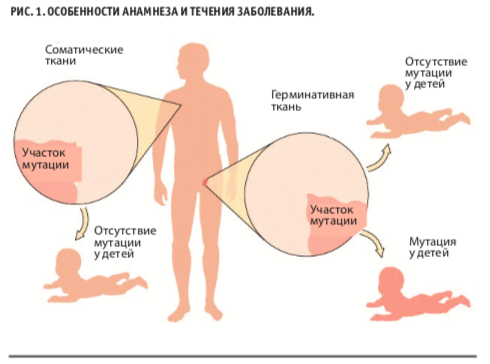
В отличие от соматических, герминативные мутации передаются по наследству и присутствуют во всех клетках организма. Вероятность их спорадического возникновения крайне низка, поэтому, проводя сбор семейного анамнеза у пациента, легко заметить наличие ЗНО у нескольких родственников (рис. 1).
Между дефектным геном и клиническими проявлениями можно установить связь. Это позволило выделить определенные наследственные онкологические синдромы: их доля в общей заболеваемости составляет 7–10 %. К таким заболеваниям относятся наследственный рак молочной железы (РМЖ) и яичников, семейный аденоматозный полипоз, синдром Ли — Фраумени, синдром фон Гиппеля — Линдау, группа синдромов, связанных с ошибочно спаренными основаниями нуклеотидов ДНК (mismatchrepair), и многие другие.
К особенностям заболеваний, вызванных герминативными мутациями, стоит отнести их возникновение в молодом возрасте, развитие вторичных либо первичномножественных ЗНО. Часто в течение жизни пациенту приходится бороться с чередой онкологических заболеваний, пока одно из них не приведет к смерти. Одни из самых тяжелых заболеваний — синдромы mismatchrepair и синдром Ли — Фраумени, которые мы проиллюстрируем ниже.
СИНДРОМ ЛИ — ФРАУМЕНИ
Клинический случай No1.
Пациент С., 5 лет, наблюдался с диагнозом мультифокальная альвео- лярная рабдомиосаркома, T2bN1M1b, стадия IVB, множественные метастазы в кости скелета, череп, костный мозг, лимфатические узлы. В семейном анамнезе: мать, 38 лет, больна РМЖ, старший брат умер 2 года назад в возрасте 10 лет от остеогенной саркомы бедра. В возрасте 4 лет появилось образование на голени, через 6 мес множественные образования на различных участках тела. Выполнена биопсия, по данным которой имеет место альвеолярная рабдомиосаркома без мутации FOXO1. По данным генетического анализа выявлена перестройка гена TP53, поставлен диагноз синдром Ли — Фраумени.
Пациент получил 8 курсов полихимиотерапии, лучевую терапию (ЛТ) на область первичной опухоли, однако на фоне проводимой терапии отмечалась прогрессия заболевания, и пациент погиб.
Клинический случай No2.
Пациент К., 15 лет, в апреле 2017 г. появилось образование в правой щеч- ной области. После дополнительного обследования выполнена биопсия и поставлен диагноз эмбриональная рабдомиосаркома правой крылонебной ямки с распространением в полость носа справа, основную и правую вернечелюстную пазуху, прорастание в полость черепа. Т2bN1Мx, IRSIII. Начал получать стандартную химиотерапию (ХТ). Однако после 3-го курса пожа- ловался на боли в левом коленном суставе. Выполнена магнитно-резонанс- ная томография (МРТ), по результатам которой определялось объемное образование нижней трети левого бедра. По данным сцинтиграфии с Tc99, перед началом ХТ метаболической активности в этой области не было. Выполнена биопсия образования кости. Поставлен диагноз конвенциональной остеосаркомы. После проведения дополнительного обследования выявлена мутация ТР53. В семейном анамнезе мама, 40 лет, страдает от реци- дивирующей базалиомы. Бабушка и дедушка по материнской линии умерли от онкологических заболеваний (родственники не смогли уточнить, каких именно).
Пациент переведен на более интенсивный курс ХТ, однако уже в течение первых 2 нед отмечалась выраженная прогрессия обеих опухолей.
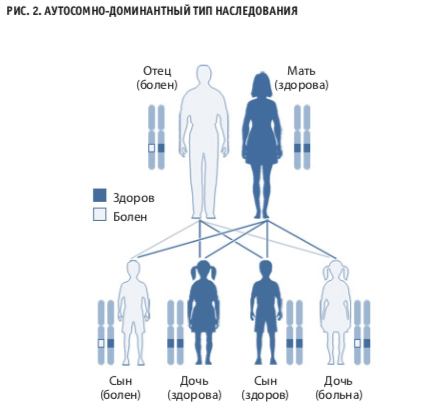
В обоих описанных ниже клинических случаях пациенты имели клинически и генетически подтвержденный синдром Ли — Фраумени. Заболевание характеризуется аутосомнодоминантным типом наследования (рис. 2) и проявляется возникновением у пациента разнообразных опухолей, что связано с повреждением в генеонкосупрессере TP53.
Эксперименты, которые проводили на лабораторных животных, показали, что инактивация этого гена у мышей в разы увеличивает частоту возникновения спонтанных опухолей не только у гомозиготных, но и у гетерозиготных по нокауталлелю особей. Разница состояла лишь в том, что гомозиготы гибли в первые 4–6 мес, преимущественно от лимфом, а у гетерозигот развивались солидные опухоли: саркомы и различные типы карцином. У человека точечные мутации в ТР53 также вызывают различные типы солидных новообразований, среди которых РМЖ, мягкотканные и остеогенные саркомы. Как правило, повреждения этого гена вызывают понастоящему катастрофические эффекты в человеческом организме, так как ТР53 играет ключевую роль в регуляции клеточного цикла, апоптозе, процессах ангиогенеза и метастазирования, репарации ошибочно спаренных нуклеотидов и многих других процессах, включая экзосомальные механизмы взаимодействия клеток.
Отключив эти механизмы, мы получим полный срыв контроля развития раковых клеток, что скажется не только на течении заболевания, но и на ответе на терапию. В связи с чем прогноз у пациентов с мутацией в ТР53 до сих пор остается крайне негативным.
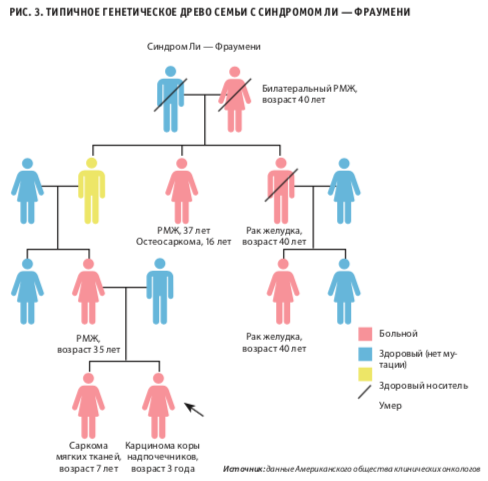
На рисунке 3 можно увидеть типичную родословную семьи с синдромом Ли — Фраумени. Однако сегодня ученые считают, что существует не один, а целых три типа этого синдрома. Таким образом, выделяют:
• LFS1 — 80% пациентов имеют точечную мутацию в ДНКсвязывающем домене TP53;
• LFS2 — мутации в CHEK2, регулирующем работу р53;
• LFSL — синдромы, похожие на синдром Ли — Фраумени, не имеющие мутаций в перечисленных генах, но имеющие изменения в длинном плече 1 хромосомы (1q23). Второй и третий типы встречаются значительно реже. И если для LFS2 известна прямая связь патогенеза с мутациями в гене CHECK2, то для синдрома LFSL точной локализации генетических повреждений не обнаружено.
Важно сказать, что наличие синдрома Ли — Фраумени — не приговор для пациента. Хотя новообразования возникают в молодом возрасте, спонтанно, часто первичномножественно, а врачонколог нередко ограничен в выборе терапии, в этой группе пациентов появляется все больше долгожителей. Это связано с обследованием родственников заболевших и диагностикой онкологической патологии на очень ранних стадиях.
СИНДРОМЫ, СВЯЗАННЫЕ С НАРУШЕНИЕМ РЕПАРАЦИИ НЕСПАРЕННЫХ ОСНОВАНИЙ (MISMATCH-REPAIR)
Для ряда синдромов характерно повреждение механизмов, отвечающих за репарацию ДНК, что также приводит к возникновению опухолей, в том числе множественных, синхронных и асинхронных. Это и есть синдромы mismatchrepair.
В данном случае очень ярко видна клиническая картина синдрома mismatchrepair. Чтобы объяснить механизм развития этой патологии, стоит вернуться к базовой биологии и генетике. Как известно, ежедневно в человеческом организме происходят тысячи повреждений звеньев ДНК, вызванные эндои экзогенными процессами. В ряде случаев это приводит к мутациям, которые могут способствовать малигнизации клеток.
Для предотвращения этого существует несколько взаимосвязанных ферментативных систем, которые вместе обеспечивают полноценную репарацию ДНК, сохраняя при этом точность воспроизведения генетической информации. Основная задача всех этих механизмов — свести к минимуму любые изменения в ДНК и сохранить ее последовательность.
Репарация ошибочно спаренных нуклеотидов или mismatchrepair (MMR) — это система распознавания и восстановления пропусков, ошибочных сшивок и вставок нуклеотидов в процессе репликации и рекомбинации ДНК. Вероятность ошибки при репликации ДНК составляет 10-7–10-8. Система репарации ошибочно спаренных нуклеотидов снижает эту вероятность до 10-9.
Клинический случай No3.
Пациент Н., 14 лет. Изначально диагностирована пилоцитарная астроци- тома. Образование удалено. Однако на контрольной МРТ, выполненной через 1 мес после операции, выявлено новое образование головного мозга. Эта опухоль также была удалена, по результатам гистологического заключения диа- гностирована анапластическая эпендимома.
Материалы пересматривались в нескольких референсных центрах, в том числе в университете Гейдельберга (Германия). Все заключения свидетельствовали о наличии двух разных новообразований.
Пациент начал получать стандартную ХТ, во время которой пожаловался на примесь крови в стуле. При подробном опросе выяснилось, что ректальные кровотечения беспокоят уже более 2 лет, однако эта информация не была доведена до лечащего врача. При проведении колоноскопии выявлен тотальный полипоз толстого кишечника с 2 участками малигнизации. На фоне ХТ отмеча- лась некоторая стабилизация, однако при проведении контрольного обследования были выявлены множественные метастазы аденокарциномы кишечника в печень и 1 очаг в мозжечке. В связи с появлением симптоматики выполнена экстренная операция по удалению метастаза в головном мозге. Результаты иммуногистохимического исследования показали, что удаленная ткань оказалась анапластической медуллобластомой. Таким образом, у пациента наблюдалось практически синхронное развитие четырех самостоятельных онкологических заболеваний: анапластической эпендимомы, пилоцитарной астроцитомы, аденокарциномы толстого кишечника и анапластической медуллобластомы.
Из семейного анамнеза стало известно, что в возрасте 28 лет мать перенесла рак шейки матки, а бабушка по материнской линии умерла в молодом возрасте от острого миелобластного лейкоза. При проведении стандартного генетического обследования не выявлено повреждений генов, влияющих на канцерогенез. В связи с этим материал был направлен на полногеномное секвенирование, в котором выявлены мутации в гене MLH3, участвующем в процессе репарации ДНК.
К сожалению, несмотря на всю проводимую терапию, у пациента отмечалась бурная прогрессия аденокарциномы и медуллобластомы, и спустя полтора года от начала терапии он погиб.
Ее работа состоит из четырех основных задач: обнаружения ошибки, определения дочерней и материнской нити ДНК, удаления неверного фрагмента и замены его на правильный. Эти процессы обеспечивают белки, закодированные в одноименных генах MLH1, MLH3, MSH2, MSH3, MSH6, PMS1 и PMS2. Поломка в них ведет к нарушению репарации, в связи с чем скорость мутагенеза возрастает в несколько раз, что ведет к трансформации клеток в опухолевые.
В том случае, если поломка присутствует в генах MLH1, MSH2, MSH6 либо PMS2, заболевание называют конституциональным синдромом mismatchrepair, который наследуется аутосомнорециссивно и характеризуется развитием опухолей головного мозга в сочетании с опухолями кишечника. При этом в 60 % случаев повреждается ген MLH1. Другое заболевание, которое также вызывается повреждением перечисленных генов, однако наследуется аутосомнодоминантно и требует только одного пораженного аллеля, — синдром Линча. Для него характерен высокий риск рака толстой кишки, а также других ЗНО, включая рак яичников, желудка и кожи.
Вернемся к описанному выше клиническому случаю. У пациента были мутации в MLH3, что не соотвествует ни коституциональному синдрому mismatchrepair, ни синдрому Линча.
В связи с тем, что этот ген и его функции в системе репарации ДНК еще мало изучены, трудно говорить о возможности выделения его повреждения в отдельный синдром. Однако, как мы видим, последствия такой поломки могут быть весьма впечатляющими.
Одна из главных проблем при лечении синдромов, связанных с mismatchrepair, — вопрос использования химиои лучевой терапии. Действие лучевой терапии, как и многих химиотерапевтических агентов, основано на повреждении ДНК, однако при этом оно происходит не только в опухолевых клетках, но и в здоровых. Учитывая нарушения в системе репарации, можно ожидать не регрессии опухоли, а ее роста и даже появления новых образований, так как количество поломок будет только накапливаться.
К сожалению, в одной статье невозможно представить все наследственные опухолевые синдромы. Какието из них, например, наследственный РМЖ, уже хорошо описаны в мировой литературе. О других информации намного меньше. Несмотря на развитие онкологии в целом, в настоящее время мы не можем предложить пациентам и их родственникам радикальных способов решения этой проблемы. Возможно, развитие генной терапии принесет новые надежды для людей с заболеваниями, вызванными герминативными мутациями.