Статьи
Глиомы у детей до года: новейшие методы терапии
Глиомы низкой степени злокачественности — самые распространенные опухоли головного мозга у детей. Чаще всего они локализуются в хиазмально-селлярной области и представлены пилоцитарными астроцитомами. Несмотря на доброкачественную гистологию и сходство данных опухолей между собой на гистологическом уровне, у детей до одного года они отличаются крайне агрессивным клиническим течением.
ДИАГНОЗ ПО СИМПТОМАМ
Диэнцефальная кахексия, прогрессирующее снижение зрения и глазодвигательные нарушения — вот основные клинические симптомы, позволяющие заподозрить данное заболевание. Локализация в срединных структурах головного мозга делает невозможным радикальное удаление этих опухолей. Диэнцефальная кахексия обусловлена вовлечением в опухолевый процесс гипоталамических структур. Изолированное наличие данного симптома делает затруднительным своевременную постановку диагноза, поскольку пациенты долгое время наблюдаются у врачей смежных специальностей (гастроэнтерологи, диетологи). Кроме того, в большом проценте случаев у пациентов с инфантильными глиомами зрительного пути присутствует инициальное метастатическое распространение, что также ухудшает прогноз заболевания.
ТЕРАПЕВТИЧЕСКИЙ СТАНДАРТ
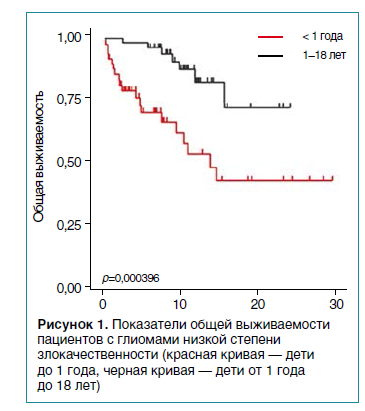 Стандартом лечения глиом низкой степени злокачественности является протокол SIOP LGG — комбинированная терапия карбоплатин/винкристин. У пациентов с инфантильными глиомами использование стандартных режимов химиотерапии (ХТ) не показало высокой эффективности (рис. 1). Лучевая терапия у детей раннего возраста невозможна из-за высокого риска развития осложнений.
Стандартом лечения глиом низкой степени злокачественности является протокол SIOP LGG — комбинированная терапия карбоплатин/винкристин. У пациентов с инфантильными глиомами использование стандартных режимов химиотерапии (ХТ) не показало высокой эффективности (рис. 1). Лучевая терапия у детей раннего возраста невозможна из-за высокого риска развития осложнений.
Открытие молекулярного патогенеза глиом низкой степени злокачественности способствовало развитию новейших методов лечения, в частности таргетной терапии (ТТ). Использование ТТ возможно только при выявлении в ткани опухоли конкретной генетической аберрации. Уникальной генетической характеристикой пилоцитарных астроцитом является химерный ген KIAA1549-BRAF, образующийся в результате дупликации хромосомного фрагмента 7q34. При выявлении данного химерного гена/транскрипта возможно расширение терапевтических опций — назначение таргетной терапии MEK-ингибитором.
Представляем вашему вниманию успешный пример использования таргетной терапии (MEK-ингибитор траметиниб) у пациента с инфантильной пилоцитарной астроцитомой хиазмально-селлярной области с наличием химерного гена KIAA1549-BRAF. Назначение таргетной терапии привело к выраженному сокращению размеров опухоли, а также значительной прибавке в весе и улучшению неврологического статуса. Сейчас ребенок продолжает терапию в амбулаторных условиях по месту жительства.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Девочка Н., 1 год и 7 месяцев. Из анамнеза заболевания известно, что в 7 месяцев появились периодические подергивания глазных яблок, прогрессирующее снижение остроты зрения, выраженное уменьшение массы тела. По месту жительства ребенок осмотрен неврологом, рекомендовано проведение магнитно-резонансной томографии (МРТ) головного мозга. По результатам МРТ выявлено объемное образование хиазмально-селлярной области размерами 3,5 х 4,2 х 2,6 см (V = 20 см3) (рис. 2).
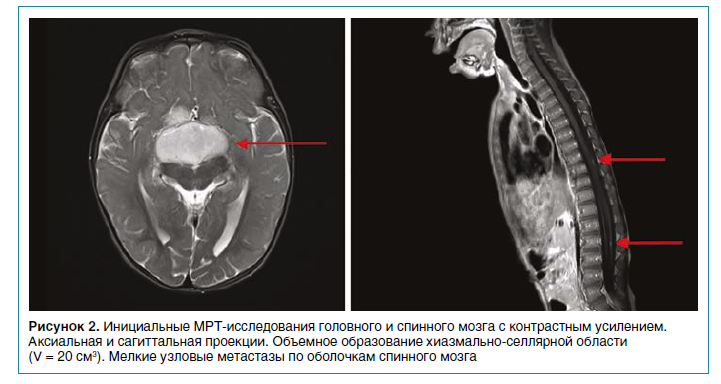
Пациентка госпитализирована в отделение хирургии НМИЦ ДГОИ имени Дмитрия Рогачева. При поступлении в возрасте 10 месяцев вес ребенка составлял 7,5 кг. В неврологическом статусе отмечались нистагм, мышечная гипотония, нарушение психомоторного развития. Проведена диагностическая биопсия с целью гистологической верификации и уточнения молекулярных характеристик опухоли. По данным гистологического исследования была установлена пилоидная астроцитома. Молекулярно-генетическое исследование ткани опухоли методом полимеразной цепной реакции выявило экспрессию химерного гена KIAA1549 (15‑й экзон) — BRAF (9‑й экзон). Учитывая гистологический диагноз, была инициирована химиотерапия по протоколу SIOP-LGG‑2004 (режим «карбоплатин + винкристин»). Через 2 недели от начала терапии отмечалось прогрессивное ухудшение состояния в виде снижения зрения, сонливости, рвоты, электролитных нарушений, появления стойкой лихорадки без выявленных очагов инфекции. По данным проведенной компьютерной томографии (КТ) выявлено нарастание гидроцефалии, признаки начального отека головного мозга, на основании чего проведена установка вентрикуло-перитонеального шунта.
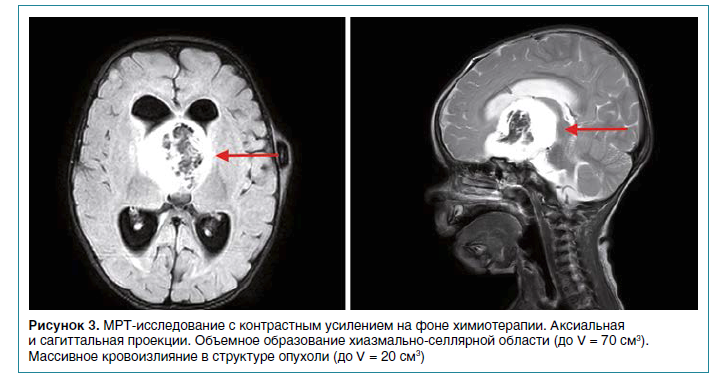
 В последующие сутки состояние ребенка продолжало ухудшаться: угнетение сознания вплоть до сопора, анемический синдром. Экстренно выполнена КТ, по результатам которой зафиксировано массивное кровоизлияние в опухоль (рис. 3). По данным обследования методом зрительных вызванных потенциалов (ЗВП) зарегистрировано нарушение зрительной афферентации на кору с обеих сторон с отсутствием достоверных корковых ответов на световой стимул. По результатам МРТ определялось увеличение объемов образования более чем в 3,3 раза в сравнении с данными предыдущей визуализации, появление в структуре опухоли массивного кровоизлияния. Констатировано прогрессирование заболевания (рис. 3). Учитывая прогрессирование заболевания на фоне стандартной химиотерапии, данные молекулярно-генетического исследования, решением врачебной комиссии в рамках программы расширенного доступа фирмы-производителя было инициировано назначение таргетной терапии MEK-ингибитором траметинибом в дозировке 0,032 мг/кг ежедневно, через гастростому. Контрольное обследование через 2 месяца после начала приема препарата выявило значительное сокращение размеров опухоли (на 36 %). В неврологическом и соматическом статусе отмечалась выраженная положительная динамика в виде прибавки веса, отсутствия лихорадки и электролитных нарушений, нистагма, а также улучшения зрения. Из нежелательных побочных эффектов терапии отмечалась только кожная токсичность I–II степени (шелушение и зуд кожных покровов).
В последующие сутки состояние ребенка продолжало ухудшаться: угнетение сознания вплоть до сопора, анемический синдром. Экстренно выполнена КТ, по результатам которой зафиксировано массивное кровоизлияние в опухоль (рис. 3). По данным обследования методом зрительных вызванных потенциалов (ЗВП) зарегистрировано нарушение зрительной афферентации на кору с обеих сторон с отсутствием достоверных корковых ответов на световой стимул. По результатам МРТ определялось увеличение объемов образования более чем в 3,3 раза в сравнении с данными предыдущей визуализации, появление в структуре опухоли массивного кровоизлияния. Констатировано прогрессирование заболевания (рис. 3). Учитывая прогрессирование заболевания на фоне стандартной химиотерапии, данные молекулярно-генетического исследования, решением врачебной комиссии в рамках программы расширенного доступа фирмы-производителя было инициировано назначение таргетной терапии MEK-ингибитором траметинибом в дозировке 0,032 мг/кг ежедневно, через гастростому. Контрольное обследование через 2 месяца после начала приема препарата выявило значительное сокращение размеров опухоли (на 36 %). В неврологическом и соматическом статусе отмечалась выраженная положительная динамика в виде прибавки веса, отсутствия лихорадки и электролитных нарушений, нистагма, а также улучшения зрения. Из нежелательных побочных эффектов терапии отмечалась только кожная токсичность I–II степени (шелушение и зуд кожных покровов).
В связи с легкостью приема и отсутствием выраженной токсичности пациентка продолжает использование препарата по месту жительства с регулярным осмотром у детского онколога для контроля соматического статуса, мониторинга нежелательных явлений и дальнейшей оценки ответа на терапию.
Читайте также
- 30 лет первой аллогенной трансплантации гемопоэтических стволовых клеток у ребенка в России
- Синдром Гурлер
- Опухолевый тромбоз нижней полой вены с распространением в правое предсердие
- Современные возможности лучевой визуализации
- Неважно, сколько дней в твоей жизни. Важно, сколько жизни в твоих днях!
- Роль педиатра в успешном лечении гемобластозов у детей
- Адоптивная клеточная иммунотерапия солидных опухолей у детей
- Клинический пример терапии ингибитором рецептора интерлейкина‑1 — препаратом анакинра — у пациента с криопирин-ассоциированным периодическим синдромом

















