Статьи
Иммуноглобулины для подкожного введения — новая эра иммуномодулирующей терапии
ШИРОКИЙ СПЕКТР
При большинстве ПИД имеются показания к заместительной терапии с применением ИГ. Дальнейшее развитие идея заместительной терапии приобрела в применении ИГ при вторичных иммунодефицитах, например при иммуносупрессивной терапии злокачественных новообразований (ЗНО), у пациентов после трансплантации гемопоэтических стволовых клеток, а также при ВИЧ-инфекции. Спектр вторичных ИДС, нуждающихся в заместительной терапии ВВИГ, все больше расширяется. Например, использование моноклональных антител к CD20 (ритуксимаб) в лечении опухолей и аутоиммунных заболеваний приводит к гибели В-лимфоцитов и временной агаммаглобулинемии.
Параллельно продолжает пополняться список иммуноопосредованных и воспалительных заболеваний, при которых высокодозовое введение ИГ выполняется с иммуномодулирующей целью. Публикации результатов клинических исследований и отдельных наблюдений говорят о том, что эти препараты стали незаменимой терапевтической модальностью при большом списке патологий, особенно в педиатрии, где безопасность препаратов ИГ была многократно доказана.
ДОЛГИЙ ПУТЬ
За длительную историю своего существования препараты ИГ прошли путь от внутримышечных до внутривенных (ВВИГ) и подкожных. Препараты ИГ для подкожного введения (ПКИГ) имеют ряд преимуществ перед ВВИГ. Очевидно, что препараты ВВИГ требуют венозного доступа, который бывает нередко затруднителен даже у взрослых, и почти всегда—у детей младшего возраста. По мере совершенствования технологий обработки плазмы появилась возможность создания концентрированных и безопасных препаратов ВВИГ, обеспечивающих введение больших объемов антител класса IgG с небольшим числом побочных эффектов. Тем не менее у когорты пациентов, получающих ВВИГ, отмечаются системные реакции в виде повышения температуры, озноба, головной боли, боли в животе, рвоты и т.д. С 1990-х годов проведено множество клинических исследований с использованием подкожного пути введения иммуноглобулина, которые показали низкий уровень системных реакций. Так, одно из недавних исследований препарата Кьютаквиг (16,5 %) показало отсутствие значимых реакций, а число легких нежелательных явлений (НЯ) составило лишь 12 %. Частично такая низкая частота НЯ объясняется тем, что в цикле очистки ПКИГ, представляющих собой препараты последнего поколения, используют наиболее современные технологии.
Другим фактором безопасности ПКИГ является их фармакокинетика. При внутривенном введении пиковая концентрация IgG достигается через 15 минут после окончания инфузии, а при подкожном — только через 4–6 дней. Показано, что выраженность системных реакций на введение ИГ коррелирует с уровнем пиковой концентрации Ig G. При внутривенном введении концентрация IgG в сыворотке крови в течение месяца может колебаться в значительных пределах: от высокой пиковой сразу после введения до относительно низкого претрансфузионного уровня. При подкожной инъекции колебания уровня IgG составляют лишь 1 г/л, что является более физиологичным. Таким образом, меньший разброс концентраций сывороточного иммуноглобулина объясняет не только меньшую частоту системных реакций при подкожном введении, но и меньшую инфекционную заболеваемость при применении ПКИГ при ПИД.
ОТЕЧЕСТВЕННЫЙ ОПЫТ
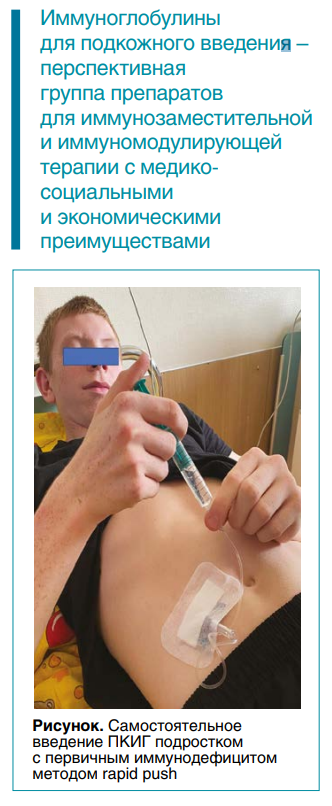 Очевидно и еще одно преимущество данных препаратов — снижение медицинских затрат на осуществление заместительной терапии в связи с тем, что подкожное введение может производиться на дому самими пациентами. Исследования, оценивавшие удовлетворенность заместительной терапией и качество жизни пациентов, также показали преимущества подкожных инъекций за счет возможности более гибкого планирования лечения и введения препарата на дому. Одно из таких исследований инициировано Национальной ассоциацией экспертов в области первичных иммунодефицитов (НАЭПИД) в РФ и охватывает сотни педиатрических и взрослых пациентов, которые начали получать препарат Кьютаквиг в 2022 году.
Очевидно и еще одно преимущество данных препаратов — снижение медицинских затрат на осуществление заместительной терапии в связи с тем, что подкожное введение может производиться на дому самими пациентами. Исследования, оценивавшие удовлетворенность заместительной терапией и качество жизни пациентов, также показали преимущества подкожных инъекций за счет возможности более гибкого планирования лечения и введения препарата на дому. Одно из таких исследований инициировано Национальной ассоциацией экспертов в области первичных иммунодефицитов (НАЭПИД) в РФ и охватывает сотни педиатрических и взрослых пациентов, которые начали получать препарат Кьютаквиг в 2022 году.
Результаты этого исследования обеспечат нас российскими данными о качестве жизни больных при данном пути введения ИГ. Первые результаты проекта уже известны, они касаются безопасности домашнего введения ПКИГ. Несмотря на обширный зарубежный опыт, у скептиков возникали сомнения в способности родителей или пациентов производить введение ПКИГ в асептических условиях. Указывали также на риск возникновения НЯ и невозможности оказать пациенту быструю помощь и т.д. Тем не менее российский опыт подтверждает отсутствие значимых реакций на подкожное введение ИГ, а проводимые по инициативе НАЭПИД школы введения ПКИГ обеспечивают адекватное обучение пациентов и родителей.
Еще одним положительным аспектом российского исследования является опыт со способом введения ПКИГ. Исторически после появления первых ПКИГ в медицинской практике их вводили с помощью электрических или механических помп, требовавших определенных узкопрофильных расходных материалов (шприцы, удлинители, иглы). Использование помп усложняет и удорожает терапию с использованием ПКИГ, а также затрудняет их применение в странах, где помпы не зарегистрированы для медицинского использования (как, например, в России).
В связи с этими аспектами в мире был апробирован и отлично зарекомендовал себя способ введения ПКИГ rapid push (дословно «быстрый толчок»), когда ПКИГ вводится вручную без применения помп пациентом и (или) его родственниками. Недостаток этого метода состоит в необходимости более частого введения препарата, обусловленной ограничением разового объема.
Как правило, в одну точку удается ввести (по переносимости) до 20 мл у маленьких детей и 30–40 мл у подростков и взрослых. Таким образом, при использовании метода rapid push можно вводить препарат 2–3 раза в неделю и более в зависимости от дозы и веса пациента. Однако использование этого метода позволяет сократить время, затраченное на одно введение, в среднем до 9 минут (по сравнению с 49 минутами при использовании помпы).
Показано, что применение метода rapid push не только не уменьшает эффективность заместительной терапии, но и приводит к формированию более высоких уровней IgG, чем при использовании помпы, а также является предпочтительным, по мнению многих пациентов. Так, 72 % из них при использовании ПКИГ предпочли метод rapid push использованию помпы.
По данным проведенных исследований, использование метода rapid push привело к еще более выгодным фармакоэкономическим характеристикам по сравнению с применением помпы для введения ПКИГ и использованием ВВИГ. Соответствующие российские данные будут получены только по завершении проводимого исследования, однако уже сейчас можно констатировать, что большинство пациентов или их родителей с успехом освоили домашнее введение ПКИГ методом rapid push (см. рис.).
Интересно, что параллельно с расширением показаний к применению ВВИГ сегодня расширяются показания к применению подкожных иммуноглобулинов. Опубликованы исследования эффективности и безопасности подкожного иммуноглобулина в терапии вторичных иммунодефицитов, демиелинизирующих заболеваний, миодистрофии, иммунной тромбоцитопении и другой аутоиммунной патологии. Таким образом, ПКИГ являются перспективной группой препаратов для иммунозаместительной и иммуномодулирующей терапии, а перспектива их внедрения в широкую медицинскую практику несет медицинские, социальные и экономические преимущества.
Читайте также
- Продолжение эры детской онкоиммунологии. «Рогатая» мишень или обманка?
- Возможности радиационной иммуномодуляции в лечении онкологических заболеваний
- Мультидисциплинарный подход к лечению сепсиса у детей с онкогематологическими заболеваниями
- Рак щитовидной железы у детей: ключевые рекомендации
- Аллогенная трансплантация костного мозга: не только при лейкозах
- Междисциплинарное взаимодействие в детской онкохирургии

















