Статьи
Курение табака и хроническая сердечная недостаточность: риски, влияние на прогноз и пути преодоления зависимости (обзор литературы)
Авторы: А.А.
Сафиуллина, Т.М. Ускач,
Е.В. Иванцова
Введение. На сегодняшний день одной из наиболее актуальных тем современной кардиологии и одной из серьезнейших проблем общественного здравоохранения признается хроническая сердечная недостаточность (ХСН), которая в классическом варианте является финальной стадией развития большинства кардиологических заболеваний. К неблагоприятным предикторам развития ХСН независимо от традиционных факторов риска относят курение – ведущий фактор риска развития сердечно-сосудистых заболеваний (ССЗ) и причина почти 40 % смертей от ССЗ.
Цель публикации – рассмотрение результатов последних исследований о влиянии курения табака на риск возникновения ХСН, прогноз заболевания и пути преодоления никотиновой зависимости.
Существует значительное сходство между воздействием курения сигарет на сердечно-сосудистую систему и патофизиологическими механизмами развития ХСН. Предполагается, что курение вызывает повреждение сердца на клеточном уровне независимо от атеросклеротических и тромботических событий. Отказ от курения – это наиболее эффективная и самая экономичная мера профилактики и снижения смертности от всех ССЗ, в том числе и от ХСН. При этом именно прекращение курения, а не снижение количества выкуриваемых сигарет рекомендуется как радикальная мера профилактики ССЗ.
Лечение никотиновой зависимости можно условно разделить на медикаментозное и немедикаментозное. Никотинзаместительная терапия – это широкодоступный безрецептурный метод лечения никотиновой зависимости, он рекомендуется во всех национальных руководствах. При отсутствии мотивации на отказ от табакокурения в краткосрочной перспективе возможен переход на альтернативные источники доставки никотина, в частности на системы нагревания табака.
Заключение. С учетом эффективности использования электронных систем нагревания табака в борьбе с курением переход на них для большинства курильщиков с тяжелой никотиновой зависимостью будет одним из этапов на пути полного отказа от вредной привычки.
Введение
Сердечно-сосудистые заболевания (ССЗ), включающие ишемическую болезнь сердца (ИБС), инсульт, хроническую сердечную недостаточность (ХСН), атеросклероз периферических артерий, являются ведущей причиной смертности во всем мире и вносят основной вклад в снижение качества жизни населения [1, 2]. По оценкам американского Института измерения показателей и оценки состояния здоровья (Institute for Health Metrics and Evaluation, IHME), в 2019 г. ССЗ стали причиной 18,56 млн смертей во всем мире, что составляет более 330 млн потерянных лет жизни и 35,6 млн лет, прожитых с инвалидностью [1, 2].
Одной из наиболее актуальных тем современной кардиологии и одной из серьезнейших проблем общественного здравоохранения признается ХСН, которая в классическом варианте является финальной стадией развития большинства кардиологических заболеваний. По данным эпидемиологических исследований, сегодня более 25 млн пациентов во всем мире страдают от ХСН, и число таких пациентов продолжает расти [3, 4].
К неблагоприятным предикторам развития ХСН независимо от традиционных факторов риска относят курение. [5]. Результаты метаанализа, проведенного H. Yang и соавт., показали, что курение сигарет повышает риск развития ХСН на 60 % [6]. Общеизвестно, что курение табака – это ведущий фактор риска развития ССЗ и причина почти 40 % смертей от ССЗ [7]. Как у мужчин, так и у женщин курение сигарет повышает риск развития ИБС – важнейшей причины возникновения систолической дисфункции левого желудочка (ЛЖ) [8]. Кроме этого, курение табака вызывает внезапную смерть у пациентов с дилатационной кардиомиопатией [9].
При ССЗ текущее курение сигарет ухудшает прогноз: так, у 20 % больных, продолжавших курить после тромболитической терапии по поводу острого инфаркта миокарда (ИМ), повторный инфаркт развивается в течение года [10]. В случае стабильного течения ИБС у женщин после планового чрескожного коронарного вмешательства риск повторного сердечно-сосудистого события выше, чем у мужчин: отношение рисков (ОР) 3,68; 95 % доверительный интервал (ДИ) 1,86–7,28; р < 0,001 по сравнению с мужчинами (ОР 1,35, 95 % ДИ 1,03–1,77; р = 0,005, взаимодействие р = 0,026) [11].
Важно отметить, что курение сигарет – это модифицируемый фактор риска развития ССЗ. Пациенты с ССЗ особенно нуждаются в лечении зависимости от табакокурения. Отказ от курения после острого ИМ является одной из самых действенных профилактических мер для улучшения прогноза заболевания.
Результаты метаанализа 20 клинических исследований показали, что выживаемость пациентов, прекративших курение после перенесенного ИМ, была на 64 % выше, чем у тех, кто продолжал курить [12]. Ретроспективный анализ данных больных (n = 28 945), перенесших коронарное шунтирование, показал, что прекращение курения сигарет может снизить 5-летнюю смертность на 35 % (ОР 0,65; 95 % ДИ 0,54–0,77; р < 0,001) и 5-летние серьезные неблагоприятные сердечно-сосудистые и цереброваскулярные события на 18 % (ОР 0,82; 95 % ДИ 0,74–0,92; р = 0,001) [13].
Безусловно, в глобальном аспекте потребление табака является значительной медико-социальной проблемой не только в России, но и во всем мире. По данным Всемирной организации здравоохранения, в 2000 г. 33,3 % населения мира было курящим, однако к 2015 г. этот показатель снизился до 24,9 % [14], т.е. отмечено снижение уровня курения во всем мире. Конечно, распространенность курения значительно варьирует в зависимости от пола, возраста и ряда социально-экономических характеристик, таких как образование, уровень дохода, семейное положение и профессия [14–16].
Несмотря на снижение масштабов потребления табака во многих странах, курение сигарет ежегодно становится причиной смерти миллионов людей. В частности, в 2017 г. около 8 млн человек во всем мире умерли от болезней, связанных с курением [17]. Табачная зависимость продолжает представлять одну из самых значительных угроз для здоровья населения, когда-либо возникавших в мире.
Патофизиологические аспекты развития хронической сердечной недостаточности, связанные с курением
Причинно-следственная связь ХСН и курения имеет сложный патофизиологический механизм. Существует значительное сходство между воздействием курения сигарет на сердечно-сосудистую систему и патофизиологическими механизмами развития ХСН. Патофизиология ХСН включает структурное повреждение сердца с развитием систолической или диастолической дисфункции с компенсаторными гемодинамическими и нейрогормональными механизмами, приводящими к периферической вазоконстрикции, задержке натрия и воды и эндотелиальной дисфункции [18]. Курение сигарет резко повышает систолическое и диастолическое артериальное давление, увеличивает частоту сердечных сокращений, общее системное сосудистое сопротивление, давление в легочной артерии и сопротивление легочных сосудов, а это все известные факторы риска развития сердечной недостаточности (СН) [18].
Проведя клиническое исследование, S.S. Gidding и соавт. доказали, что у курящих пациентов происходит увеличение массы миокарда ЛЖ и изменение его геометрии (по данным эхокардиографии) по сравнению с некурящими, даже после исключения тех лиц, у кого были серьезные сердечно-сосудистые события, такие как фибрилляция предсердий (ФП) и ИМ [19]. Кроме того, ими показано, что текущее (активное) курение связано с бóльшим средним диаметром левого предсердия [20].
J.A. Leigh и соавт. обнаружили связь между интенсивностью и продолжительностью курения сигарет с показателями структуры и функции правого и левого желудочков [21]. У текущих курильщиков увеличение продолжительности курения (измеряемое более молодым возрастом начала курения) и количества выкуриваемых сигарет было связано с ухудшением показателей структуры ЛЖ (увеличение массы и толщины стенки), диастолической функции ЛЖ и функции правого желудочка.
Аналогичные результаты получены в исследовании с применением магнитно-резонансной томографии сердца, где текущее курение было ассоциировано с увеличением массы ЛЖ и снижением циркулярного стрейна ЛЖ [22]. Также известно, что у текущих курильщиков никотин вместе с окисью углерода и окислительный стресс вызывают фиброз в различных участках миокарда, что приводит к ремоделированию миокарда, систолической и диастолической дисфункциям и развитию нарушений ритма сердца [23, 24].
Предполагается, что курение табака непосредственно токсично для кардиомиоцитов. На животных моделях доказано, что табачный дым вызывает гипертрофию и ремоделирование желудочков с сопутствующим повышением уровня норадреналина в сыворотке крови, активности никотинамидадениндинуклеотидфосфоксидазы и активации митоген-активируемой протеинкиназы [25, 26]. Это позволяет предположить, что курение вызывает повреждение сердца на клеточном уровне независимо от атеросклеротических и тромботических событий.
Сигаретный дым содержит более 7000 химических веществ и от 69 известных канцерогенов, подавляющее большинство которых представляют собой продукты сгорания табака [27]. Наибольшую озабоченность вызывают следующие его компоненты: 1) окисляющие химические вещества, 2) окись углерода, 3) летучие органические соединения, 4) твердые частицы, 5) тяжелые металлы, 6) никотин.
Трудно выделить независимую роль никотина и продуктов сгорания табака у курильщиков сигарет. Однако, как полагают, окисляющие химические вещества, такие как свободные радикалы (в 1 затяжке сигареты их содержится 1017), активные формы кислорода и реактивные формы азота из сигаретного дыма, являются основными факторами атерогенеза и тромбообразования. Окислительное повреждение возникает в результате активации, дисфункции и повреждения эндотелиальных клеток, воспаления, активации тромбоцитов и липидных нарушений [28].
Окись углерода усиливает окислительный стресс и приводит к нарушению функции митохондрий, воспалению, эндотелиальной дисфункции и ухудшению работы почек, что также является патофизиологической цепочкой при СН [29–35]. Табачный дым повышает уровень карбоксигемоглобина в крови, который оказывает отрицательное инотропное действие и увеличивает конечное диастолическое давление в ЛЖ [22].
Исследования фармакологии и токсикологии никотина на животных и некоторые эпидемиологические исследования на людях подтверждают биологическую вероятность того, что никотин способствует развитию острых сердечно-сосудистых событий у курильщиков с ССЗ и оказывает фармакологические эффекты, которые могут способствовать ускорению атерогенеза [23, 24]. Никотин вызывает зависимость и небезвреден, однако не выступает основной причиной заболеваний, связанных с курением.
По результатам крупного фармакоэпидемиологического исследования курильщиков в США, использование никотинзаместительной терапии не было связано с каким-либо значительным изменением стационарной смертности, госпитальной продолжительности жизни и повторной госпитализации [36]. Получены сходные результаты перекрестного исследования эффектов курения сигарет, трансдермального никотина и плацебо-трансдермального никотина. Доказано, что никотин как таковой не отвечает за активацию тромбоцитов или повышение уровня фибриногена в плазме, наблюдаемое у курильщиков. Соответственно, трансдермальный никотин в лечении для прекращения курения пациентов будет безопаснее, чем курение сигарет. В настоящее время организации здравоохранения принимают и поддерживают точку зрения, что основными факторами развития болезней, связанных с курением, являются продукты горения, а не никотин (см. рисунок) [37].
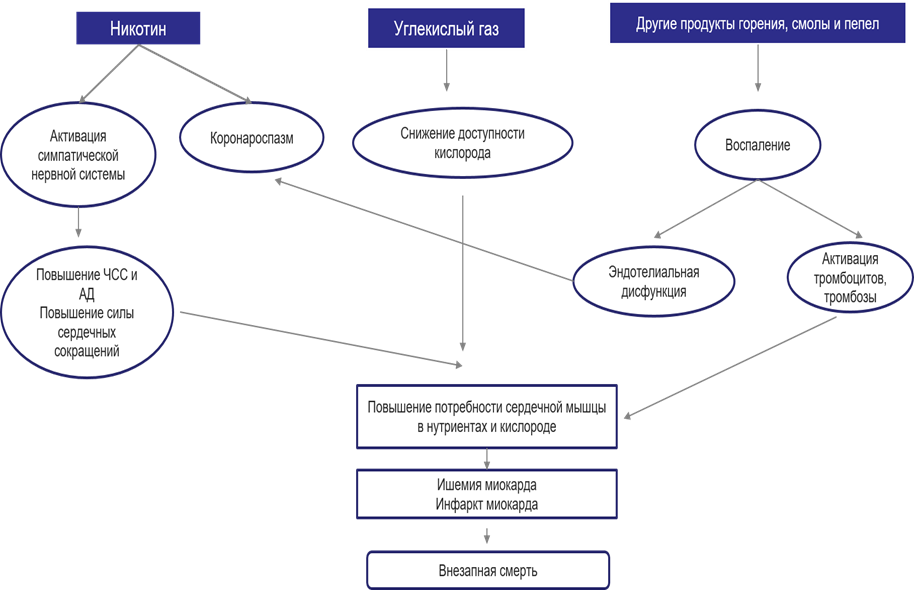
Некоторые механизмы, способствующие возникновению острых сердечно-сосудистых событий
Влияние курения на течение и прогноз хронической сердечной недостаточности
Общее бремя курения (определяемое продолжительностью курения и количеством выкуриваемых сигарет в день) и статус курения (текущее активное курение или курение в прошлом) ассоциированы с высоким риском развития ХСН и доказаны в многочисленных клинических исследованиях [22, 38, 39].
D. Aune и соавт. провели метаанализ 29 проспективных когортных исследований с целью изучить взаимосвязь между статусом курения сигарет и риском возникновения ХСН. Результаты показали, что ОР составил 1,44 (95 % ДИ 1,34–1,55; I2 = 83 %) для постоянно курящих по сравнению с теми, кто никогда не курил [40]. По сравнению с бывшими курильщиками у продолжающих курить был значительно более высокий риск СН (ОР 1,58; 95 % ДИ 1,43–1,77; I2 = 77 %). Кроме того, существовала дозозависимая связь между количеством выкуриваемых сигарет и повышенным риском ХСН. Десять выкуренных сигарет в день были связаны с повышенным (41 %) риском развития ХСН (ОР 1,41; 95 % ДИ 1,01–1,96).
В недавно опубликованном исследовании, основанном на менделевской рандомизации, проведен анализ для оценки ассоциации между ХСН и различными фенотипами курения (начало курения, возраст начала регулярного курения, прекращение курения и индекс курения в течение всей жизни) [41]. Показано, что генетическая предрасположенность к регулярному курению (настоящему или бывшему по сравнению с отсутствием опыта курения), выкуривание большего числа сигарет в день и более высокий суммарный индекс курения в течение всей жизни связаны с более высоким риском развития СН. Результаты показали сходные тенденции после поправки на факторы риска, коррелирующие с СН, и, более того, эти ассоциации не зависели от ИБС и ФП.
Существуют исследования, в которых выявлена взаимосвязь между статусом курения табака и различными фенотипами СН. В исследовании PREVEND текущее курение было связано с возникновением СН со сниженной фракцией выброса (СНнФВ) [42]. С другой стороны, в исследовании Framingham Heart текущее курение было связано с возникновением СН с сохраненной фракцией выброса (СНсФВ) [43]. В клиническом испытании MESA (n = 6,792; 12,2 года наблюдения) текущее курение ассоциировано с более высоким риском развития СН как с сохраненной, так и со сниженной фракцией выброса (ФВ) ЛЖ (n = 279 случаев) по сравнению с теми, кто никогда не курил (ОР 2,05; 95 % ДИ 1,36–3,09) [44].
В недавно опубликованном исследовании ARIC (n = 9345, 13 лет наблюдения) выявлена связь между текущим статусом курения и впервые возникшей СН (n = 1215 случаев) как со сниженной, так и с сохранной ФВ ЛЖ по сравнению с теми, кто никогда не курил [45]. Также в данной работе выявлена зависимость «доза–реакция» для нескольких лет курения с возникновением СН. Более длительный период отказа от курения был связан с пониженным риском возникновения СН, но сохранялся значительно повышенный риск в течение нескольких десятилетий для обоих фенотипов СН по сравнению с теми, кто никогда не курил.
В работе M.E. Hall и соавт. показана связь бремени курения (как ≥15 лет курения, так и ≥30 лет курения) среди когда-либо курящих с возникновением СН [33].
Перечисленные результаты исследований свидетельствуют о том, что прекращение курения сигарет может быть важной стратегией профилактики и снижения риска возникновения ХСН у текущих курильщиков.
Безусловно, важна оценка статуса курения сигарет как до, так и после постановки диагноза ХСН. Продолжение курения после постановки диагноза ХСН ухудшает ее прогноз и снижает эффективность лечения СН [35]. Согласно данным метаанализа Y.J. Son и H.J. Lee примерно 16 % пациентов продолжают курить после постановки диагноза ХСН [46]. Продолжение курения табака увеличивает смертность на 38,4 % (ОР = 1,384; 95 % ДИ 1,139–1,681) и повторную госпитализацию по причине декомпенсации ХСН на 44,8 % (ОР = 1,448; 95 % ДИ 1,086–1,930).
По результатам субанализа исследования TOPCAT [47] курение сигарет было четко определено как важный предиктор смерти у пациентов с СНсФВ. Опубликованный в 2020 г. ретроспективный анализ (n = 14,406) показал, что текущие курильщики имели высокий риск смертности по сравнению с бывшими курильщиками независимо от типа СН: СНнФВ – ОР 1,19 (1,06–1,32), СНсФВ – ОР 1,30 (1,02–1,64), взаимодействие р = 0,50.
Никотиновая зависимость
Согласно современным российским и евразийским рекомендациям по сердечной недостаточности, рекомендациям Европейского общества кардиологов (European Society of Cardiology, ESC) и Американской кардиологической ассоциации (American Heart Association) пациентам с ХСН рекомендовано прекращение курения [48–51]. Отказ от курения – это наиболее эффективная и самая экономичная мера профилактики и снижения смертности от всех ССЗ, в том числе и от ХСН. При этом именно прекращение курения, а не снижение количества выкуриваемых сигарет рекомендуется как радикальная мера профилактики ССЗ. К сожалению, отказ от курения сигарет затрудняется из-за наличия у значительного большинства пациентов никотиновой зависимости. После постановки диагноза ХСН многие (13–54 %) остаются активными курильщиками [52].
Выделяют психологическую и физиологическую никотиновую зависимость. Психологическая обусловлена привычками (курением в определенном месте, определенной ситуации), т.е. внутренним стереотипом поведения. Коррекция психологической зависимости осуществляется оказанием психологической помощи, воздействием на уровень тревожности и самооценки с помощью психотерапевтических программ комплексной реабилитации.
Физиологическая зависимость сопряжена с обменом веществ в организме, когда воздействие никотина на рецепторы формирует чувство удовольствия, а прекращение курения – никотиновую абстиненцию. Никотин воздействует на никотиновые ацетилхолиновые рецепторы, вызывает высвобождение нейромедиаторов: дофамина, норэпинефрина, ацетилхолина, серотонина, гамма-аминомасляной кислоты (ГАМК), глутамата и эндорфинов [53]. Данные нейромедиаторы определяют различные поведенческие эффекты: ощущение удовольствия, возбуждение, подавление аппетита, улучшение внимания и памяти, улучшение настроения, снижение тревоги [34]. При повторном воздействии развивается толерантность ко многим эффектам никотина, тем самым уменьшая его первичные усиливающие эффекты и вызывая физическую зависимость (т.е. симптомы отмены в отсутствие никотина). На поведение при курении влияют фармакологическая обратная связь и факторы окружающей среды (друзья, которые курят, стресс и реклама продукта). Уровни никотина в организме в зависимости от конкретного уровня потребления никотина при курении регулируются скоростью метаболизма никотина, который происходит в печени в основном с помощью фермента CYP2A6 [53].
Возможности терапии зависимости от никотина
Поскольку употребление табака вызывает психические и поведенческие расстройства, необходимо лечебное воздействие со множеством компонентов, среди которых решающее значение имеет лекарственное лечение. Лечение никотиновой зависимости можно условно разделить на медикаментозное и немедикаментозное [54].
Фармакотерапия никотиновой зависимости включает в себя широкий спектр лекарственных препаратов – от заменителей никотина, используемых в различных формах (жевательная резинка, пластырь, назальный спрей, ингалятор, подъязычные таблетки), до антидепрессантов, антагонистов рецепторов никотина и т.д. Две категории лекарственных средств показаны для прекращения курения: лекарства первой и второй линий.
Лекарства первой линии показали эффективность в лечении табачной зависимости, имеют более высокий уровень безопасности и одобрены FDA (Food and Drug Administration – федеральное агентство США, отвечающее за контроль безопасности товаров при продаже пищевых продуктов и медикаментов). Лекарства первой линии должны быть первым выбором для каждого врача, проводящего лечение никотиновой зависимости.
Лекарства второй линии, рекомендуемые для прекращения курения, представлены препаратами, эффективность которых доказана, но в меньшей степени, чем у лекарств первой линии. Их рекомендуют в тех случаях, когда препараты первой линии не могут быть использованы по различным причинам (недостаточная эффективность, противопоказания и т.д.) [55].
Особую озабоченность в настоящее время в России вызывает отсутствие препаратов для лечения никотиновой зависимости. Единственный препарат, рекомендованный для лечения никотиновой зависимости в России – варениклин, отсутствует в продаже. Никотинзаместительная терапия (НЗТ) может применяться для профилактики и/или купирования синдрома отмены у пациентов, бросающих курить.
Совместно с пациентом выбирается дата отказа, начиная с которой полностью прекращается потребление табачной и/или никотинсодержащей продукции. Выбор начальных доз никотинсодержащих препаратов проводится с учетом степени никотиновой зависимости и/или числа ежедневно выкуриваемых сигарет, а также их формы – базовой (пластырь) и ситуационной (спрей).
Рекомендуется назначение комбинации поведенческой и фармакологической терапии, что в настоящее время считается самым эффективным доказанным подходом в лечении никотиновой зависимости. Фармакологическая терапия включает использование либо полного, либо частичных агонистов никотиновых рецепторов и рекомендуется для пациентов со степенью никотиновой зависимости более 6 баллов по тесту Фагерстрема. Полный агонист никотиновых рецепторов – никотин – рекомендован для проведения НЗТ [56].
Никотинзаместительная терапия – это широкодоступный безрецептурный метод лечения никотиновой зависимости, она лицензирована как терапия первого порядка для лечения табачной зависимости во всех странах мира и рекомендуется во всех национальных руководствах. Среди целей НЗТ – снижение мотивации к курению, проявление физиологических и психологических симптомов отмены, которые развиваются в процессе отказа от табака, и, таким образом, увеличение вероятности постоянного воздержания от потребления табака до полного отказа от него [55, 57].
В Российской Федерации зарегистрированы 4 формы никотинсодержащих препаратов: 1) трансдермальный пластырь с длительным (16 и 24 ч) высвобождением никотина в дозировках 10, 15 и 25 мг (16-часовой пластырь) и 7, 14 и 21 мг (24-часовой); 2) жевательная резинка (2 и 4 мг); 3) подъязычная таблетка (2 мг); 4) спрей для слизистой оболочки полости рта дозированный (13,6 мг) [56].
Может применяться как монотерапия с использованием одного продукта, так и комбинация нескольких продуктов (трансдермального пластыря с одним из продуктов быстрого высвобождения никотина). Схема назначения НЗТ разрабатывается индивидуально с учетом степени никотиновой зависимости, количества выкуриваемых сигарет в день и степени мотивации к отказу от табака. Курс терапии длится от 3 до 6 мес. При очень высокой степени никотиновой зависимости лечение может продолжаться до 12 мес. Его начинают сразу же после полного прекращения потребления табачных продуктов. Для пациентов с очень высокой степенью никотиновой зависимости монотерапия может быть начата до полного отказа от табака.
Никотинзаместительная терапия доставляет никотин в головной мозг гораздо медленнее, чем сигареты, и не создает пиков. Таким образом, НЗТ способна насытить рецепторы никотина, устраняя потребность в нем без стимуляции этих рецепторов [58]. Это приводит к уменьшению числа рецепторов, которое возвращается к норме после 3 мес НЗТ. Тем не менее эти клетки сохраняют память о курении, и при возобновлении курения их количество на клеточной мембране может очень быстро умножаться. Следовательно, табачная зависимость – это хроническое рецидивирующее заболевание.
Рекомендуется также применение частичных агонистов никотиновых рецепторов – препаратов, не содержащих никотин. Кроме свойства частичного агониста они обладают свойством блокаторов никотиновых рецепторов. К частичным агонистам никотиновых рецепторов относятся варениклин и цитизин. Препараты имеют разную эффективность: варениклин является фармакологическим препаратом с доказанной эффективностью, а для цитизина эффективность на период воздержания от табака в течение 6 мес не доказана [59, 60].
К назначению НЗТ с ХСН в постинфарктный период (в течение 2 нед) необходимо относиться крайне осторожно, а при остром ИМ, нестабильной стенокардии, тяжелых аритмиях применение НЗТ не рекомендуется [61, 62].
Стратегия «снижения вреда» при курении у пациентов с хронической сердечной недостаточностью
В случае, если пациент не мотивирован на отказ от курения, возможно применение стратегии «снижения вреда», которая используется в медицине и социальной сфере с целью максимально сократить вред, которому подвергается человек и (или) общество в результате опасных действий или поведения и который невозможно полностью исключить или предотвратить.
Концепция «снижения вреда» может находить применение в минимизации рисков у группы пациентов, которые не готовы резко изменить свой образ жизни и полностью исключить риски: курение, физическая активность, диета. Стратегия «снижения вреда», обусловленного курением, впервые изложена в середине 70-х гг. ХХ в. проф. Майклом Расселом, английским психиатром и борцом с курением. Ему принадлежат работа «Сигареты с низким содержанием смолы и средним уровнем никотина – новый подход к более безопасному курению» и часто цитируемое высказывание о том, что «курильщик курит из-за никотина, а умирает от смолы» [63–65].
Конечно, стратегия «снижения вреда» не отменяет парадигму «нулевой толерантности», а лишь предполагает более дифференцированный подход к оценке эффективности терапии у каждого конкретного пациента. Наилучшую эффективность данная методика показывает у пациентов с очень выраженным аддиктивным влечением к никотину или отсутствием мотивации на отказ от курения. Стратегия «снижения вреда» направлена в первую очередь на немотивированных пациентов, которые продолжают курить, несмотря на очевидные последствия для их здоровья [66, 67].
Альтернативные способы и формы доставки никотина могут рассматриваться как инструменты «снижения вреда». Они имитируют и заменяют потребление традиционных табачных изделий. Среди них можно выделить продукты как с содержанием табака – электронные системы нагревания табака (ЭСНТ), и без него – электронные сигареты или электронные системы доставки никотина (ЭСДН). Первым из них по решению FDA США от 7 июля 2020 г. присвоен статус «продукта с модифицированным риском».
«Продукция с пониженным риском (ППР)» – это термин для обозначения продукции, которая, вероятно, обладает или потенциально может обладать пониженным риском причинения вреда здоровью курильщиков, переключившихся на данные виды продукции, по сравнению с риском причинения вреда здоровью при продолжении курения сигарет. Одним из примеров может служить система нагревания табака (СНТ). В данном продукте, в отличие от классических сигарет, происходит не горение табака, а лишь его нагревание до температуры 250–350 °С. В связи с тем, что в СНТ нет горения табака, содержание выделяемых вредных и потенциально вредных веществ значительно ниже, чем в дыме сигарет [68, 69]. В процессе работы ЭСНТ не происходит химических реакций с выделением тепловой энергии. Аэрозоль, образующийся в ней при нагревании табака, не содержит твердых частиц и, как следствие, не попадает под определение «дым». Число выделяемых веществ из-за отсутствия окисления снижено более чем в 10 раз (около 7000 в дыме сигареты и 529 в аэрозоле ППР).
Независимые исследования показали, что концентрация вредных и потенциально вредных химических соединений, производимых ЭСНТ, в среднем на 90 % ниже, чем в традиционных сигаретах [70–74]. Это не означает снижение риска на 90 % и не исключает риски для здоровья: аэрозоль содержит никотин, вызывающий зависимость [75].
В настоящее время мало исследований, оценивающих влияние воздействия ЭСНТ на сердечно-сосудистые исходы, но тем не менее среди них есть несколько, которые заслуживают внимания.
Краткосрочное рандомизированное клиническое исследование (РКИ) применения ЭСНТ на здоровых добровольцах, в котором изучалась концентрация 15 биомаркеров воздействия (Со, S-PMA, MHBMA, 3-HPMA, общий NNN, общий NNAL, общий 1-OHP, 4-ABP, 1-NA, 2-NA, толуидин, CEMA, HEMA, 3-MPMA и тотал-3-OH-B), показало значимое их снижение у участников, переходящих на ЭСНТ, по сравнению с продолжившими курить [74]. Биомаркеры воздействия – это маркеры, сигнализирующие о воздействии выбранных вредных и потенциально вредных веществ. Их изучали в крови и моче участников РКИ. Все эти биомаркеры влияют на общий уровень воспалительных медиаторов и медиаторы оксидативного стресса, что прямо связано с развитием атеросклеротического поражения сосудов. Кардиологически значимые биомаркеры карбоксида углерода и акролеина были снижены в среднем на 62,5 %.
В исследовании F. Lüdicke и соавт. при изучении нескольких маркеров сердечно-сосудистого риска, таких как фибриноген, высокочувствительный С-реактивный белок (вч-СРБ), гомоцистеин и артериальное давление, выявлено, что концентрация вч-СРБ на 90-й день была на 6,4 % ниже в группе ЭСНТ, чем в группе курения сигарет [76]. Кроме того, в группе ЭСНТ наблюдалось снижение уровня 11-дегидро-тромбоксана B2 (биомаркера активации тромбоцитов), растворимой молекулы внутриклеточной адгезии-1 (биомаркера функции эндотелия) и 8-эпи-простагландина F2a (биомаркера окислительного стресса), а также увеличение холестерина липопротеидов высокой плотности по сравнению с группой курения сигарет.
В исследовании С. Haziza и соавт. в группе ЭСНТ наблюдались положительные изменения в метаболизме липидов (общий холестерин и холестерин высокой и низкой плотности), эндотелиальной дисфункции (растворимая молекула межклеточной адгезии-1), окислительном стрессе (8-эпи-простагландин F2a) и факторах риска ССЗ (вч-СРБ) по сравнению с группой курения [77].
На основании результатов перечисленных исследований можно считать, что переход на ЭСНТ с традиционных продуктов курения может быть связан с положительным влиянием на эндотелиальную дисфункцию и окислительный стресс и, соответственно, на риск развития заболеваний, связанных с курением, в том числе ССЗ.
Исследования долгосрочного воздействия продуктов ЭСНТ на здоровье ограничены, поэтому трудно сказать, будут ли изделия из нагреваемого табака оказывать неблагоприятное воздействие на здоровье в будущем. Тем не менее по результатам южнокорейского общенационального когортного исследования с участием 5 159 538 взрослых мужчин, прошедших медицинские осмотры в течение первого (2014–2015 гг.) и второго (2018 г.) периодов медицинского скрининга (из базы данных Корейской национальной службы медицинского страхования), те, кто отказывается от стандартных сигарет и переходит на негорючие никотиновые табачные изделия, имеют более низкий риск ССЗ в будущем по сравнению с теми, кто постоянно курит стандартные сигареты [78].
Экспертный совет Американской коллегии кардиологов (American College of Cardiology, ACC) включил альтернативные способы доставки никотина в алгоритм работы с пациентами, которые не готовы отказаться от курения [79]. В документе указано, что, если пациент не заинтересован в медикаментозном лечении, то необходимо обсудить применение «табачных изделий без горения». Через месяц пациент должен явиться с контрольным визитом к врачу, во время которого снова обсуждается вопрос о медикаментозной терапии. Важно избегать совместного применения табачных изделий и альтернативных систем доставки никотина, поскольку при этом существенно возрастает риск возникновения ССЗ и их осложнений по сравнению с курением только табака [80].
В рекомендациях по профилактике ССЗ Европейского общества кардиологов от 2021 г. указано, что электронные сигареты доставляют никотин без большинства химических веществ, содержащихся в табаке, и, вероятно, менее вредны, чем табак. Также в ряде исследований есть свидетельства того, что электронные сигареты, возможно, более эффективны, чем НЗТ, с точки зрения отказа от курения [81–83]. Однако долгосрочное воздействие электронных сигарет на сердечно-сосудистую систему и здоровье легких требует дополнительных исследований.
Заключение
Пациентам с ХСН «золотым стандартом» терапии рекомендуется в долгосрочной перспективе полный отказ от курения сигарет для улучшения прогноза и снижения риска смерти. Однако при отсутствии мотивации на отказ от табакокурения в краткосрочной перспективе возможен переход на альтернативные источники доставки никотина, в частности на СНТ. С учетом эффективности ЭСНТ в борьбе с курением переход на них для большинства курильщиков с тяжелой никотиновой зависимостью будет одним из этапов на пути полного отказа от вредной привычки.
Литература
1. GBD 2017 Causes of Death Collaborators. Global, regional, and national age-sex-specific mortality for 282 causes of death in 195 countries and territories, 1980–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet 2018;392(10159):1736–88. DOI: 10.1016/S0140-6736(18)32203-7
2. GBD 2017 DALYs and HALE Collaborators. Global, regional, and national disability-adjusted life-years (DALYs) for 359 diseases and injuries and healthy life expectancy (HALE) for 195 countries and territories, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet 2018;392(10159):1859–922. DOI: 10.1016/S0140-6736(18)32335-3
3. Ziaeian B., Fonarow G.C. Epidemiology and aetiology of heart failure. Nat Rev Cardiol 2016;13:368–78. DOI: 10.1038/nrcardio.2016.25
4. Savarese G., Lund L.H. Global Public Health Burden of Heart Failure. Card Fail Rev 2017;3(1):7–11. DOI: 10.15420/cfr.2016:25:2
5. Roger V.L., Weston S.A., Gerber Y. et al. Trends in incidence, severity, and outcome of hospitalized myocardial infarction. Circulation 2010;121:863–9. DOI: 10.1161/CIRCULATIONAHA.109.897249
6. Yang H., Negishi K., Otahal P., Marwick T.H. Clinical prediction of incident heart failure risk: a systematic review and meta-analysis. Open heart 2015;2:e000222. DOI: 10.1136/openhrt-2014-000222
7. The health consequences of smoking – 50 years of progress: a report of the surgeon general. Available at: US Department of Health and Human Services: Atlanta (GA): Centers for Disease Control and Prevention (US); 2014. PMID: 24455788
8. Fox K.F., Cowie M.R., Wood D.A. et al. Coronary artery disease as the cause of incident heart failure in the population. Eur Heart J 2001;22:228–36. DOI: 10.1053/euhj.2000.2289
9. Coughlin S.S., Neaton J.D., Sengupta A., Kuller K.H. Predictors of mortality from idiopathic dilated cardiomyopathy in 356,222 men screened for the multiple risk factor intervention trial. Am J Epidemiol 1994;139:166–72. DOI: 10.1093/oxfordjournals.aje.a116978
10. Rivers J.T., White H.D., Cross D.B. et al. Reinfarction after thrombolytic therapy for acute myocardial infarction followed by conservative management: Incidence and effect of smoking. Jam Coll Cardiol 1990;16:340–8. DOI: 10.1016/0735-1097(90)90583-b
11. Yang L.X., Wang Z.J., Shi D.M. et al. Differential impact of cigarette smoking on prognosis in women and men undergoing percutaneous coronary intervention. Angiology 2020;71(3):281–7. DOI: 10.1177/0003319719889276
12. Critchley J., Capewell S. Smoking cessation for the secondary prevention of coronary heart disease. Cochrane Database Syst Rev 2004;1:CD003041. DOI: 10.1002/14651858.CD003041.pub2
13. Masoudkabir F., Yavari N., Pashang M. et al. Smoking cessation after surgery and midterm outcomes of surgical revascularization. Ann Thorac Surg 2020;109(6):1874–9. DOI: 10.1016/j.athoracsur.2019.09.045
14. WHO global report on trends in prevalence of tobacco use 2000–2025. 3rd Edn. Geneva: World Health Organization, 2019. 121 p. Available at: https://apps.who.int/iris/bitstream/handle/10665/330221/9789240000032-eng.pdf?ua=1 (Accessed July 09, 2020).
15. Degenhardt L., Chiu W.T., Sampson N. et al. Toward a global view of alcohol, tobacco, cannabis, and cocaine use: findings from the world mental health surveys. Plos Med 2008;5(7):e141. DOI: 10.1371/journal.pmed.0050141
16. Sinha D.N., Suliankatchi R.A., Amarchand R., Krishnan A. Prevalence and sociodemographic determinants of any tobacco use and dual use in six countries of the WHO South-East Asia region: findings from the demographic and health surveys. Nicotine Tob Res 2016;18(5):750–6. DOI: 10.1093/ntr/ntv286
17. Findings from the global burden of disease study 2017. Seattle, United States: Institute for Health Metrics and Evaluation (IHME), 2018. Available at: http://www.healthdata.org/sites/default/files/files/policy_report/2019/GBD_2017_Booklet.pdf (Accessed July 09, 2020).
18. Nicolozakes A.W., Binkley P.F., Leier C.V. Hemodynamic effects of smoking in congestive heart failure. Am J Med Sci 1988;296(6):377–80. DOI: 10.1097/00000441-198812000-00002
19. Gidding S.S., Liu K., Colangelo L.A. et al. Longitudinal determinants of left ventricular mass and geometry: the Coronary Artery Risk Development in Young Adults (CARDIA) Study. Circ Cardiovasc Imaging 2013;6:769–75. DOI: 10.1161/CIRCIMAGING.112.000450
20. Gidding S.S., Carnethon M.R., Daniels S. et al. Low cardiovascular risk is associated with favorable left ventricular mass, left ventricular relative wall thickness, and left atrial size: the CARDIA study. J Am Soc Echocardiogr 2010;23:816–22. DOI: 10.1016/j.echo.2010.05.023
21. Leigh J.A., Kaplan R.C., Swett K. et al. Smoking intensity and duration is associated with cardiac structure and function: the ECHOcardiographic Study of Hispanics/Latinos. Open Heart 2017;4(2):e000614. DOI: 10.1136/openhrt-2017-000614
22. Kamimura D., Cain L.R., Mentz R.J. et al. Cigarette smoking and incident heart failure: insights from the Jackson Heart Study. Circulation 2018;137:2572–82. DOI: 10.1161/CIRCULATIONAHA.117.031912
23. D’Alessandro A., Boeckelmann I., Hammwhöner M., Goette A. Nicotine, cigarette smoking and cardiac arrhythmia: an overview. Eur J Prev Cardiol 2011;19:297–305. DOI: 10.1177/1741826711411738
24. Suskin N., Sheth T., Negassa A., Yusuf S. Relationship of current and past smoking to mortality and morbidity in patients with left ventricular dysfunction. J Am Coll Cardiol 2001;37(6):1677–82. DOI: 10.1016/s0735-1097(01)01195-021
25. Rafacho B.P., Azevedo P.S., Polegato B.F. et al. Tobacco smoke induces ventricular remodeling associated with an increase in NADPH oxidase activity. Cell Physiol Biochem 2011;27:305–12. DOI: 10.1159/000327957
26. Gu L., Pandey V., Geenen D.L. et al. Cigarette smoke-induced left ventricular remodelling is associated with activation of mitogen-activated protein kinases. Eur J Heart Fail 2008;10:1057–64. DOI: 10.1016/j.ejheart.2008.08.009
27. Csordas A., Bernhard D. The biology behind the atherothrombotic effects of cigarette smoke. Nat Rev Cardiol 2013;10(4):219–30. DOI: 10.1038/nrcardio.2013.8
28. Barua R.S., Ambrose J.A. Mechanisms of coronary thrombosis in cigarette smoke exposure. Arterioscler Thromb Vasc Biol 2013;33(7):1460–7. DOI: 10.1161/ATVBAHA.112.300154
29. Zhang J., Piantadosi C.A. Mitochondrial oxidative stress after carbon monoxide hypoxia in the rat brain. J Clin Invest 1992;90:1193–9. DOI: 10.1172/JCI115980
30. Morris P.B., Ference B.A., Jahangir E. et al. Cardiovascular effects of exposure to cigarette smoke and electronic cigarettes: clinical perspectives from the prevention of cardiovascular disease section leadership council and early career councils of the American College of Cardiology. J Am Coll Cardiol 2015;66:1378–91. DOI: 10.1016/j.jacc.2015.07.037
31. Levitzky Y.S., Guo C.Y., Rong J. et al. Relation of smoking status to a panel of inflammatory markers: the framingham offspring. Atherosclerosis 2008;201:217–24. DOI: 10.1016/j.atherosclerosis.2007.12.058
32. Bye A., Sorhaug S., Ceci M. et al. Carbon monoxide levels experienced by heavy smokers impair aerobic capacity and cardiac contractility and induce pathological hypertrophy. Inhal Toxicol 2008;20:635–46. DOI: 10.1080/08958370701883821
33. Hall M.E., Wang W., Okhomina V. et al. Cigarette Smoking and Chronic Kidney Disease in African Americans in the Jackson Heart Study. J Am Heart Assoc 2016;5(6):e003280. DOI: 10.1161/JAHA.116.003280
34. Reboul C., Boissiere J., Andre L. et al. Carbon monoxide pollution aggravates ischemic heart failure through oxidative stress pathway. Sci Rep 2017;7:39715. DOI: 10.1038/srep39715
35. Ambrose J.A., Barua R.S. The pathophysiology of cigarette smoking and cardiovascular disease: an update. J Am Coll Cardiol 2004;43:1731–7. DOI: 10.1016/j.jacc.2003.12.047
36. Pack Q.R., Priya A., Lagu T.C. et al. Short-term safety of nicotine replacement in smokers hospitalized with coronary heart disease. Multicenter Study. J Am Heart Assoc 2018;7(18):e009424. DOI: 10.1161/JAHA.118.009424
37. Benowitz N.L., Fitzgerald G.A., Wilson M., Zhang Q. Nicotine effects on eicosanoid formation and hemostatic function: comparison of transdermal nicotine and cigarette smoking. J Am Coll Cardiol 1993;22(4):1159–67. DOI: 10.1016/0735-1097(93)90431-y
38. Pujades-Rodriguez M., George J., Shah A.D. et al. Heterogeneous associations between smoking and a wide range of initial presentations of cardiovascular disease in 1937360 people in England: lifetime risks and implications for risk prediction. Int J Epidemiol 2015;44:129–41. DOI: 10.1093/ije/dyu218
39. Wilhelmsen L., Rosengren A., Eriksson H., Lappas G. Heart failure in the general population of men – morbidity, risk factors and prognosis. J Intern Med 2001;249:253–61. DOI: 10.1046/j.1365-2796.2001.00801.x
40. Aune D., Schlesinger S., Norat T., Riboli E. Tobacco smoking and the risk of heart failure: a systematic review and meta-analysis of prospective studies. Eur J Prev Cardiol 2019;26:279–88. DOI: 10.1177/2047487318806658
41. Lu Y., Xu Z., Georgakis M.K. et al. Smoking and heart failure: a Mendelian randomization and mediation analysis. ESC Heart Fail 2021;8(3):1954–65. DOI: 10.1002/ehf2.13248
42. Brouwers F.P., de Boer R.A., van der Harst P. et al. Incidence and epidemiology of new onset heart failure with preserved vs. reduced ejection fraction in a community-based cohort: 11-year follow-up of PREVEND. Eur Heart J 2013;34:1424–31. DOI: 10.1093/eurheartj/eht066
43. Ho J.E., Lyass A., Lee D.S. et al. Predictors of new onset heart failure: differences in preserved versus reduced ejection fraction. Circ Heart Fail 2013;6:279–86. DOI: 10.1161/CIRCHEARTFAILURE.112.972828
44. Watson M., Dardari Z., Kianoush S.et al. Relation between cigarette smoking and heart failure (from the Multiethnic study of atherosclerosis) Am J Cardiol 2019;123(12):1972–7. DOI: 10.1016/j.amjcard.2019.03.015
45. Ding N., Shah A.M., Blaha M.J. et al. Cigarette smoking, cessation, and risk of heart failure with preserved and reduced ejection fraction. J Am Coll Cardiol 2022;79(23):2298–305. DOI: 10.1016/j.jacc.2022.03.377
46. Son Y.J., Lee H.J. Association between persistent smoking after a diagnosis of heart failure and adverse health outcomes: A systematic review and meta-analysis. Tob Induc Dis 2020;18:05. eCollection 2020. DOI: 10.18332/tid/116411
47. Sandesara P.B., Samman-Tahhan A., Topel M. et al. Effect of cigarette smoking on risk for adverse events in patients with heart failure and preserved ejection fraction. Am J Cardiol 2018;122(3):400–4. DOI: 10.1016/j.amjcard.2018.04.016
48. McDonagh T.A., Metra M., Adamo M. et al. ESC Scientific Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Heart J 2021;42(36):3599–726. DOI: 10.1093/eurheartj/ehab368
49. Heidenreich P.A., Bozkurt B., Aguilar D. et al. 2022 AHA/ACC/HFSA guideline for the management of heart failure: a report of the American College of Cardiology / American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 2022;145(18):e895–e1032. DOI: 10.1161/CIR.0000000000001063
50.
Терещенко С.Н., Жиров И.В., Ускач Т.М.
и др. Клинические рекомендации Евразийской ассоциации кардиологов (ЕАК) /
Национального общества специалистов по заболеваниям миокарда и сердечной
недостаточности (НОИСН) по диагностике и лечению хронической сердечной
недостаточности (2020). Евразийский кардиологический журнал 2020;3:6–76. DOI: 10.38109/2225-1685-2020-3-6-76
Tereshchenko S.N., Zhirov I.V., Uskach T.M. et al. Clinical recommendations of
the Eurasian Association of Cardiologists (EOC) / National Society of
Specialists in Myocardial Diseases and Heart Failure (NOISN) for the diagnosis
and treatment of chronic heart failure (2020). Evrazijskij kardiologicheskij
zhurnal = Eurasian Journal of Cardiology 2020;3:6–76. (In Russ.).
DOI: 10.38109/2225-1685-2020-3-6-76
51.
Хроническая сердечная недостаточность.
Клинические рекомендации 2020. Российский кардиологический
журнал
2020;25(11):4083. DOI: 10.15829/1560-4071-2020-4083
2020 Clinical practice guidelines for Chronic heart failure. Rossijskij
kardiologicheskij zhurnal = Russian Journal of Cardiology 2020;25(11):4083. (In
Russ.). DOI: 10.15829/1560-4071-2020-4083
52. Reyes E.B., Ha J.-W., Firdaus I. et al. Heart failure across Asia: same healthcare burden but differences in organization of care. Int J Cardiol 2016;223:163–7. DOI: 10.1016/j.ijcard.2016.07.256
53. Benowitz N.L. Nicotine addiction. Prim Care 1999;26:611–31. DOI: 10.1016/s0095-4543(05)70120-2
54. Benowitz N.L. Neurobiology of Nicotine Addiction: Implications for Smoking Cessation Treatment. Am J Med 2008;121(4 Suppl. 1):S3–10. DOI: 10.1016/j.amjmed.2008.01.015
55.
Прекращение потребления табака и
лечение табачной зависимости. Научно обоснованные рекомендации / Под ред. проф.
А.К. Дёмина. М., РФ – Вашингтон, округ Колумбия, США. Брюссель, Бельгия: Изд-е
Российской ассоциации общественного здоровья, 2013. С. 22.
Cessation of tobacco use and treatment of tobacco addiction.
Scientifically-based recommendations / Edited by prof. A.K. Demin. Moscow,
Russia – Washington, DC, USA. Brussels, Belgium: Publication of the Russian
Public Health Association, 2013. P. 22. (In Russ.).
56.
Чучалин А.Г., Сахарова Г. М., Антонов
Н.С. и др. Синдром зависимости от табака, синдром отмены табака у взрослых.
Клинические рекомендации (МКБ 10: F17.2, F17.3)
/ Минздрав России. Наркология 2018:7;3:3–21. DOI: 10.25557/1682-8313.2018.03.3-21
Chuchalin A.G., Sakharova G. M., Antonov N.S. et al. Tobacco dependence
syndrome, tobacco withdrawal syndrome in adults. Clinical recommendations (ICD
10: 17.2, 17.3) / Ministry of Health of Russia. Narkologiya = Narcology
2018:7;3:3–21. (In Russ.). DOI: 10.25557/1682-8313.2018.03.3-21
57.
Антонов Н.С., Сахарова Г.М.
Эффективность применения безрецептурных препаратов для лечения табачной
зависимости: обзор литературы. РМЖ 2016;12:804–10. (In Russ.).
Antonov N.S., Sakharova G.M. The effectiveness of over-the-counter drugs for
the treatment of tobacco addiction: a literature review. Rossijskij medicinskij
zhurnal 2016;12:804–10.
58. Brossard P., Weitkunat R., Poux V. et al. Nicotine pharmacokinetic profiles of the Tobacco Heating System 2.2, cigarettes and nicotine gum in Japanese smokers. Regul Toxicol Pharmacol 2017;89:193–9. DOI: 10.1016/j.yrtph.2017.07.032
59.
Комплексное лечение табачной
зависимости и профилактика хронической обструктивной болезни легких, вызванной
курением табака: Методические рекомендации НИИ пульмонологии Минздрава России №
2002/154 от 9 декабря 2003 / Чучалин А.Г., Сахарова Г.М., Антонов Н.С. и др. М.,
2003. 48 с.
Comprehensive treatment of tobacco addiction and prevention of chronic
obstructive pulmonary disease caused by tobacco smoking: Methodological
recommendations of the Research Institute of Pulmonology of the Ministry of
Health of Russia No. 2002/154 of December 9, 2003 / Chuchalin A.G., Sakharova
G.M., Antonov N.S. et al. Moscow, 2003. 48 p.
60.
Брюн Е.А., Бузик О.Ж., Кутушев О.Т.,
Лыков В.И. Профилактика и лечение табачной зависимости. Методические
рекомендации Департамента здравоохранения г. Москвы № 29, ч. 1 и 2. М., 2016. 60 с.
Brun E.A., Buzik O.Zh., Kutushev O.T., Lykov V.I. Prevention and treatment of tobacco
addiction. Methodological recommendations of the Moscow Department of Health
No. 29, parts 1 and 2. Moscow, 2016. 60 p.
61. Treating tobacco use and dependence: 2008 update U.S. Public Health Service Clinical Practice Guideline executive summary / 2008 PHS Guideline Update Panel, Liaisons, and Staff. Respir Care 2008;53(9):1217–22. PMID: 18807274
62. Ford C.L., Zlabek J.A. Nicotine Replacement Therapy and Cardiovascular Disease. Mayo Clin Proc 2005;80(5):652–6. DOI: 10.4065/80.5.652
63. Russell M. Low-tar medium-nicotine cigarettes: a new approach to safer smoking. BMJ 1976;1:1430–3. DOI: 10.1136/bmj.1.6023.1430
64. Drummond M.B., Upson D. Electronic cigarettes. Potential harms and benefits. Ann Am Thor Society 2014;11(2):236–42. DOI: 10.1513/AnnalsATS.201311-391FR
65. McNeill A., Munafò M.R. Reducing harm from tobacco use. J Psychopharmacol 2013;27(1):13–8. DOI: 10.1177/0269881112458731
66. Morgan C.J., Noronha L.A., Muetzelfeldt M. et al. Curran, C.J. Harms and benefits associated with psychoactive drugs: findings of an international survey of active drug users. J Psychopharmacol 2013;27(6)497–506. DOI: 10.1177/0269881113477744
67. Guidelines for the psychosocially assisted pharmacological treatment of opioid dependence. WHO Guidelines Approved by the Guidelines Review Committee. Geneva: World Health Organization, 2009. 111 p. PMID: 23762965 Bookshelf ID: NBK143185
68. Davis B., Williams M., Talbot P. IQOS: evidence of pyrolysis and release of a toxicant from plastic. Tob Control 2019;28(1):34–41. DOI: 10.1136/tobaccocontrol-2017-054104
69. Jankowski M., Brozek G.M., Lawson J. et al. New ideas, old problems? Heated tobacco products – a systematic review. Int J Occup Med Environ Health 2019;32:595–634. DOI: 10.13075/ijomeh.1896.01433
70. Li X., Luo Y., Jiang X. et al. Chemical analysis and simulated pyrolysis of Tobacco Heating System 2.2 compared to conventional cigarettes. Nicotine Tob Res 2019;21(1):111–8. DOI: 10.1093/ntr/nty005
71. Farsalinos K.E., Yannovits N., Sarri T. et al. Carbonyl emissions from a novel heated tobacco product (IQOS): comparison with an e-cigarette and a tobacco cigarette. Addiction 2018;113:2099–106. DOI: 10.1111/add.14365
72. Mallock N., Böss L., Burk R. et al. Levels of selected analytes in the emissions of “heat not burn” tobacco products that are relevant to assess human health risks. Arch Toxicol 2018;92:2145–9. DOI: 10.1007/s00204-018-2215-y
73. Vu A.T., Taylor K.M., Holman M.R. et al. Polycyclic aromatic hydrocarbons in the mainstream smoke of popular U.S. Cigarettes Chem Res Toxicol 2015;28(8):1616–26. DOI: 10.1021/acs.chemrestox.5b00190
74. Schaller J.P., Keller D., Paget L. et al. Evaluation of the Tobacco Heating System 2.2. Part 2: Chemical composition, genotoxicity, cytotoxicity, and physical properties of the aerosol. Regul Toxicol Pharmacol 2016;81(Suppl 2):S27–47DOI: 10.1016/j.yrtph.2016.10.001
75. Kiyohara K., Tabuchi T. Electronic cigarette use in restaurants and workplaces where combustible tobacco smoking is not allowed: an Internet survey in Japan. Tob Control 2018;27(3):254–7. DOI: 10.1136/tobaccocontrol-2016-053581
76. Lüdicke F., Picavet P., Baker G. et al. Effects of switching to the menthol Tobacco Heating System 2.2, smoking abstinence, or continued cigarette smoking on clinically relevant risk markers: A randomized, controlled, open-label, multicenter study in sequential confinement and ambulatory settings (P. 2). Nicotine Tob Res 2018;20(2):173–82. DOI: 10.1093/ntr/ntx028
77. Haziza C., de La Bourdonnaye G., Donelli A. et al. Favorable changes in biomarkers of potential harm to reduce the adverse health effects of smoking in smokers switching to the menthol Tobacco Heating System 2.2 for 3 months (P. 2). Nicotine Tob Res 2020;22:549–59. DOI: 10.1093/ntr/ntz084
78. Choi S., Lee K., Park S.M. Combined associations of changes in noncombustible nicotine or tobacco product and combustible cigarette use habits with subsequent short-term cardiovascular disease risk among south korean men: a nationwide cohort study. Circulation 2021;144(19):1528–38. DOI: 10.1161/CIRCULATIONAHA.121.054967
79. Barua R.S., Rigotti N.A., Benowitz N.L. et al. 2018 ACC expert consensus decision pathway on tobacco cessation treatment: a report of the American College of Cardiology task force on clinical expert consensus documents. J Am Coll Cardiol 2018;72(25):3332–65. DOI: 10.1016/j.jacc.2018.10.027
80. Bhatnagar A., Payne T.J., Robertson R.M. Is there a role for electronic cigarettes in tobacco cessation? J Am Heart Assoc 2019;8:e012742. DOI: 10.1161/JAHA.119.012742
81. Hartmann-Boyce J., McRobbie H., Lindson N. et al. Electronic cigarettes for smoking cessation. Cochrane Database Syst Rev 2020;10:CD010216. DOI: 10.1002/14651858.CD010216.pub4
82. Hajek P., Phillips-Waller A., Przulj D. et al. A randomized trial of e-cigarettes versus nicotine-replacement therapy. N Engl J Med 2019; 380(7):629–37. DOI: 10.1056/NEJMoa1808779
83. Li J., Hajek P., Pesola F. et al. Cost-effectiveness of e-cigarettes compared with nicotine replacement therapy in stop smoking services in England (TEC study): a randomized controlled trial. Addiction 2020;115:507–17. DOI: 10.1111/add.14829
Вклад авторов / Author’s contribution
А.А. Сафиуллина: сбор и обработка материала;
Т.М. Ускач: концепция и дизайн статьи;
Е.В. Иванцова: редактирование.
ORCID авторов / ORCID authors:
А.А. Сафиуллина / A.A. Safiullina: https://ORCID.org/0000-0003-3483-4698
Т.М. Ускач / T.M. Uskach: https://ORCID.org/0000-0003-4318-0315
Е.В. Иванцова / E.V. Ivantsova: https://ORCID.org/0009-0005-8316-2084

















