Статьи
Лечение артериальной гипертонии на фоне хронической болезни почек
В 2021 г. опубликовано обновленное руководство KDIGO (Kidney Disease: Improving Global Outcomes) по лечению высокого артериального давления (АД) у пациентов с хронической болезнью почек (ХБП), не получающих диализ. Ключевыми вопросами в руководстве являются оптимальные целевые значения АД и дифференцированный выбор антигипертензивных препаратов (АГП).
Высокая распространенность ХБП в популяции, достигающая 10–15 %, является причиной роста сердечно-сосудистых заболеваний (ССЗ) и смертности. Эта проблема требует поиска оптимальных стратегий лечения для снижения бремени заболевания, особенно при сочетании ХБП с артериальной гипертензией (АГ). Средства, снижающие АД, являются основой стратегий лечения для замедления прогрессирования ХБП и снижения риска ССЗ. Ключевыми подходами для такой категории пациентов выступают снижение АД, достижение его оптимального уровня, рациональное использование АГП.
ЦЕЛЕВОЙ УРОВЕНЬ АД У ПАЦИЕНТОВ С АГ И ХБП
Руководство предлагает для пациентов с АГ и ХБП применение более низкого уровня целевого систолического артериального давления (САД) <120 мм рт. ст., определяемого стандартизированным методом измерения офисного АД, только при хорошей переносимости (в 2012 г. рекомендовался целевой уровень АД <130 / 80 мм рт. ст.). Оговорено, что применять рекомендованное целевое значение САД <120 мм рт. ст. потенциально опасно для измерения АД, полученного нестандартным методом. Основанием к данной рекомендации стали результаты крупного метаанализа, который был проведен Blood Pressure Lowering Treatment Trialists’ Collaboration (2013 г.), включавшего 26 рандомизированных контролируемых испытаний (РКИ) (n = 152 290) и 30 295 пациентов без АГ со сниженной расчетной скоростью клубочковой фильтрации (рСКФ <60 мл / мин / 1,73 м2), показавшие, что клиническая значимость и сердечно-сосудистые преимущества в этой когорте в большей степени зависят от достигнутого эффекта снижения АД. Так, применение гипотензивной терапии со снижением САД на 5 мм рт. ст. обеспечивало уменьшение относительного риска развития серьезных сердечно-сосудистых событий на 17 % в группах пациентов с / без нарушения рСКФ (относительный риск (ОР) составил 0,83 при доверительном интервале (ДИ) 0,79–0,88). При этом абсолютная польза активного лечения пациентов со сниженной скоростью клубочковой фильтрации (СКФ) была более выраженной в сравнении с пациентами без ее нарушения: предотвращение серьезных сердечно-сосудистых исходов на каждую 1000 участников составило 28 случаев (number needed to treat (NNT) для предотвращения 1 исхода за 4 года, NNT = 35) в сравнении с 19 случаями в группе пациентов без нарушения СКФ (NNT = 53). Позднее был проведен дополнительный анализ ре- зультатов крупного РКИ SPRINT (2017 г.), в котором в общей когорте (n = 9361) 2646 участников (28,3 %) имели ХБП. Исходный средний уровень АД составлял 139,2 / 74,9 мм рт. ст. Оценивалось влияние более интенсивного (<120 мм рт. ст.) и менее интенсивного снижения САД (<140 мм рт. ст.) на смертность, риск развития ССЗ, почечных исходов при средней длительности наблюдения 3,3 года. При интенсивном снижении САД отмечено уменьшение ССЗ (ОР 0,81, ДИ 0,63–1,05) и смертности (ОР 0,72, ДИ 0,53–0,99). В абсолютных значениях в группе интенсивного снижения САД получено на 13 смертей меньше на каждую 1000 пациентов. В подгруппе пациентов с ХБП старше 75 лет эффект был более выраженным: для достижения целевого САД <120 мм рт. ст. необходимо снижение риска ССЗ (ОР 0,64, ДИ 0,45–0,92) и смертности (ОР 0,66, ДИ 0,49–0,90). При этом не было получено неблагоприятного влияния на частоту комбинированного почечного исхода (снижение СКФ ≥50 % или терминальная почечная недостаточность (ТПН)) и протеинурии. Таким образом, результаты исследования SPRINT представляют собой наилучшие доказательства в пользу интенсивного снижения САД как средства повышения выживаемости у пациентов с ХБП и АГ.
Результаты дополнительного метаанализа, выполненного экспертами KDIGO, также показали преимущества достижения более низкого целевого САД (<120 мм рт. ст.) в снижении риска общей смертности в разных подгруппах пациентов: АГ и ХБП с / без диабета и без диализа — на 25 % (ОР 0,75, ДИ 0,57–0,99), АГ и ХБП без диабета — на 21 % (ОР 0,29, ДИ 0,69–0,91), в подгруппе АГ и ХБП с протеинурией — снижение комбинированного риска (смертность + терминальная почечная недостаточность (ТПН)) на 20 % (ОР 0,80, ДИ 0,68–0,95).
Целевой уровень САД <120 мм рт. ст. снижает риск сердечно-сосудистых событий и смертности от всех причин при ХБП, однако влияние на прогрессирование почечной недостаточности остается неопределенным. Вместе с тем у большинства пациентов с ХБП и высоким АД, включая ослабленных и пожилых, сердечно-сосудистые преимущества и риск когнитивных нарушений могут быть снижены при целевом САД <120 мм рт. ст. по сравнению с САД <140 мм рт. ст. Доказательства, подтверждающие целевое значение САД <120 мм рт. ст., менее очевидны у отдельных категорий пациентов: при сахарном диабете, более низкой СКФ при ХБП стадии G4–5, значительной протеинурии (>1 г / сут), исходном САД 120–129 мм рт. ст., у молодых (возраст <50 лет) или в старческом возрасте (>90 лет).
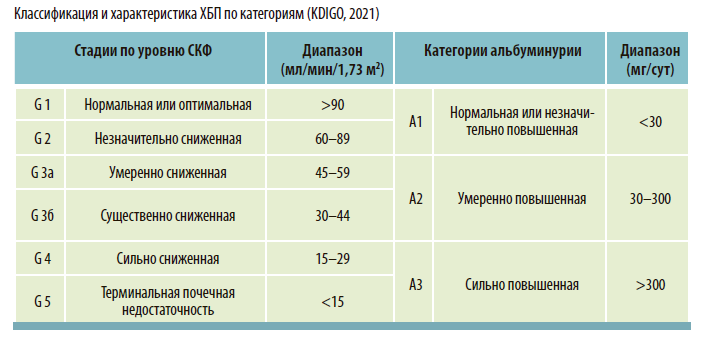
ВЫБОР ФАРМАКОТЕРАПИИ ПРИ АГ И ХБП
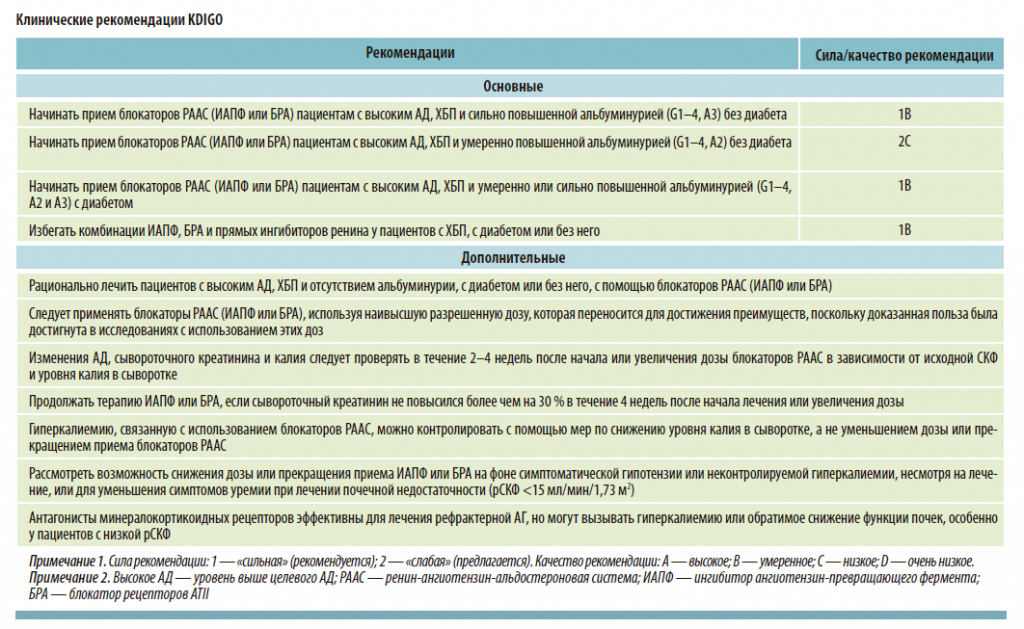
Имеются ограниченные данные об использовании разных классов АГП для лечения высокого АД при ХБП. В РКИ по изучению АГ, в которых участвовали пациенты с ХБП, преимущества влияния на сердечно-сосудистые исходы получили ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы рецепторов ангиотензина (БРА), тиазидоподобные диуретики и антагонисты кальция. Этим классам уступали β-адреноблокаторы, но они часто показаны при определенных состояниях, таких как ишемическая болезнь сердца (ИБС) и систолическая сердечная недостаточность с пониженной фракцией выброса. Многим пациентам с АГ и ХБП, у которых уровень АД превышен на 20 мм рт. ст. и более целевого значения, обычно требуется комбинация 2 или более препаратов. Если комбинация 3 препаратов — блокатора ренин-ангиотензин-альдостероновой системы (РААС), антагониста кальция и диуретиков — в рекомендуемых дозах недостаточна для контроля АД, дополнительная терапия может включать антагонист минералокортикоидных рецепторов или АГП других групп.
БЛОКАТОРЫ РААС У ПАЦИЕНТОВ С АГ И ХБП
ИАПФ и БРА являются наиболее изученными АГП, которые обеспечивают значительную защиту почек и сердечно-сосудистой системы у пациентов с ХБП и рекомендованы KDIGO (2013, 2021 гг.) в качестве терапии первой линии для пациентов с недиабетической ХБП, особенно с протеинурией, а также они более предпочтительны для лечения пациентов с диабетической ХБП и протеинурией даже при отсутствии высокого АД.
Поиск обоснований и убедительных доказательств наличия дополнительного защитного эффекта блокаторов РААС по сравнению с другими АГП получил продолжение в двух последовательных метаанализах, включавших только РКИ с участием когорты пациентов с АГ и ХБП наиболее уязвимых стадий G3–5, составляющих значительную долю в популяции (более 10 %) и имеющих высокий риск прогрессирования заболевания почек и развития ТПН.
В крупном метаанализе Xie Х. (2016 г.), включавшем 119 РКИ с участием 64 768 пациентов с ХБП (СКФ <60 мл / мин / 1,73 м2) с / без диабета, были установлены преимущества лечения блокаторами РААС по сравнению с другими АГП или плацебо в отношении почечных и сердечно-сосудистых исходов. ИАПФ и БРА значительно снижали риск почечной недостаточности (удвоение сывороточного креатинина, снижение СКФ на 50 % или ТПН) на 39 и 30 % (OР 0,61, ДИ 0,47–0,79; ОР 0,70, ДИ 0,52–0,89) соответственно в сравнении с плацебо, а также на 35 и 25 % (OР 0,65, ДИ 0,51–0,80; ОР 0,75, ДИ 0,54–0,97) соответственно в сравнении с другими классами АГП, которые не показали влияния на почечные исходы. ИАПФ и БРА снижали риск серьезных сердечно-сосудистых исходов в сравнении с плацебо на 18 и 24 % (OР 0,82, ДИ 0,71–0,92; ОР 0,76, ДИ 0,62–0,89) соответственно. Кроме того, проведение сравнительного анализа БРА и ИАПФ показало преимущество последнего с более высокой вероятностью уменьшения почечной недостаточности, сердечно-сосудистой и общей смертности.
В другом сетевом метаанализе Zhang Y. (2020 г.), основанном на большом количестве РКИ и пациентов с АГ, ХБП стадий G3–5 с / без диабета (44 РКИ, n = 42319), проводилось сравнение того, насколько эффективно разные классы АГП способны предотвратить развитие почечных и сердечно-сосудистых исходов, а также снизить риск сердечно-сосудистой и общей смертности. По предотвращению развития почечных исходов монотерапия ИАПФ была достоверно более эффективной, чем плацебо (OР 0,54, ДИ 0,41–0,73), другой контроль (OР 0,54, ДИ 0,33–0,87), антагонисты кальция (OР 0,67, ДИ 0,50–0,89), β -адреноблокаторы (OР 0,60, ДИ 0,37–0,96) и БРА (OР 0,7, ДИ 0,52–0,97). Монотерапия БРА имела достоверное преимущество в сравнении с плацебо (ОР 0,76, ДИ 0,58–1,00). По предотвращению сердечно-сосудистых исходов только ИАПФ и БРА достоверно снижали риск в сравне- нии с плацебо на 23 и 13 % (ОР 0,73, ДИ 0,64–0,84; ОР 0,83, ДИ 0,70–0,98), а ИАПФ имели преимущество и в сравнении с активным контролем (ОР 0,66, ДИ 0,45–0,98). Однако ИАПФ / БРА не получили преимуществ в защите сердечно-сосудистой системы над диуретиками, антагонистами кальция и β-адреноблокаторами. Монотерапия ИАПФ значительно снижала риск сердечно-сосудистой и общей смертности на 27 и 23 % по сравнению с плацебо, а также показала преимущество перед БРА в дополнительном снижении рисков на 37 и 24 %. Комбинированная терапия ИАПФ + БРА не превосходила монотерапию ИАПФ или БРА, контроль и другие АГП для любых исходов.
В рамках руководства KDIGO дополнительно были выполнены метаанализы по оценке эффективности блокаторов РААС у пациентов с АГ и ХБП в зависимости от наличия сахарного диабета. В когорте пациентов с АГ и ХБП без диабета метаанализ показал преимущество ИАПФ над другими АГП по протективному влиянию на сердечно-сосудистые и почечные исходы. ИАПФ значительно снижали риск сердечно-сосудистых событий — на 43 %, ТПН — на 49 %, особенно в подгруппах с протеинурией (А2–3), где наблюдалось снижение риска на 42 и 68 % соответственно, а также риска комбинированного почечного исхода (ТПН + удвоение креатинина) — на 49 %. В метаанализе исследований в когорте пациентов с АГ, хронической почечной недостаточностью (ХПН) и сахарным диабетом ИАПФ убедительно снижали риск развития почечных исходов: наступления ТПН — на 40 %, комбинирован- ного исхода — на 42 %, а также риск прогрессирования микро- в макропротеинурию — на 55 %, хотя и не было выявлено достоверного уменьшения смертности (ОР 0,79). БРА также имели эффект снижения риска развития тех же почечных исходов, особенно на фоне протеинурии (А2–3) — на 23, 16 и 44 % соответственно. При этом для БРА было отмечено уменьшение риска сердечно-сосудистых исходов на 21 %, но без влияния на общую смертность.
Таким образом, терапия блокаторами РААС у пациентов с АГ и ХБП является наиболее эффективной для защиты функций почек и сердечно-сосудистой системы. ИАПФ превосходят БРА и другие АГП, а также показывают самую высокую вероятность быть наиболее эффективным методом лечения у недиализных пациентов с ХБП и АГ.
Наличие кардио- и ренопротекторных эффектов блокаторов РААС обеспечивается особым фармакодинамическим действием. Благодаря ингибированию эффектов ангиотензина II, который оказывает сильное сосудосуживающее действие на постгломерулярную сосудистую систему, блокаторы РААС эффективно снижают фильтрационное давление, улучшают размер пор в клубочках для уменьшения протеинурии и предотвращения повреждения почек. ИАПФ имеют брадикининовые эффекты, которые способствуют ослаблению негативного воздействия гипергликемии на микрососуды почек у пациентов с сахарным диабетом. Кроме того, ИАПФ могут приводить к увеличению ангиотензина 1–7, что снижает уровень ингибитора активатора плазминогена-1, который является еще одним фактором риска для функции почек.
Кроме того, наличие кардио- и ренопротекторных эффектов у блокаторов РААС придает препаратам большую клиническую значимость, обеспечивая очевидную пользу, несмотря на потенциальные нежелательные эффекты, включая гиперкалиемию, острое повреждение почек. В этой связи рекомендуется избегать любой комбинации ИАПФ, БРА и прямых ингибиторов ренина у пациентов с ХБП вне зависимости от наличия диабета.
ДРУГИЕ АГП У ПАЦИЕНТОВ С АГ И ХБП
Проводилась оценка других АГП по влиянию на основные исходы у пациентов с АГ и ХБП. Наибольшее внимание уделено дигидропиридинам класса антагонистов кальция. Проведен крупный метаанализ Zhao H. J. (2016 г.), в котором на основе данных 8 РКИ с участием 25 647 пациентов с АГ, ХБП и / или сахарным диабетом проведено сравнение отдаленной эффективности (не менее 2 лет наблюдения) дигидропиридинов и блокаторов РААС. В группе терапии дигидропиридинами отмечена значительно более высокая частота наступления ТПН по сравнению с терапией ИАПФ / БРА при одинаковом снижении уровня АД (ОР 1,25, ДИ 1,05–1,48). Хотя ИАПФ и БРА показали лучший ренопротекторный эффект, не было существенных различий между блокаторами РААС и дигидропиридинами по влиянию на общую смертность (OР 0,96).
В метаанализе Lin Y. C. (2017 г.), включавшем 21 РКИ с участием 9492 пациентов с АГ и ХБП стадий G3–5, сравнивались эффекты антагонистов кальция и блокаторов РААС на сердечно-сосудистые и почечные исходы. Результаты не показали значительных различий по гипотензивному эффекту, снижению смертности, сердечно-сосудистых событий, а также почечных исходов между антагонистами кальция и блокаторами РААС у пациентов с более выраженным проявлением ХБП. Следовательно, антагонисты кальция не увеличивают смертность у пациентов с ХБП и обладают более слабым ренопротекторным действием по сравне- нию с терапией ИАПФ / БРА, что в сочетании с их выраженным гипотензивным эффектом и благоприятным метаболическим профилем может использоваться для предпочтительной комбинации с блокаторами РААС у пациентов с АГ и ХБП.
Проведенный метаанализ в рамках руководства KDIGO других классов АГП (β-адреноблокаторы, антагонисты кальция, прямые ингибиторы ренина) показал, что эти препараты мало или совсем не оказывают влияния на сердечно-сосудистые и почечные исходы (ТПН, удвоение креатинина, снижение СКФ) у пациентов с АГ, ХБП и протеинурией в сравнении с плацебо.
СРАВНЕНИЕ KDIGO И НАЦИОНАЛЬНЫХ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ ПО ХБП
Национальные клинические рекомендации по ХБП (2021 г.) согласуются с руководством KDIGO по предпочтительному выбору ИАПФ и БРА пациентам с ХБП стадий G3–5 вне зависимости от наличия АГ и диабета при отсутствии противопоказаний для эффективной фармакотерапии, снижения протеинурии и рисков прогрессирования дисфункции почек (ренопротекции), сердечно-сосудистых событий и смерти от всех причин (уровень рекомендации A1), а также комбинации блокаторов РААС с антагонистами кальция (уровень рекомендации В1) и диуретиками (уровень рекомендации А2). Вместе с тем рекомендуемые целевые показатели САД более консервативны: снижение САД до 130–139 мм рт. ст. при протеинурии А1–2 (уровень рекомендации А1) и до 120–130 мм рт. ст. при протеинурии А3 (уровень рекомендации В1).
Список литературы находится в редакции

















