Статьи
МКБ и микрофлора
Нехирургическое лечение мочекаменной болезни начиналось с шарлатанства и жульничества. «Поскольку выживаемость перинеальной литотомии была неопределенной, а сама процедура болезненной, то лондонские шарлатаны не испытывали сложностей с продажей отваров, которые якобы должны были растворять камни», — отмечают историки AUA в брошюре Milestones, подготовленной The W.P. Didusch Center for Urologic History.
По словам историков, лекарства не просто пользовались спросом, а расхватывались и разлетались. Среди тиражируемых средств описываются и эзотерические снадобья, в рецептуре которых сперма, лисья кровь и белое вино. В марте 1740 года Mrs. Joanna Stephens получила £5000 за средство, которое, как подтвердила экспертная клиническая комиссия, действительно растворяло камни. Это была известковая вода, раствор гидроксида кальция. До настоящего времени существовали и существуют методики растворения камней и профилактики их формирования. Но, по всей видимости, для растворяемых камней появятся и более изящные способы профилактики и лечения, а именно энзимы и пробиотики.
Болезнь цивилизации
Справку о распространенности мочекаменной болезни в XVIII веке историк AUA не дает, однако он отмечает, что уже тогда болезнь была признана весомой проблемой. А награда, полученная Mrs. Joanna Stephens, как раз и была выделена в рамках программы по борьбе с мочекаменной болезнью. Сейчас едва ли на распространенность мочекаменной болезни можно закрыть глаза: за последние 30 лет ее частота выросла на 70%, причем наиболее значимо — у детей и молодых женщин (Tasian et al., 2018; Nazzal et al., 2018; Stern et al., 2016; Tang et al., 2018). Причина такого «каменного бума» связана не только с истинным ростом заболеваемости, но и с улучшением как самой диагностики, так и ее доступности.
Однако экспертов настораживает увеличение распространенности мочекаменной болезни среди детей. В литературе отмечено, что кишечная микробиота и антибиотики могут играть значимую роль в нефролитогенезе. И в текущем году American Society of Nephrology опубликовала предупредительное сообщение о возможной инициации мочекаменной болезни антибиотиками.
«Антибиотики могут влиять на риск развития мочекаменной болезни посредством изменения метаболизма оксалатов, обеспечиваемого кишечной микробиотой. Важно, что оксалаты, поступающие с пищей, метаболизируются с участием коллективной микробиоты кишечника, так называемым оксалобиомом, который снижает абсорбцию оксалатов в кишечнике и тем самым потенциально препятствует формированию оксалатных камней. Бактерия Oxalobacter formigenes, по всей видимости, наиболее значимый представитель человеческого оксалобиома, который в том числе включает Bifidobacterium, Lactobacillus, Escherichia coli и другие», — написали Lama Nazzal и Martin J. Blaser в текущем году в статье Does the Receipt of Antibiotics for Common Infectious Diseases Predispose to Kidney Stones? A Cautionary Note for All Health Care Practitioners.
Авторы отмечают, что O. formigenes чувствительна ко многим часто назначаемым антибиотикам и препаратам так называемого узкого спектра действия. Кроме того, колонизация кишечника O. formigenes становится все менее распространенной в странах с высоким доступом к антибиотикам. И хотя эта информация обсуждалась в научном сообществе и ранее, всплеск интереса связан публикацией Tasian et al., также появившейся в этом году.
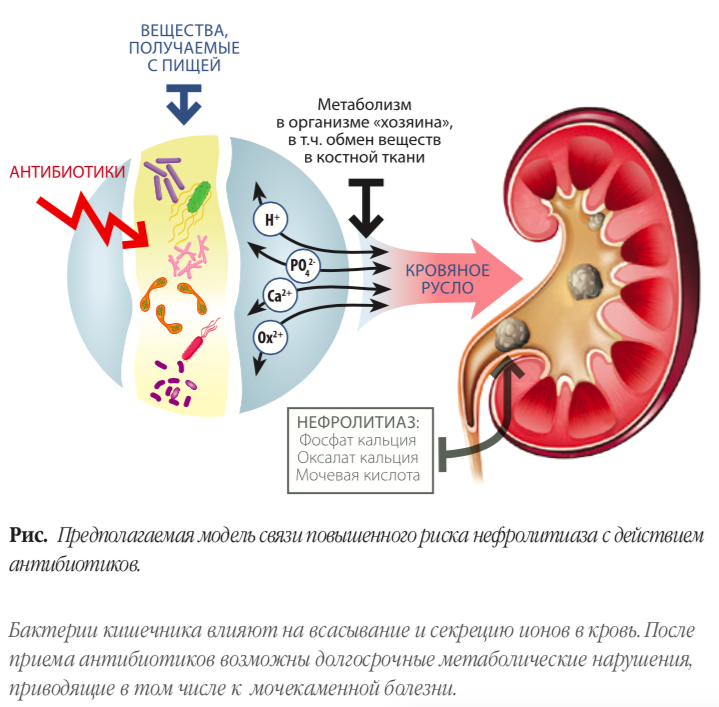
Tasian с соавторами использовали модель логистической регрессии (сonditional logistic regression models) для сравнения: 26 000 пациентов с мочекаменной болезнью и 260 000 здоровых людей. Они выяснили, что прием таких антибиотиков, как производные сульфаниламида, цефалоспорины, фторхинолоны, нитрофурантоин, метенамин и пенициллины широкого спектра, повышает риск развития мочекаменной болезни, причем велико значение антибиотиков, применяемых еще в детстве. Антибиотики увеличивают не только распространенность нефролитиаза, но также снижают возраст возникновения этого заболевания.
Очевидным следствием приема антибиотиков является сокращение численности оксалобиома, в результате чего нарушается метаболизм оксалатов. Стоит, однако, отметить, что ученые не сводят весь патологический механизм лишь к O. formigenes, которая, кстати, может быть устойчива к ряду антибиотиков, в том числе связанных с повышенным риском развития мочекаменной болезни, а именно к цефалоспоринам, нитрофурантоину и пенициллинам широкого спектра. Из существующих данных складывается довольно сложный пазл связи микробиома и нефролитогенеза. Возможно, что из-за антибиотиков нарушается равновесие в комплексе оксалобиома, в результате чего и изменяется метаболизм оксалатов. Кроме того, в результате антибактериальной терапии селективное преимущество получают бактерии, устойчивые ко множеству антибиотиков и стимулирующие образование камней. Антибиотики также могут оказывать влияние на некоторые параметры, напрямую не связанные с кишечным микробиомом, например, pH мочи, концентрации фосфата, кальция и цитрата. Изменения концентрации электролитов в моче могут приводить к появлению камней из мочевой кислоты или фосфата кальция. Нельзя также исключать возможность кристаллизации в почках самих антибиотиков, подобное поведение было показано для сульфометоксазолтриметоприма и ципрофлоксацина (Tasian et al., 2018; Nazzal et al., 2018).
Как отмечают авторы, антибиотики могут иметь более весомое значение в группе людей, имеющих предрасположенность к мочекаменной болезни. Кроме того, у детей кишечный микробиом способен резко изменяться, поэтому у них риск развития мочекаменной болезни из-за приема антибиотиков особенно велик (Tasian et al., 2018; Nazzal et al., 2018).
«Мы привыкли считать, что антибиотики краткосрочно нарушают состояние микробиоты кишечника и в большинстве случаев не имеют отсроченных негативных последствий. Но отсроченный негативный эффект может быть существенным, а накапливаемые научные и клинические данные поддерживают представление о связи нефролитиаза с предшествующим применением антибиотиков», — пишут Lama Nazzal и Martin J. Blaser, акцентируя внимание на необходимости информировать об этом клиницистов.
Оксалобиом
Поскольку наиболее часто камни состоят из оксалата кальция, особое значение для мочекаменной болезни имеют кишечные бактерии, способные разрушать оксалат. Совокупность микроорганизмов, метаболизирующих оксалат, получила название оксалобиом. В состав оксалобиома входят такие бактерии, как уже упоминавшаяся Oxalobacter formigenes, Bifidobacterium, Lactobacillus, Escherichia coli, Porphyromonas gingivalis, и другие (Nazzal et al., 2018; Peck et al., 2015).
Оксалобиом можно подразделить на две группы. В группу оксалотрофов- универсалов входят бактерии, которые в качестве источника углерода могут использовать не только оксалат, но и другие соединения. К их числу относятся, например, Bifidobacterium и Lactobacillus. В противоположность им оксалотрофы- специалисты, такие как Oxalobacter formigenes, являются анаэробами, которые получают углерод только в виде оксалата (Hatch, 2016). Представители оксалобиома используют для расщепления оксалата три фермента: мембранный оксалат-формиатный переносчик, формил-КоА-трансферазу и оксалил-КоА- декарбоксилазу.
Oxalobacter formigenes — основной защитник, препятствующий развитию мочекаменной болезни. Так, Kaufman et al. показали, что колонизация кишечника O. formigenes связана с 70% снижением риска рецидива мочекаменной болезни.
А Siener с соавторами показали, что O. formigenes снижает концентрацию оксалатов, доступных для абсорбции в кишечнике, и тем самым защищает от литогенеза. Oxalobacter formigenes не только уменьшает всасывание оксалата, но и способствует выделению оксалата вместе с калом (Mehta et al., 2016).
Кажется логичным, что в отсутствие оксалотрофных микроорганизмов риск мочекаменной болезни должен увеличиваться. Действительно, у больных муковисцидозом O. formigenes полностью отсутствует или присутствует в очень малых количествах, и риск нефролитиаза резко повышен. Однако такая простая зависимость наблюдается не всегда. Например, в Южной Африке у чернокожего населения частота МКБ составляет менее 1%, а у белого населения — около 15%, хотя и у тех и у других численность O. formigenes одинаково низка без значимых различий (Tang et al., 2018; Peck et al., 2015).
По всей видимости, и это отмечено во многих научных статьях, O. formigenes если и первая скрипка, то далеко не сольная. В 2016 году Stern и коллеги сообщили, что им удалось найти различия в составе кишечной микрофлоры у людей, страдающих нефролитиазом и нет. Оказалось, что у пациентов с мочекаменной болезнью в кишечной микрофлоре содержится в 3,4 раза больше бактероидов, чем у контрольной группы, а у контрольной группы бактерий рода Prevotella в 2,8 раза больше, чем у группы с мочекаменной болезнью. Количество бактерий рода Eubacterium в кишечной микробиоте обратно связано с содержанием оксалатов в моче, а численность бактерий из рода Escherichia обратно связана с содержанием цитрата в моче. Было также показано, что состав микробиоты кишечника у пациентов, у которых камни в почках состоят из мочевой кислоты, и пациентов, у которых камни имеют другой состав, в целом не различается (Stern et al., 2016).
Также в текущем году Tang и коллеги показали, что представленность 20 родов бактерий в кишечном микробиоте значительно различалась между пациентами с мочекаменной болезнью и здоровыми людьми. Из этих 20 родов численность бактерий родов Phascolarctobacterium, Parasutterella, Ruminiclostri-dium, Erysipelatoclostridium, Fusicatenibacter и Dorea связана с концентрацией в крови ионов калия, натрия, кальция и хлора.
Было также показано, что при наличии камней в почках в кишечной микробиоте наблюдается повышенная численность провоспалительных бактерий, таких как Megamonas, Phascolarctobacterium, Escherichia, Shigella и Sutterella (Tang et al., 2018).
В этом же году в работе Ticinesi и коллег было показано, что в целом кишечная микрофлора у пациентов с камнями в почках менее разнообразна, чем у людей без МКБ (Ticinesi et al., 2018).
Перспектива
Как и когда человек обзаводится полноценным оксалобиомом — загадка. Но установлено, что у детей, не получавших интенсивную терапию антибиотиками, O. formigenes начинает выявляться в кишечнике примерно в годовалом возрасте, однако откуда эта бактерия попадает в кишечник, неизвестно (Knight et al., 2013). В 3–4 года O. formigenes обнаруживается у всех детей, но в возрасте 8–12 лет у многих детей бактерия исчезает из кишечной микробиоты (Mehta et al., 2016). Также установлено, что в странах с низким доступом к антибиотикам, например в Индии, отмечается наивысшая распространенность O. formigenes. И динамику заселения кишечника O. formigenes, и повышение частоты мочекаменной болезни в развитых странах с участившимися случаями болезни среди детей можно объяснить широким применением антибиотиков, которые примерно в трети случаев назначаются ошибочно. Такое мнение высказывают упомянутые выше Lama Nazzal и Martin J. Blaser.
Нельзя отказаться от антибиотиков, но их применение должно быть строго обоснованным. А превентивными мерами, следующими вместе с назначением антибиотиков и после окончания терапии, должны быть обильное питье, снижение потребления оксалатов и прием пробиотиков (Nazzal et al., 2018).
На настоящий момент попытка создания пробиотиков, содержащих такие оксалат-расщепляющие бактерии, как Oxalobacter, Lactobacillus и/или Bifidobacterium spp, окончилась неудачей (Lieske, 2017): в первые дни после приема пробиотика количество оксалата в моче действительно уменьшилось, но уже через 5 дней уровень оксалата возвращался к значениям до лечения. В то же время пересадка оксалат-разрушающих бактерий из кишечника хищного млекопитающего Neotoma albigula в кишечник лабораторных крыс привела к стойкой колонизации кишечника последних оксалотрофными микробами (Mehta et al., 2016).
Некоторые бактериальные ферменты, расщепляющие оксалат, могут применяться для полного растворения или уменьшения размеров уже сформированных камней. Такая терапия будет особенно подходить пациентам с неоперабельными камнями, пациентам, у которых камни быстро образуются повторно после удаления. Ферменты могут как расщеплять свободный оксалат, так и действовать непосредственно на кристаллы оксалата кальция в уже существующих камнях.
Однако на данный момент ферменты, которые способны расщеплять оксалат эффективно в организме человека, еще не получены. Например, оксалатдекарбоксилаза сенной палочки (Bacillus subtilis) в изолированном виде работает со скоростью, составляющей менее 1,3% от теоретической максимальной возможной скорости. Таким образом, терапия мочекаменной болезни бактериальными ферментами хотя и представляется эффективной, еще требует значительной доработки (Peck et al., 2015).
Заключение
Микробиом — это «второй человеческий геном», или метагеном, который кодирует 3,3 млн уникальных генов, что в 150 раз больше, чем геном самого человека. Поэтому неудивительно, что микробиота способна реализовать множество метаболических функций и трансформаций, которые человеческий организм не в состоянии выполнить собственными силами. Одна из важнейших — это метаболизм оксалатов, с чем придется считаться не только урологам, но и всем врачам.
Однако и переложить всю ответственность на микробиом и антибиотики едва ли верно. Слишком сложны механизмы. И например, Поль де Крюи в «Охотниках за микробами» отмечает, что Левенгук, изучая микромир, отмечал, что в дни, когда он обеспокоен поносом, в его собственных испражнениях особенно много «крохотных животных». Однако он никогда не связывал понос с самими «животными», отмечая бесконечную сложность каждого явления и опасность без тщательного анализа принимать за главную какую-либо одну причину из сложного сплетения всех.
Оптимизм о перспективах трансплантации фекальной микробиоты или создании энзимов от камней преждевременен. Пока основной посыл, озвученный мировыми экспертами в литературе, – разумное применение антибиотиков как возможность профилактики мочекаменной болезни. И это основное, что должен взять себе на заметку каждый врач, отмечено в публикации American Society of Nephrology.
Список литературы находится в редакции

















