Статьи
Младенческие гемангиомы: современный взгляд на проблему
Младенческие, или инфантильные, гемангиомы — распространенная проблема у детей раннего возраста. Дебютирует в период новорожденности с возможным развитием осложнений, приводящим к функциональным или эстетическим нарушениям. Важны своевременная диагностика данной патологии и ранний старт лечения, первой линией которого на современном этапе считается системная фармакотерапия пропранололом.
ОБЩИЕ СВЕДЕНИЯ
Младенческая, или инфантильная, гемангиома (МГ)—наиболее распространенное доброкачественное сосудистое опухолевидное новообразование, которое диагностируется у 5–10 % младенцев в течение первого года жизни. Характеризуется быстрым ростом и медленным спонтанным разрешением без существенных последствий в большинстве случаев. До 60 % МГ локализуются в челюстно-лицевой области.
К факторам риска развития МГ относят принадлежность к женскому полу, недоношенность, низкую массу тела при рождении и отягощенный по МГ семейный анамнез. Риск МГ увеличивается на 25 % на каждые 500 г дефицита массы тела при рождении.
С повышенной частотой МГ связано наличие двух синдромов: синдрома PHACE (акроним от Posterior fossa abnormality, Hemangioma, Arterial anomaly, Cardiac defects, Eye abnormality—дефекты задней черепной ямки, сегментарные гемангиомы в области лица и/или волосистой части головы, аномалии сосудов головного мозга, сердечно-сосудистые аномалии и аномалии глаз) и синдрома LUMBAR (Lower body IH, Urogenital anomalies, Ulceration, Myelopathy, Body deformities, Anorectal malformations, Arterial anomalies, Renal anomalies—гемангиомы нижней части тела, урогенитальные аномалии, изъязвление, миелопатия, деформации тела, пороки развития, артериальные и почечные аномалии). Синдром PHACE может также включать гемангиомы печени. LUMBAR-синдром ассоциирован с гемангиомами нижней части тела, часто затрагивающими пояснично-крестцовую область.
В 30 % случаев МГ регрессируют без последствий, но большая часть формирует резидуальные явления в виде атрофических рубцов, синдрома дряблой кожи, телеангиоэктазий, фиброзножировых изменений. Существует и риск осложнений (язвы, кровотечения и др.). Для стратификации рисков и принятия решений о тактике лечения разработаны соответствующие инструменты классификации и оценки степени тяжести МГ.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина МГ определяется стадией поражения.
1. Стадия начальных проявлений характеризуется наличием с самого рождения участка покраснения (или побледнения) кожи или слизистой оболочки. Родители чаще всего воспринимают это как потертость, синячок или царапину.
2. Стадия пролиферации (активного роста) заявляет о себе трансформацией внешних признаков МГ. В возрасте 2–3 недель подозрительное пятнышко начинает расти и приобретает насыщенную ярко-красную или багрово-синюю окраску. МГ становится плотной и горячей при пальпации из-за локального повышения температуры.
3. Стадия стабилизации и начала инволюции (4–6 месяцев) знаменуется остановкой роста и побледнением очага сосудистого поражения. Эти изменения происходят постепенно, как правило, от центра к периферии.
4. Стадия выраженной инволюции выражается в том, что очаг сосудистой гиперплазии уменьшается в объеме, становится менее плотным при пальпации, приобретает еще более светлый оттенок.
Продолжительность стадий зависит от начальной площади поражения, объема и глубины вовлеченных в процесс тканей, проводимой терапии.
5. Стадия резидуальных (остаточных) проявлений —конечный этап развития МГ. Длительность и степень регресса образования варьируют от частичного (телеангиоэктазии, объемные фиброзно-жировые комплексы в толще тканей) до полного разрешения в течение 1–10 лет.
Следует отметить, что самопроизвольной инволюции подвергаются до 70–90 % сосудистых поражений и лишь 10 % пациентов требуют назначения терапии. К факторам, определяющим необходимость лечения МГ, относятся локализация, распространенность, глубина, множественность сосудистых образований, наличие ассоциированных аномалий (синдромы РНАСЕ и LUMBAR), а также осложнения, вызывающие функциональные и косметические дефекты.
ТРУДНОСТИ ДИАГНОСТИКИ
В связи с разнообразием сосудистой патологии у детей важна своевременная и правильная диагностика МГ. Впервые ребенок может попасть в поле зрения не только педиатра, но также хирурга, кардиолога, онколога. Диагностика включает клинический осмотр младенца, сбор подробного анамнеза (течения беременности и семейного), оценку стадии развития образования. Для уточнения объема и глубины поражения, определения его гемодинамических особенностей, топографии, а также с целью дифференциальной диагностики используются ультразвуковые методы обследования (рис. 1–3).
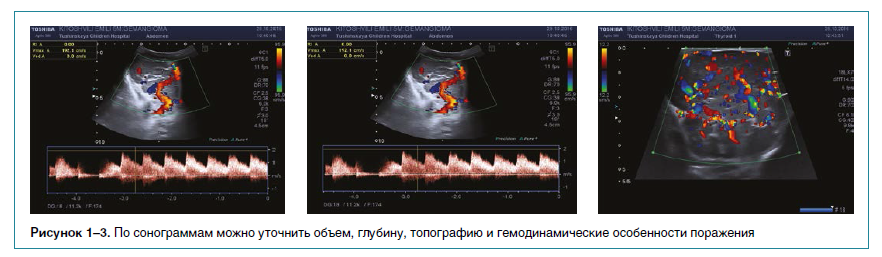

Детальная оценка топографии при необходимости хирургического вмешательства производится при помощи магнитно-резонансной или компьютерной томографии с контрастированием. Морфологические исследования (гистологическое, иммуногистохимическое) осуществляются для оценки пролиферативной активности клеток эндотелия и определения специфических белковмаркеров. При появлении стридорозного дыхания показано проведение прямой ларингоскопии для исключения подскладочной гемангиомы гортани, а при множественных кожных МГ — ультразвукового исследования печени для исключения мультифокальных гемангиом.
К уникальным особенностям МГ относятся:
- появление в течение первых недель жизни;
- быстрый рост с последующей постепенной медленной инволюцией;
- положительное иммуногистохимическое окрашивание биопсийных образцов на белок-транспортер глюкозы эритроцитарного типа (GLUT-1). GLUT-1 экспрессируется на протяжении жизненного цикла МГ и может использоваться для дифференциальной диагностики МГ и сосудистых мальформаций.
ПОЧЕМУ МГ ВОЗНИКАЮТ
Этиология МГ неизвестна. Предложен ряд гипотез патогенеза — например, теория происхождения из плаценты с участием внутренних и внешних триггерных факторов. К эндогенным триггерным факторам относятся нарушения регуляции ангиои васкулогенеза. Из внешних провоцирующих факторов наиболее значимы пренатальная гипоксия (ПГ), а именно анемия беременных, гестоз, обвитие плода пуповиной, фетоплацентарная недостаточность, многоплодная беременность и др. ПГ способствует формированию МГ за счет активации ангиогенных факторов, приводящих к гиперплазии эндотелия капилляров. Сочетание внутриутробной гипоксии с повышенной частотой этих образований у маловесных новорожденных и недоношенных подтверждает данную гипотезу.
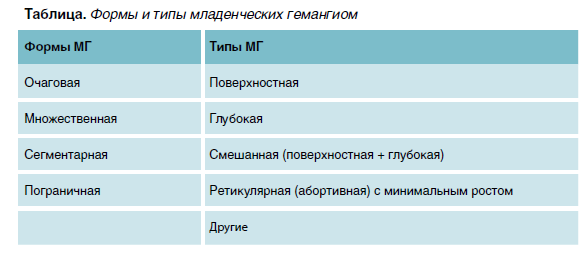
Актуальность проблемы МГ определяется высокой распространенностью, ранним началом заболевания (с периода новорожденности), частым развитием осложнений в виде изъязвлений, нагноений, кровотечений. У данной категории педиатрических больных в дальнейшем наблюдаются функциональные и эстетические нарушения, которые могут стать причиной дыхательной недостаточности при подскладочных гемангиомах гортани, сердечной недостаточности и легочной гипертензии при гемангиомах печени, амблиопии при гемангиомах периорбитальной области. Остаточные явления в виде рубцов, атрофии и фиброзно-жировых изменений нередко становятся причиной психологического стресса как у детей, так и родителей. Формы и типы младенческих гемангиом представлены в таблице.
АЛГОРИТМ ЛЕЧЕНИЯ
Традиционно при выявлении МГ применялись консервативные и инвазивные методы лечения с локальным или системным воздействием. Стратегия выбора того или иного метода зависит от возраста пациента, размера, формы и типа, стадии и локализации сосудистого образования. В качестве лекарственных средств использовались глюкокортикостероиды (ГКС), винкристин, интерферон, а в качестве инвазивных методов воздействия на МГ— криодеструкция, лазерная хирургия, склерозирование и эмболизация питающих сосудов, хирургическое удаление. Сейчас ряд ранее применявшихся методов нельзя считать адекватными. Один из наиболее распространенных подходов к лечению МГ — системная фармакотерапия. Ранее в этом качестве широко использовались ГКС, однако их применение у детей ограничено побочными эффектами.
Современная терапия первой линии при МГ предполагает применение блокаторов β-адренорецепторов. После случайного открытия в 2008 году влияния пропранолола на МГ медикаментозная терапия данным препаратом стала самым распространенным консервативным методом лечения МГ во всем мире с доказанной эффективностью.
Пропранолол относится к неселективным бета-адреноблокаторам. Препарат конкурентно блокирует как β-1-адренорецепторы, находящиеся в сердце, так и β-2-адренорецепторы, которые преимущественно локализуются в бронхах и периферических сосудах.
Случайно обнаруженный положительный эффект пропранолола при лечении МГ основан на способности препарата вызывать периферическую вазоконстрикцию, в том числе и в сосудах МГ, благодаря уменьшению образования и высвобождения мощного вазодилататора — оксида азота (NO). Кроме того, пропранолол ингибирует процессы ангиогенеза, снижая экспрессию VEGF (васкулоэндотелиального фактора роста) и FGF (фактора роста фибробластов). В процессе ангиогенеза также принимают участие матриксные металлопротеиназы (ММР-2 и ММР-9), уровень которых повышается в фазу пролиферации инфантильных гемангиом. Их деятельность регулируется β-адренорецепторами. Пропранолол ингибирует деятельность ММР-2 и ММР-9, снижая тем самым активность ангиогенеза. Также установлено, что пропранолол запускает процессы апоптоза эндотелиальных клеток.
В результате периферической вазоконстрикции на фоне приема пропранолола уменьшается скорость кровотока в МГ. При системном воздействии МГ бледнеет, делается менее плотной, снижается местная температура — и все это уже на вторые сутки от начала приема препарата.
До недавнего времени лечение пропранололом относилось к оff-label терапии, поскольку проводилось с отступлениями от инструкции по применению препарата. В связи с этим данное лечение оказывалось возможным только после получения разрешения соответствующих этических комитетов медицинских учреждений и информированного согласия родителей.
Сегодня в мире, включая Россию, пропранолол официально зарегистрирован для лечения пролиферирующих МГ у детей, требующих системной терапии, в виде препарата Гемангиол (Hemangiol, Pierre Fabre DERMATOLOGIE, Франция) как новый стандарт лечения. Это специальная пероральная форма пропранолола для детей в виде сиропа. Многоцентровые плацебо-контролируемые исследования по применению препарата Гемангиол показали положительную динамику после 5 недель лечения у 88 % пациентов. А к 24-й неделе лечения терапевтическая эффективность была доказана у 60 % больных. При доказанной эффективности и безопасности Гемангиол был включен в европейские и американские международные рекомендации по лечению МГ. Сегодня это первый и единственный педиатрический препарат, одобренный для лечения данной патологии.
Применение других бета-блокаторов, в частности атенолола и надолола, которые иногда назначают как в России, так и за рубежом, относится к оff-lable терапии. Кроме того, следует отметить, что атенолол обладает большей кардиоселективностью, чем пропранолол, следовательно, имеет большее влияние на сердечно-сосудистую систему.
Хирургическое лечение в наши дни применяется у детей с угрожающими жизни обструктивными МГ различных локализаций, а также при неэффективности лекарственной терапии. Кроме того, хирургический метод лечения нашел применение при МГ в стадии инволюции с остаточными деформациями кожи, атрофическими и гипертрофическими рубцами, участками растянувшейся, потерявшей эластичность кожи, а также остаточной фиброзно-жировой тканью, создающей избыточные объемы, что приводит к значительным эстетическим и функциональным нарушениям. Преимущество хирургического лечения именно на стадии инволюции обусловлено уменьшением риска кровотечения и потенциально меньшим размером поражения в связи с естественным течением процесса.
Определенное место в программе лечения МГ занимает селективная лазеротерапия. В доступной литературе имеются отдельные сообщения о применении импульсных лазеров на красителе (ИЛК) для лечения МГ, которые превосходят по эффективности другие типы лазеров. Использование ИЛК — эффективный и безопасный метод удаления остаточной эритемы и поверхностных телеангиэктазий в регрессирующих гемангиомах. Использование лазера наиболее оправданно при поверхностных (простых) МГ небольших размеров.
Местное лечение аппликациями пропранолола в виде препарата Тимолол эффективно только при простых МГ небольших размеров.
С 2010 г. на базе перинатального кардиологического центра при ГКБ № 67 и кардиологического отделения ДГКБ им. З.А.Башляевой г. Москвы совместно с кафедрой госпитальной педиатрии им. академика В.А. Таболина ФГАОУ ВО «РНИМУ им. Н.И.Пирогова» Минздрава России проводится медикаментозное лечение неселективным β-адреноблокатором пропранололом детей с МГ различной локализации, включая печень, гортань, а также наиболее тяжелых больных с PHACE(S)-синдромом. С 2019 года в число пролеченных пациентов вошли 80 детей, получивших лечение препаратом Гемангиол.
Все пациенты обследовались и получали лечение согласно разработанному коллективом авторов протоколу с динамической оценкой эффективности и безопасности терапии, включая оценку состояния сердечно-сосудистой системы
Накопленный опыт успешного применения пропранолола (более 600 пациентов) позволил создать на базе кардиологического отделения ДГКБ им. З.А. Башляевой Центр компетенции по лечению МГ у детей, где в рамках системы ОМС проводятся комплексное лабораторно-инструментальное обследование (рис. 1–3), системная фармакотерапия и динамическое наблюдение за пациентами с МГ, осуществляется индивидуальный подход к тактике назначения пропранолола, коррекции доз препарата, а также к продолжительности лечения для достижения максимальной эффективности проводимой терапии и минимизации развития рецидивов (ребаунд-синдром).
Составленный и внедренный в клиническую практику алгоритм ведения пациентов с МГ, слаженная работа команды специалистов (детских кардиологов, офтальмологов и оториноларингологов, врачей функциональной и ультразвуковой диагностики, хирургов и специалистов по лазерному лечению) — все это позволяет избежать применения агрессивных методов терапии данной патологии и повысить качество жизни маленьких пациентов.

















