Статьи
На разных берегах
Общая vs безрецидивная
Достоверное улучшение безрецидивной выживаемости стало достаточным аргументом для экспертов FDA, чтобы проголосовать «за». Однако Европейское медицинское агентство (ЕМА), в отличие от FDA, не одобрило сунитиниб
к использованию в адъювантном режиме.
Европейские эксперты посчитали неправильным утверждать к применению высокотоксичный препарат, не продлевающий жизнь больных. Axel Bex из Netherlands Cancer Institute (Амстердам, Голландия), выступая на конгрессе ЕАУ 2018, пояснил: «В исследовании S-TRAC у четко определенной группы больных, имеющих высокий риск прогрессирования, удалось достичь статистически значимого увеличения безрецидивной выживаемости, однако при достаточно длительном наблюдении не было выявлено даже тенденции к увеличению общей выживаемости, что не позволяет нам принять этот препарат к использованию в адъювантном режиме». Также соглашается с мнением европейских коллег американский эксперт доктор Sumanta Kumar Pal, руководитель исследований по раку почки в медицинском центре City of Hope (Лос-Анджелес, США). Он не считает большим достижением продление безрецидивной выживаемости на 1 год в результате годичного применения довольно токсичного препарата, если нет значимого увеличения общей выживаемости.
Дискуссионным остается вопрос выбора первично оцениваемого параметра в исследовании. Thomas Powles из Barts Cancer Institute (Лондон, Великобритания) на конгрессе ЕАУ 2018 отметил, что считает рациональным методом оценку безрецидивной выживаемости как главного маркера эффективности терапии, в том числе при проведении высокотоксичного лечения. «В большинстве исследований по адъювантной терапии солидных опухолей именно безрецидивная выживаемость изучается как первичная конечная точка, поскольку тенденции в ее различии проявляются раньше, чем при оценке общей выживаемости, что позволяет за меньший период наблюдения сделать выводы об эффективности терапии, — сказал эксперт. — При этом надо понимать, что безрецидивная выживаемость может быть достоверным отражением эффективности лечения только тогда, когда мы видим хотя бы минимальное, пусть даже недостоверное расхождение кривых общей выживаемости. В таком случае мы понимаем, что при отсутствии видимого выигрыша в выживаемости “сейчас” мы можем рассчитывать на какой-то эффект “потом”, уже за рамками периода наблюдения в исследовании. В исследовании S-TRAC кривые общей выживаемости, представленные, кстати, только в дополнительных к статье материалах, не расходились, так что я считаю, что EMA приняло правильное решение».
Интересен тот факт, что 6 членов экспертной комиссии FDA, проголосовавших «за», посчитали, что данные по общей выживаемости в исследовании S-TRAC были недоступны и что улучшение безрецидивной выживаемости может отображать потенциальное улучшение общей. Учитывая, что данные по общей выживаемости не были включены в основной текст статьи, могло ли так получиться, что эксперты FDA не были осведомлены о наличии оцененных данных по этому показателю за 8-летний период наблюдения?
К тому же, почему FDA одобрило к использованию препарат на основании только одного положительного исследования при наличии целого ряда исследований с отрицательными результатами — еще один вопрос, которым задаются европейские эксперты. «Принимая во внимание только исследования с положительными результатами и игнорируя общий пул доказательной базы, такими решениями мы можем навредить пациентам», — отмечает британский эксперт по фармакоэкономике Bishal Gyawali, реагируя на решение FDA (JAMA Oncol, 2018).
Другие данные
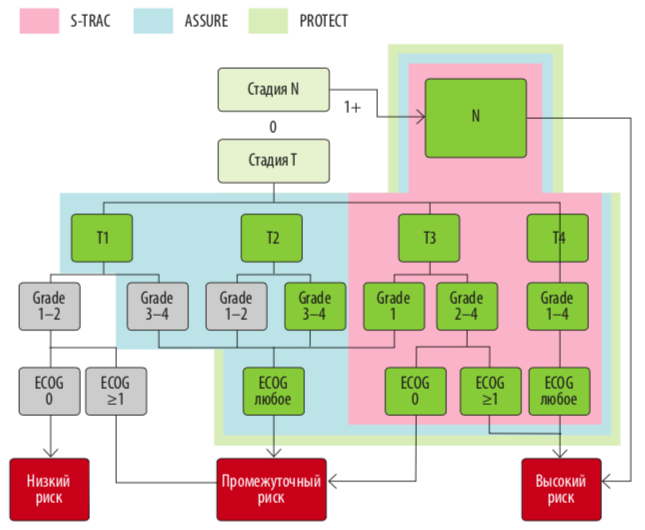
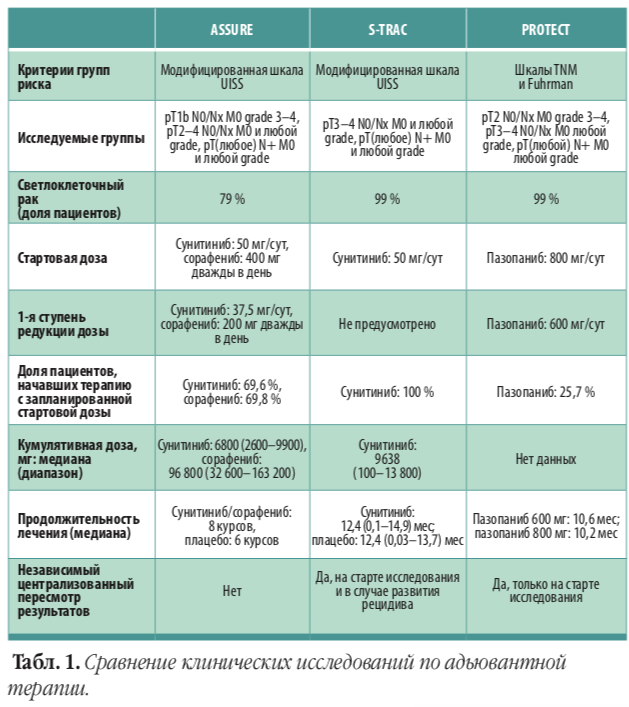
Эффективность адъювантной терапии рака почки уже оценена в трех рандомизированных исследованиях: ASSURE, S-TRAC и PROTECT. В исследовании ASSURE 1943 больных с промежуточным или высоким риском рецидива (>T1b G3–4 и/или N+) после оперативного лечения были рандомизированы в отношении 1:1:1 и по-лучали сунитиниб (50 мг/сутки), сорафениб (400 мг дважды в сутки) или плацебо. Исследование не выявило различий в общей и безрецидивной выживаемости, в том числе в группе высо-кого риска (pT3–T4 или N+) (JAMA Oncol, 2017). Исследование PROTECT объединило 1538 больных с промежуточным и высоким риском рецидива (>T1b G3–4 и/или N+), которые после нефрэктомии в течение года получали пазопаниб 800 мг/сутки или плацебо, однако, как и в исследовании ASSURE, в последующем начальная доза препарата была снижена (до 600 мг/сутки). Различий в безрецидивной выживаемости между двумя сравниваемыми группами выявлено не было, однако при анализе вторичной конечной точки (безрецидивная выживаемость в группе больных, получающих 800 мг пазопаниба) было выявлено снижение риска рецидива на 31 % по сравнению с плацебо (ОР 0,69; 95 % ДИ 0,51–0,94) (J Cin Oncol, 2017).
Правомерно ли вообще сравнивать исследования S-TRAC и ASSURE и чем могут быть обусловлены различия? Наиболее вероятными причинами неоднородных результатов могут быть различия в характеристиках больных и профиле корректировки доз препарата. Во-первых, в исследование ASSURE были также включены больные раком почки стадии T1b и Т2 высокой степени дифференцировки G3–4, в то время как в исследование S-TRAC вошли пациенты с более распространенной стадией заболевания (T3 и Т4). Эта разница отразилась в увеличении на год медианы безрецидивной выживаемости у больных, получающих плацебо, в исследовании ASSURE. Во-вторых, примерно у 20 % пациентов в исследовании ASSURE был несветлоклеточный рак почки, при котором терапия ингибиторами VEGF имеет меньший эффект. В-третьих, в исследовании ASSURE только 69,6 % пациентов начинали терапию с суточной дозы сунитиниба 50 мг, в то время как в исследовании S-TRAC всем пациентам начинали терапию с такой дозы. К тому же в ASSURE допускалась максимальная редукция дозы до 25 мг, в отличие от исследования S-TRAC, где минимально применяемой дозировкой были 37,5 мг. Axel Bex считает, что возможность проведения пациенту лечения на максимальной дозе очень важна.
«Если мы можем после операции начать терапию с дозы 50 мг и длительно не снижать ее из-за побочных явлений, то, возможно, это и принесет свой эффект, однако не все пациен-ты могут выдержать такую терапию», — отметил эксперт. Интересны данные Amirali Salmasi, который посчитал, что только 30 % пациентов из исследования ASSURE по своим характеристикам и режиму проведенной терапии (стартовая доза и ее последующая редукция) соответствовали критериям включения исследования S-TRAC (Eur Urol, 2018). Можно ли на основании всего вышеизложенного сделать вывод, что S-TRAC является наиболее качественным исследованием из существующих?
На конгрессе ЕАУ 2018 итальянские и канадские ученые представили мета- анализ исследований ASSURE, S-TRAC и PROTECT, результаты которого подтвердили позицию европейских экспертов о неэффективности адъювантной терапии (Eur Urol Suppl, 2018). В мета-анализе не выявлено значимого улучшения безрецидивной и общей выживаемости, в том числе при совместном анализе с группой пациентов исследования PROTECT, получавших пазопаниб 600 мг (ОР 0,92; 95 % ДИ 0,82–1,03) для БРВ и 0,99 (95 % ДИ 0,85–1,17) для ОВ или пазопаниб 800 мг (ОР 0,87; 95 % ДИ 0,73–1,04) для БРВ и 1,04 (95 % ДИ 0,89–1,22) для ОВ. Ранее был опубликован другой мета-анализ, объединивший только исследования ASSURE и S-TRAC (Ann Oncol, 2017), который также выявил, что сунитиниб в адъювантном режиме не позволяет повысить безрецидивную или общую выживаемость, при этом лечение сопровождается высокой частотой побочных эффектов.
Нельзя не отметить, что два других тирозинкиназных ингибитора ангиогенеза, сорафениб в исследовании ASSURE и пазопаниб в исследовании PROTECT, также не позволили продлить выживаемость при их использовании в адъювантном режиме.
Конфликт интересов?
Общий пул доказательных данных позволяет склоняться к тому, что адъювантная терапия сунитинибом не приносит никакого эффекта. Комментируя решение FDA, британский эксперт по фармакоэкономике Bishal Gyawali сказал: «Не хотелось бы думать, что к принятию вредоносного для пациентов решения привело недопонимание или неполное восприятие экспертами FDA полноты доказательных данных по этому вопросу» (JAMA Oncol, 2018). Ряд экспертов даже попытались увидеть в решении FDA коммерческую подоплеку, учитывая, что исследование S-TRAC проводилось при спонсировании фирмой, являющейся производителем сунитиниба. C финансовой точки зрения, для производителя очень выгодно получить одобрение препарата к использованию в адъювантном режиме, а не только у больных с прогрессированием заболевания.
К примеру, в исследовании по использованию сунитиниба у больных метастатическим раком почки средняя продолжительность лечения составляла 6 месяцев, а в условиях реальной клинической практики этот период может быть даже меньше, в то время как в адъювантном режиме препарат применяется значимо дольше (на протяжении года) и у всех пациентов, перенесших операцию и способных перенести терапию.
Что дальше?
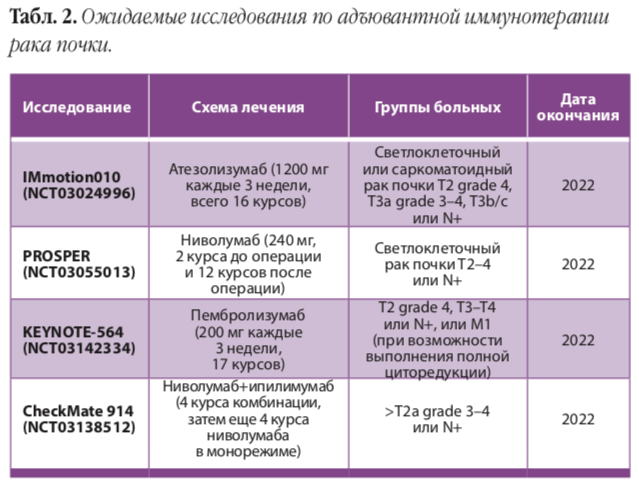
Особенность настоящего научного тренда — преобладание работ по изучению иммунотерапии. Наиболее ожидаемые исследования представлены в таблице выше. Но таргетная терапия не остается на задворках научного поиска, и в ближайшее время ожидаются результаты ряда клинических исследований, таких как исследование SORCE (сорафениб 1 год vs. сорафениб 3 года vs. плацебо), исследование ATLAS (акситиниб 3 года) и исследование EVEREST (эверолимус 1 год).
Большие надежды на высокую эффективность иммунотерапии, в первую очередь, связаны с гипотезой, что неэффективность таргетной адъювантной терапии обусловлена малым влиянием на микрометастазы и невозможностью последующего «переключения» режима терапии в случае системного проявления болезни. «Складывается впечатление, что иммунотерапия помогает добиться высокой частоты полных ответов, что позволяет рассчитывать на нее как на полноценную профилактику рецидива заболевания», — отметил Thomas Powles.
Заключение
Пока большинство научных данных подтверждает отсутствие эффекта от адъювантной терапии у больных раком почки после хирургического лечения. Однако разное отношение международных экспертов к имеющимся данным не позволяет однозначно высказаться об оптимальном подходе к лечению таких больных. Большие надежды на улучшение результатов лечения связаны с исследованием новых препаратов, а также с более точным определением клинических и молекулярных критериев, позволивших бы определить группу пациентов, которым проведение адъювантной терапии принесет пользу.

















