Статьи
Олапариб в лечении мКРРПЖ: результаты исследования PROfound
Исследование III фазы с отбором пациентов с метастатическим кастрационно-резистентным раком предстательной железы (мКРРПЖ) по генетическим маркерам PROfound дало положительные результаты в отношении терапии олапарибом. Это подтверждает важность подбора противоопухолевых препаратов при мКРРПЖ на основе данных генетического тестирования.
ПРОБЛЕМА В ЦИФРАХ
Рак предстательной железы во всем мире характеризуется высоким уровнем заболеваемости и смертности и рассматривается как серьезная угроза общественному здоровью. РПЖ является пятой по значимости причиной смерти от онкологической патологии у мужчин во всем мире: в одном только 2018 году было зарегистрировано 358 989 летальных исходов (общая смертность среди всех пациентов с РПЖ). Стандартизованный показатель смертности от РПЖ в мире составил 7,6 на 100 тысяч населения. В последние годы заболеваемость РПЖ возросла, вероятно, вследствие урбанизации и изменения образа жизни современных мужчин. Самая высокая распространенность РПЖ зарегистрирована в Европе, Азии и Северной Америке: 449,8 тыс., 297,2 тыс. и 234,3 тыс. новых случаев в год соответственно. В 2018 году в мире было диагностировано более 1,3 млн случаев данной патологии, в структуре заболеваемости за 2020 год, согласно прогнозам, ожидается порядка 2 млн новых пациентов, а летальный исход прогнозируется у 33 000 из них.
РПЖ относительно редко диагностируется у мужчин младше 50 лет, но по достижении этого возраста частота заболевания многократно возрастает. Злокачественная трансформация клеток при РПЖ развивается как многостадийный процесс, начинающийся с интраэпителиальной неоплазии и эволюционирующий в РПЖ. На ранних стадиях стратегией выбора является применение радикальной простатэктомии и локальной лучевой терапии. В случае дальнейшего прогрессирования после операции целесообразны андрогенная депривация или подавление активности андрогенов. Такая тактика основана на том, что первичная опухоль предстательной железы в основном состоит из клеток, экспрессирующих рецепторы к андрогенам и изначально являющихся андрогензависимыми. Даже при наличии ответа на антиандрогенную терапию в течение первых 14–20 месяцев лечения с течением времени почти у всех пациентов развиваются резистентность и прогрессирование в кастрационно-резистентный рак предстательной железы с первичным метастазированием в лимфатические узлы или кости (мКРРПЖ). РПЖ на поздних стадиях неизлечим, неизбежно прогрессирует и часто приводит к летальному исходу: у 40 % больных развивается метастатическая болезнь, а 5-летняя выживаемость мужчин с метастазами составляет около 30 %.
БИОЛОГИЧЕСКАЯ ГЕТЕРОГЕННОСТЬ
Метастатический КРРПЖ известен как биологически гетерогенное заболевание. Приблизительно 90 % пациентов с данным диагнозом имеют геномные отклонения в AR, PI3K, DDR, WNT и путях, связанных с клеточным циклом.
По данным многоцентрового исследования опухолей у больных мКРРПЖ с включением 150 пациентов, примерно 23 % мутаций были идентифицированы в генах репарации ДНК. Пути репарации повреждений ДНК играют важную роль в поддержании целостности генома. Мутации путей репарации повреждений ДНК ассоциированы с более агрессивным течением и неблагоприятными исходами заболевания при некоторых видах рака, в том числе при РПЖ. В последние годы внимание к этим мутациям при РПЖ усилилось, поскольку исследования показали, что их распространенность выше, чем принято было считать ранее.
Исследования полноразмерного генома выявили более 70 ключевых локусов, связанных с небольшим увеличением риска раз вития РПЖ, которые, присутствуя вместе у одного пациента, обуславливают примерно 30 % риска РПЖ в пределах одной семьи. Также были выявлены 7 более редких генетических вариантов с более высоким риском РПЖ. Несколько крупных ретроспективных исследований обнаружили связь между мутациями гена BRCA1/2 и агрессивным течением заболевания. Мутации гена BRCA2, по-видимому, оказывают отрицательное влияние на исходы мКРРПЖ. В целом же именно BRCA1 и BRCA2 являются хорошо изученными генами репарации, осуществляемой посредством гомологичной рекомбинации (HRR). Имеющиеся на сегодняшний день данные свидетельствуют о том, что рак предстательной железы, обусловленный нарушениями HRR, является клинически и гистологически агрессивным заболеванием, при этом большинство имеющихся данных касается мутаций гена BRCA2.
По разным данным, 20–30 % мутаций гена BRCA2 представлены делециями. При РПЖ делеции BRCA2 выявляются в 43,3 % случаев. Исследования показали, что у носителей мутаций BRCA2 риск развития РПЖ выше по сравнению с мужчинами, у которых такие мутации отсутствуют. Национальная сеть по борьбе со злокачественными новообразованиями США (National Comprehensive Cancer Network, NCCN) рекомендует тестировать на предмет гетерогенности BRCA всех пациентов с метастатическим РПЖ и РПЖ на продвинутых стадиях, а также при наличии рака предстательной железы в семейном анамнезе. Таргетная терапия для пациентов с мутацией BRCA не была одобрена, хотя отдельные клинические данные свидетельствуют о том, что у таких пациентов результаты лечения могут улучшаться при применении препаратов на основе платины. Поэтому у пациентов с мКРРПЖ на первый план выступают поддерживающие методы лечения, направленные на продление безрецидивной и общей выживаемости без ущерба для качества жизни, связанного со здоровьем.
ГЕНЕТИЧЕСКИ ДЕТЕРМИНИРОВАННЫЙ ПОДХОД К ЛЕЧЕНИЮ
Результаты клинических исследований последних лет свидетельствуют, что молекулярно-генетическая стратификация подходов к лечению оправданна при мКРРПЖ. Дефекты репарации ДНК встречаются приблизительно в 25–30 % всех спорадических случаев мКРРПЖ. Для эффективной репарации однонитевых разрывов ДНК требуются ферменты из семейства поли (АДФ-рибоза) полимераз (PARP). Модели in vitro показали, что BRCA1- и BRCA2-дефектные клетки чувствительны к ингибиторам PARP. Первым одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) ингибитором PARP стал олапариб. Данный препарат связывается с активным участком фермента PARP, ассоциированного с ДНК, предотвращает его отсоединение и фиксирует PARP на ДНК, тем самым блокируя репарацию. В делящихся клетках это приводит к остановке работы репликационной вилки в месте нахождения комплекса PARP-ДНК и возникновению двунитевых разрывов ДНК. В опухолевых клетках c HRR-дефицитом, на которые воздействовал олапариб, двухцепочечные разрывы могут быть восстановлены только посредством менее совершенных механизмов, что в конечном итоге приведет к клеточной гибели.
В клиническом исследовании II фазы TOPARP олапариб в дозе 400 мг и режиме приема 2 раза в день изучался в качестве монотерапии у пациентов, которые ранее уже проходили активную химиотерапию (все участники ранее получали доцетаксел, 49 (98 %) получали абиратерон или энзалутамид, а 29 (58 %) — кабазитаксел). Секвенирование выявило гомозиготные делеции, мутации (или и то и другое) в генах репарации ДНК. Олапариб показал противоопухолевую активность у пациентов с аберрациями генов репарации ДНК, особенно BRCA1 / 2: на тера¬пию олапарибом ответили 88 % участников с раком предстательной железы с мутацией BRCA. Выживаемость без прогрессирования через год составила 40 %. Медиана общей выживаемости на фоне применения олапариба составила 17,7 месяца у пациентов с мутацией BRCA, 16,6 месяца при мутации ATM и 13,9 месяца при мутации PALB2.
ИССЛЕДОВАНИЕ PROfound: ХАРАКТЕРИСТИКА И ДИЗАЙН
Исследование PROfound представляло собой рандомизированное открытое исследование III фазы по оценке эффективности и безопасности олапариба по сравнению с энзалутамидом или абиратероном у пациентов с мутацией в генах HRR мКРРПЖ. PROfound стало первым исследованием III фазы, оценивающим монотерапию ингибитором PARP при мКРРПЖ с мутациями генов HRR. В него включались пациенты с прогрессированием после гормональной терапии при мРПЖ и/или КРРПЖ.
Когорта А включала 245 пациентов с по меньшей мере одним изменением в BRCA1, BRCA2 или ATM, а когорта Б включала 142 пациента с по меньшей мере одним изменением в любом из 12 других заранее определенных генов. Для рандомизации в исследование PROfound пациентов отбирали при условии прогрессирования заболевания на фоне предшествующей терапии новыми гормональными препаратами (НГП). Предшествующая химиотерапия таксанами разрешалась, но не являлась обязательной. Переход на олапариб был показан после подтверждения прогрессирования заболевания на основе визуализации для пациентов, которые соответствовали определенным критериям:
• задокументированный мКРРПЖ;
• подтвержденная мутация генов HRR в опухолевой ткани;
• зафиксированная прогрессия на предыдущей новой гормональной терапии (НГТ), например абиратерона ацетат и/или энзалутамид для мРПЖ и/или КРРПЖ;
• ECOG-статус 0–2;
• отсутствие в анамнезе терапии PARPi или какой-либо цитотоксической химио-терапии при РПЖ (т.е. химиотерапии на основе платины и митоксантрона).
В итоге в скрининг были включены 4425 пациентов от 206 медицинских центров в 20 странах; у 4047 больных образцы опухолевой ткани были доступны для тестирования. Из этих образцов 2792 (69 %) были успешно секвенированы, квалифицирующие генные мутации были обнаружены у 778 пациентов (28 %). Из них 387 (50 %) соответствовали всем критериям отбора.
Квалифицирующие изменения в генах HRR идентифицировали путем проспективного исследования ткани с помощью ранее составленной панели из 15 генов, прямо или косвенно задействованных в гомологичной рекомбинации (BRCA1, BRCA2, ATM, BRIP1, BARD1, CDK12, CHEK1, CHEK2, FANCL, PALB2, PPP2R2A, RAD51B, RAD51C, RAD51D и RAD54L). Лучше всего изучены и наиболее часто встречаются мутантные гены BRCA1, BRCA2 и ATM — носителей этих мутаций набирали в когорту A, данные которой использовались для анализа первичной конечной точки и основных вторичных конечных точек. Носители мутаций в остальных вышеперечисленных генах были сгруппированы в когорту Б, которая являлась поисковой. Использовался тест секвенирования следующего поколения FoundationOne CDx, разработанный в партнерстве с Foundation Medicine.
В качестве препарата сравнения были выбраны НГП на основании одобрения FDA / EMA, опыта клинической практики и доступных данных. PROfound проводили как открытое исследование, учитывая различные режимы лечения и проявления токсичности в контрольной группе. Анализ первичной конечной точки проводили на основании данных BICR для минимизации систематической ошибки исследователя. Пациенты могли бы перейти из группы НГП по выбору врача в группу олапариба при наличии радиологического прогрессирования и удовлетворительного общего состояния для последующей терапии олапарибом. Из-за прогнозируемой высокой частоты перехода в группу олапариба из группы терапии по выбору врача в качестве основной первичной конечной точки была выбрана подтвержденная радиологически выживаемость без прогрессирования у пациентов по крайней мере с одной мутацией BRCA1, BRCA2 или ATM (когорта А). Основной вторичной конечной точкой являлась общая выживаемость. Вторичные конечные точки включали подтвержденную объективную частоту ответа на терапию, время до прогрессирования болевого синдрома, общую выживаемость, снижение концентрации простат-специфического антигена (ПСА) по крайней мере на 50 % и коэффициент конверсии циркули¬рующих опухолевых клеток.
ЧЕМУ НАУЧИЛ ОПЫТ ИССЛЕДОВАНИЯ PROFOUND
Участникам исследования PROfound удалось достичь первичной конечной точки: олапариб значительно улучшил подтвержденную радиологически выживаемость без прогрессирования у пациентов с изменениями в BRCA1, BRCA2 или ATM по сравнению с НГП по выбору врача (энзалутамид/абиратерон). Олапариб снижал риск прогрессирования или смерти на 66 % по сравнению с препаратами по выбору врача, что является весьма достойным результатом.
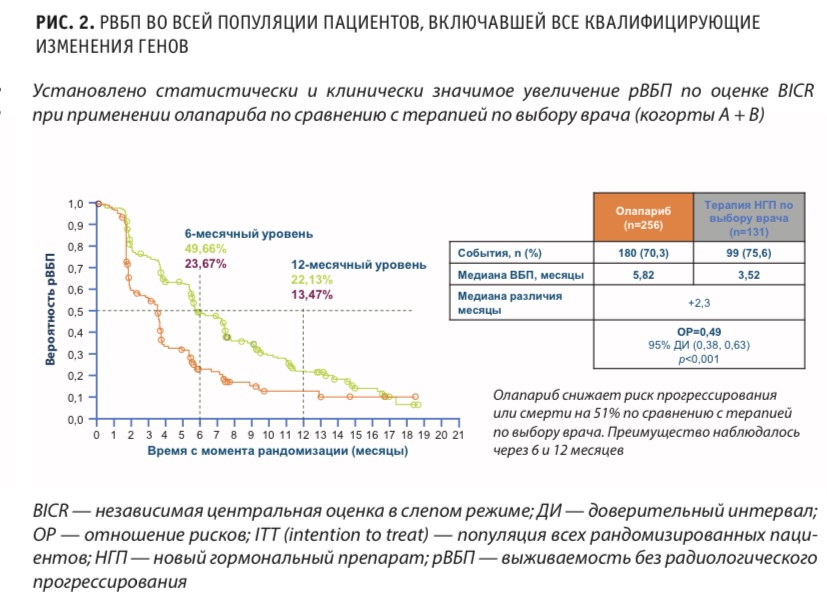
По оценке BICR, при применении олапариба по сравнению с терапией НГП по выбору врача во всей популяции пациентов, включенных в исследование (когорты А+Б), рис. 2, риск прогрессирования или смерти снижался на 51 %. Положительный эффект наблюдался на отметках 6 и 12 месяцев.
Подтвержденная частота объективного ответа на терапию составила 22 % (30 из 138 пациентов) в группе олапариба и 4 % (3 из 67 пациентов) в контрольной группе (ОШ 5,93; ДИ 95 %, 2,01–25,40). Через 6 месяцев болевой синдром больше не нарастал у 85 % пациентов в группе олапариба по сравнению с 75 % в контрольной группе.
Медиана общей выживаемости при промежуточном анализе (зрелость данных 41 %) составила 17,5 месяца в группе олапариба (когорты А + Б) и 14,3 месяца в контрольной группе (отношение рисков смерти 0,67; ДИ 95 %, 0,49–0,93). Среди пациентов контрольной группы 82 % перешли на лечение олапарибом. Анализ зрелых данных по общей выживаемости в когорте А, который являлся заключительным этапом запланированной процедуры множественного анализа, показал, что олапариб демонстрирует статистически значимое увеличение ОВ у пациентов с мКРРПЖ и мутациями генов BRCA1 / 2 или АТМ по сравнению с терапией по выбору врача (рис. 1).
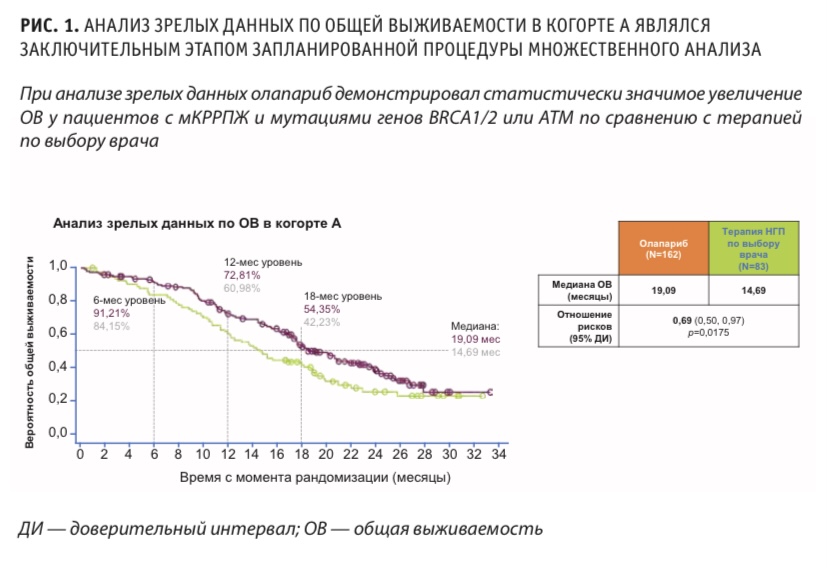
Медиана общей продолжительности назначенного лечения для пациентов в общей популяции участников (когорты А и Б) со составила 7,4 месяца (диапазон от 0 до 22,7) в группе олапариба и 3,9 месяца (диапазон от 0,6 до 19,5) в контрольной группе. Частота нежелательных явлений третьей степени тяжести или более была выше при применении олапариба. Профиль побочных эффектов олапариба был сходен с обычно наблюдаемым при лечении других типов опухолей.
Наиболее частыми нежелательными явлениями любой степени тяжести были анемия, тошнота и повышенная утомляемость или астения при применении олапариба, а также утомляемость или астения при лечении в контрольной группе. В общей сложности в группе олапариба было зарегистрировано 11 случаев тромбоэмболии легочной артерии (4 % пациентов) по сравнению с 1 (1 %) в контрольной группе; ни один из них не был смертельным. Сообщений о миелодиспластических синдромах или остром миелобластном лейкозе не поступало. Три пациента сообщили о новых первичных злокачественных новообразованиях: 1 в группе олапариба (глиома) и 2 в контрольной группе (рак желудка и переходно-клеточный рак). Тромбоэмболия легочной артерии не является признанным осложнением лечения олапарибом, и значимость возникновения этих событий трудно интерпретировать в данной популяции пациентов.
PROfound И СОВРЕМЕННЫЕ ПОДХОДЫ К ТЕРАПИИ мКРРПЖ
Результаты исследования PROfound подтверждают данные исследований 1 и 2-й фазы о противоопухолевой активности олапариба при мКРРПЖ с мутациями в генах гомологичной рекомбинации. Подтвержденная визуализационной методикой рВБП была значительно выше в группе олапариба, чем в контрольной группе среди пациентов по крайней мере с одним изменением BRCA1, BRCA2 или ATM (когорта А), при более низком риске прогрессирования заболевания или смерти (на 66 %) и снижении прогрессирования болевого синдрома. В когорте Б и в общей популяции участников при приеме олапариба рентгенологически подтвержденная ВБП также была выше. Среди пациентов с одним по крайней мере изменением BRCA1, BRCA2 или ATM анализ зрелых данных по общей выживаемости (вторичная конечная точка) показал значимое преимущество олапариба независимо от перехода на олапариб у более чем 80 % пациентов контрольной группы, у которых заболевание прогрессировало.
Таким образом, PROfound является первым положительным исследованием III фазы с отбором пациентов по биомаркерам для оценки таргетной терапии у мужчин с мКРРПЖ. Результаты его подтвердили важность генетического тестирования данной категории пациентов. На сегодняшний день олапариб является единственным PARP-ингибитором с положительными результатами исследований III фазы при четырех различных типах злокачественных новообразований: раке яичников, молочной, поджелудочной и предстательной железы.
Читайте также
- Маммография? Спасибо, не надо!
- SOLAR-1. Алпелисиб – теперь и в России
- Клиническая практика терапии неоперабельного уротелиального рака после прогрессирования
- Рак щитовидной железы: современные возможности и перспективы лечения
- 10 вопросов к главному онкологу о сегодняшнем и завтрашнем дне специальности
- Преимущества таргетной терапии при раке легкого
- Рак желудка после эрадикации H. pylori: призрак или реальная угроза?
- Есть ли место иммунотерапии при ранних стадиях онкологических заболеваний?

















