Статьи
Опыт применения УЗИ с контрастом в прицельной биопсии простаты
Контрастно-усиленное ультразвуковое исследование (КУУЗИ) является относительно новым методом диагностики, который пока не получил распространения в урологической практике. Тем не менее опыт применения такой технологии уже имеется.
По действующим стандартам при подозрении на рак предстательной железы (РПЖ), а именно при повышении уровня ПСА и (или) положительном ректальном исследовании, рекомендуется выполнение систематической биопсии простаты из 8–12 точек. Подобная «слепая биопсия» приводит к гипердиагностике клинически незначимого РПЖ, с одной стороны, и невыявлению клинически значимого РПЖ и точной градирующей группы аденокарциномы—с другой. Такое положение дел привело к развитию прицельной биопсии простаты (ПБП), направленной на выявление только клинически значимых, потенциально летальных аденокарцином простаты.
В настоящий момент наиболее значимыми способами визуализации опухоли простаты являются магнитно-резонансная томография (МРТ) и ультразвуковое исследование (УЗИ). Мультипараметрическое МРТ стало стандартом визуализации РПЖ. В систематическом обзоре 2015 года, посвященном точности МРТ в выявлении клинически значимого РПЖ, прогностическая ценность отрицательного результата составила 63–98 %. РПЖ может быть визуализирован при стандартном трансректальном ультразвуковом исследовании (ТРУЗИ), однако чувствительность данного метода не превышает 35 %.
Все дело в пузырьках
 Технология КУУЗИ заключается в том, что в вену пациента вводится контрастный агент (КА), который позволяет оценить локальные изменения в кровоснабжении в виде ангиогенеза, характерного для клинически значимого неопластического процесса. Контрастный агент представляет собой наполненные газом микропузырьки размером 1–10 нм, покрытые липидной или белковой оболочкой, со «временем жизни» в организме до нескольких минут. При УЗИ эти пузырьки визуализируются как гиперэхогенные структуры. Таким образом, очаги с усиленным кровоснабжением будут раньше остальной паренхимы органа обретать гиперэхогенность и раньше других участков ее терять. На этом эффекте основаны визуализация патологического очага и последующая навигация для ПБП.
Технология КУУЗИ заключается в том, что в вену пациента вводится контрастный агент (КА), который позволяет оценить локальные изменения в кровоснабжении в виде ангиогенеза, характерного для клинически значимого неопластического процесса. Контрастный агент представляет собой наполненные газом микропузырьки размером 1–10 нм, покрытые липидной или белковой оболочкой, со «временем жизни» в организме до нескольких минут. При УЗИ эти пузырьки визуализируются как гиперэхогенные структуры. Таким образом, очаги с усиленным кровоснабжением будут раньше остальной паренхимы органа обретать гиперэхогенность и раньше других участков ее терять. На этом эффекте основаны визуализация патологического очага и последующая навигация для ПБП.
Первым официально зарегистрированным КА в 1991 году стал Эховист, который представлял собой микропузырьки газа с галактозой и обладал коротким временем визуализации из-за разрушения при прохождении кардиопульмонарного барьера. Позже это препятствие было преодолено: в 1994 году появился препарат на основе сонифицированного раствора альбумина Альбунекс, в 1995 году — препарат Левовист, также на основе галактозы, но стабилизированной пальмитиновой кислотой. С 1996 года начинают появляться КА второго поколения, отличающиеся большей стабильностью за счет применения газов с низкой растворимостью, таких как перфторуглерод. К препаратам второго поколения относятся Соновью, Оптизон, Соназоид, Дефинити. Первым КА, зарегистрированным в России, стал Соновью. Наиболее часто он применяется в диагностике заболеваний печени, поджелудочной и щитовидной железы.
Соновью представляет собой гетерогенную фосфолипидную систему, содержащую микропузырьки газа гексафторида серы, стабилизированного пальмитиновой кислотой. В 1 мл готового к использованию препарата содержится около 200 млн микропузырьков. Благодаря малым размерам пузырька (менее 10 мкм), сопоставимым по размеру с эритроцитом, препарат успешно распространяется по кровеносному руслу вплоть до капилляров, но при этом не выходит за его пределы, в отличие, например, от рентгеноконтрастных препаратов и парамагнетиков. «Время жизни» в кровеносном русле Соновью составляет 5–6 минут, что является вполне достаточным для визуализации очагов гиперваскуляризации. Время полувыведения—12 минут, с последующей метаболизацией в печени.
Применение КУУЗИ для диагностики заболеваний простаты в настоящее время не является стандартной рекомендацией, однако в ряде исследований продемонстрирована эффективность этого метода. В исследовании G. Russo было показано, что ангиогенез необходим для развития аденокарциномы простаты от 2 мм до клинически значимого очага. Также данная работа продемонстрировала чувствительность 70 % и специфичность методики 74 % в выявлении РПЖ.
КУУЗИ на практике
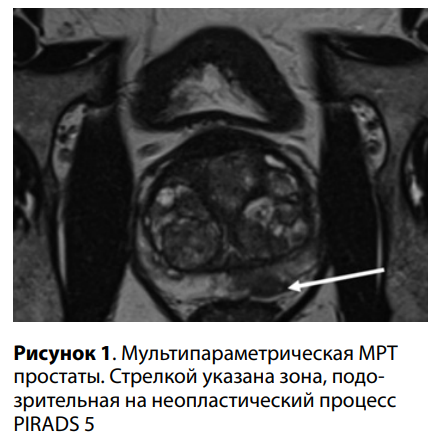
В урологической клинике «Европейского Медицинского Центра» в ноябре 2022 года была впервые проведена ПБП с применением КУУЗИ. В клинику обратился мужчина А., 65 лет, с жалобами на ноктурию 2 раза за ночь. При обследовании было выявлено повышение общего ПСА до 11,2 нг/мл, соотношение свободного и общего ПСА составило 16 %. Пациенту была назначена мультипараметрическая МРТ, которая выявила подозрительный очаг с признаками, соответствующими неопластическому процессу PIRADS 5 (рис. 1). Пациенту была выполнена рандомная биопсия из 12 точек по стандартной методике с предварительным забором ткани из зоны, подозрительной на неопластический процесс. Операция проводилась в условиях процедурного кабинета под внутривенной анестезией в положении на левом боку после предварительной обработки прямой кишки раствором йодинола. С помощью ультразвукового аппарата с применением внутриполостного датчика визуализирована предстательная железа, проведено когнитивное совмещение МРТи УЗ-изображений.
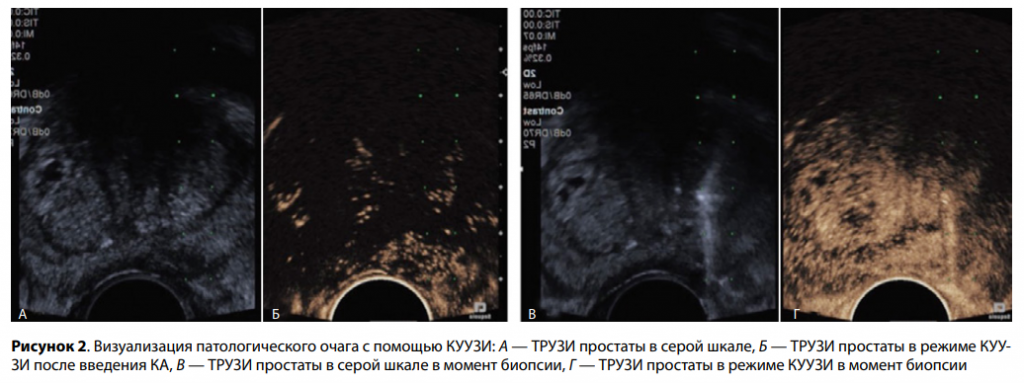
Суспензию микропузырьков препарата Соновью, согласно инструкции, подготовили непосредственно перед введением. Для этого через адаптер к содержимому флакона добавили 5 мл 0,9 %-ного раствора хлорида натрия. После этого флакон аккуратно встряхивали до полного растворения лиофилизата. Согласно инструкции, через периферический венозный катетер диаметром 20 G лиофилизат был введен внутривенно со скоростью 1 мл/с с последующим введением 10 мл 0,9 % раствора хлорида натрия. В течение 10–15 с мы наблюдали поступление КА в предстательную железу, фиксируя изменение эхогенности его ткани. Область с ранним появлением контраста расценена как гиперваскулярная и, как следствие, подозрительная на неопластический процесс. Соответственно прицельная биопсия была выполнена из вышеуказанной зоны (рис. 2). Следует упомянуть, что изолированное контрастирование подозрительного очага продолжается около 15 с, позже вся железа становится гиперэхогенной и невозможно определить патологическую зону.
Применение контрастно-усиленного ультразвукового исследования для диагностики заболеваний простаты в настоящее время не является стандартной рекомендацией, однако в ряде исследований была продемонстрирована эффективность этого метода.
По результатам гистологического исследования при рандомной биопсии получена аденокарцинома простаты Глисон 7 (3 + 4). В материале же, полученном из прицельной зоны, 35 % материала представлено аденокарциномой простаты Глисон 9 (4 + 5). Полученный результат первой ПБП с применением КУУЗИ показывает, что данная технология позволяет выявить зону наиболее агрессивной аденокарциномы, которая определяет прогноз заболевания.

















