Статьи
Первичные иммунодефицитные состояния у детей со злокачественными новообразованиями
Злокачественные новообразования (ЗНО) встречаются в практике педиатра с частотой 13–15 на 100 тысяч детей, а на первом году жизни еще чаще — до 23,3 на те же 100 тысяч. Причем для младенцев наиболее характерны солидные экстракраниальные ЗНО, тогда как у детей постарше преобладают лейкозы и лимфомы.
АКТУАЛЬНАЯ ПРОБЛЕМА
Связь между первичными иммунодефицитными состояниями (ПИДС) и развитием ЗНО у детей интересовала ученых с момента появления понятия о врожденных иммунодефицитах. Первые работы в этом направлении были опубликованы уже в 1970‑е годы. Сегодня данной теме уделяется все больше внимания во многом благодаря формированию крупных регистров ПИДС, а также достижениям генетического секвенирования нового поколения.
ПИДС представляют собой гетерогенную группу наследственных заболеваний, поражающих один или несколько компонентов врожденной и (или) адаптивной иммунной системы. Обнаружено более 500 генетических дефектов, обусловливающих данные заболевания, к наиболее распространенным клиническим проявлениям которых относятся рецидивирующие инфекции, выраженные аллергические реакции, развитие аутоиммунных заболеваний и ЗНО.
По данным международных регистров:
• частота ПИДС составляет 11,2 на 100 тысяч новорожденных;
• в более 70 % случаев они диагностируются в возрасте до 18 лет.
По информации из различных источников риск развития ЗНО у детей с ПИДС оценивается как 5–25 %, а какая именно онкологическая патология возникнет у пациента, в большинстве случаев зависит от вида ПИДС. Обнаружено достаточно много генов, определяющих эту патологию, однако основные механизмы озлокачествления пока еще толком не известны.
Считается, что развитию ЗНО у детей с ПИДС способствует комбинация факторов: сам по себе дефект иммунной защиты, наличие мутаций и воздействие на организм ребенка эндогенных и экзогенных факторов, например, микробиоты. Так, S. Renzi и соавт. в 2020 году описали когорту из 233 пациентов c общим вариабельным иммунодефицитом (ОВИН), у которых в 12,5 % случаев возникли ЗНО. Риск их развития был значительно выше по сравнению с общей популяцией, при этом чаще всего (31 %) встречались лимфомы.
ОСНОВНЫЕ НАРУШЕНИЯ
Приведем основные нарушения иммунной системы, при которых отмечается повышенная частота развития ЗНО.
1. Синдромы хромосомных поломок. К заболеваниям с повышенным числом спонтанных и (или) индуцированных хромосомных аберраций относятся атаксия-телеангиоэктазия— А-Т (синдром Луи-Бар), а также А-Т-подобное заболевание, синдромы Ниймегена и Блума, дефицит ДНК-лигазы 1 и 4, дефициты Цернунноса (Cernunnos) и Артемиды (Artemis).
2. Дефицит антител (АТ). ОВИН —один из наиболее частых иммунодефицитов у взрослых и детей. Сюда относится группа не до конца дифференцированных синдромов с дефектом синтеза АТ: X-сцепленная агаммаглобулинемия (XLA, дефицит тирозинкиназы Брутона, ген BTK), селективный дефицит иммуноглобулина А (IgA), гипер-IgM-синдромы.
3. Дефекты количества и функции нейтрофилов (врожденные нейтропении, дефицит GATA2 при мутации гена гемопоэтического фактора транскрипции). Речь идет о гетерогенной группе наследственных заболеваний с нарушением созревания нейтрофильных гранулоцитов и уменьшением их числа в периферической крови. Дефицит GATA2 был описан в 2010 году. Это состояние имеет черты как иммунодефицита, так и миелодиспластического синдрома.
Сегодня описаны еще три похожих синдрома:
• дефицит дендритных клеток, моноцитов, B-лимфоцитов и естественных киллеров (NK);
• синдром Эмбергера (первичная лимфедема с миелодисплазией);
• семейный миелодиспластический синдром (МДС) и острый миелоидный лейкоз (ОМЛ).
В 2011 году было показано, что все 4 заболевания —результат мутаций зародышевой линии в гене GATA2.
4. Синдромы дизрегуляции — АЛПС, XLP, дефицит CTLA4, LRBA.
5. Комбинированные иммунодефициты — тяжелый комбинированный иммунодефицит (ТКИН), синдром Вискотта — Олдрича, гипер-IgEсиндром, DOCK8, синдромы Ди Джоржди и CHARGE.
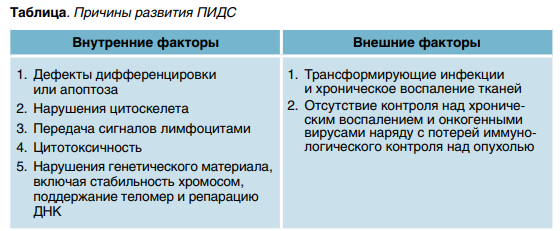
Причины развития ПИДС можно разделить на две большие группы (табл.). В 2022 г. M. Ballow и соавт. описали факторы, которые учувствуют в канцерогенезе при общем вариабельном иммунодефиците. Необходимо отдельно отметить, что разные варианты дефектов связаны разными вариантами ЗНО. Например, вирусные инфекции и пониженная иммунная толерантность приводят прежде всего к развитию лимфом, а для солидных ЗНО должны совпасть иммунная некомпетентность и синдром повышенной ломкости хромосом, что способствует, например, возникновению сарком у таких пациентов.
СОБСТВЕННЫЙ ОПЫТ
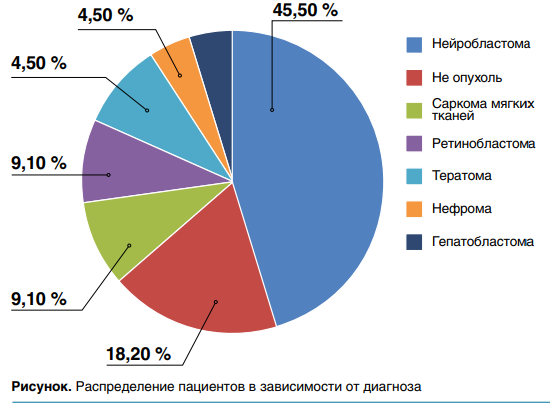
В НИИ ДОиГ имени академика Л.А.Дурнова проводится работа по выявлению ПИДС у детей раннего возраста со ЗНО или подозрением на него. С момента старта работы в 2023 г. обследованы 22 пациента (18 со ЗНО, 4 — не опухоль), соотношение мальчиков и девочек — 10:12. Средний возраст на момент постановки диагноза — 0,8 месяца (от 8 дней до 83,4 мес). В большинстве случаев встречались дети с нейробластомой — 42,1 % случаев (рис.).
Разнообразные изменения обнаружены у 16 пациентов (из них 13 со ЗНО, 3 — не опухоль), не выявлено их у 6 пациентов (из них 5 со ЗНО, 1 — не опухоль). У десяти больных обнаружено по одному гену, у четырех—два, у двух пациентов— более двух генов.
Клинически значимые мутации встречались в трех случаях, подтвержденных клинической картиной заболевания и иммунологическими тестами (CARD9, GATA2, PTPN11). В трех случаях пациенты с выявленными мутациями оставлены под наблюдением (CASP10, MYH9, PIK3CD), а в остальных обнаруженные мутации не сопровождались клиническими подтверждениями того или иного ПИДС.
Изменения генов встречались в основном в гетерозиготном состоянии, но даже при отсутствии гомозиготности возможны различные дефекты иммунитета. вызывающие ЗНО (Mark Bellow соавт, 2022 г.).
У 13 пациентов со ЗНО исходы терапии основного заболевания оказались абсолютно разными: в большинстве случаев терапия была остановлена (30,8 %), тяжелое течение основного заболевания встречалось у 23,1 % пациентов, ранняя прогрессия и смена терапии составили по 15,4 %, гладкое течение и смерть — по 7,7 % случаев.
Разнообразие признаков ПИДС (манифестация заболевания в широком возрастном диапазоне, отсутствие специфических симптомов, прогрессирующий характер) часто приводит к поздней диагностике на уровне первичного звена и несвоевременному оказанию медицинской помощи. Зачастую у детей с ПИДС аутоиммунные или онкологические заболевания развиваются раньше, чем верифицирован иммунодефицит. Это означает, что настороженность должна быть не только у врачей первичного звена, но и у детских онкологов и гематологов. Выявление подлежащего иммунодефицита у пациента с онкологическим заболеванием не исключает лечения ЗНО, а помогает понять механизм его развития и подобрать оптимальный режим терапии. Лечение ЗНО в контексте ПИДС осложняется серьезной токсичностью и долгосрочными эффектами, такими как возникновение вторичных ЗНО.
Цель исследования, проводимого в НИИ ДОиГ им. Л.А.Дурнова, как уже говорилось выше, состоит в выявлении фоновых заболеваний (в том числе ПИДС) у пациентов, поступивших в стационар со ЗНО или подозрением на него. Наблюдались больные:
- нестандартно переносившие специфическое лечение (с серьезными инфекционными осложнениями, требовавшими применения антибактериальных препаратов резерва, противогрибковой и противовирусной терапии);
- длительно восстанавливающие гемопоэз или с плохим ответом на терапию по стандартным протоколам;
- с нехарактерными для данной возрастной группы ЗНО:
- с определенными фенотипическими особенностями (порок сердца, аномалии лицевого скелета и т.д.).
ПЕРВЫЕ ИТОГИ
Из предварительных результатов нашей работы следует, что пациенты со ЗНО и ПИДС требуют индивидуального подхода к лечению как онкологической патологии, так и курации в отношении ПИДС. К ведению таких пациентов следует привлекать междисциплинарную команду с участием детского онколога, иммунолога, гематолога, генетика и других специалистов. Успех лечения определяется диагностикой вовремя и технологическими возможностями оказания специализированной медицинской помощи. Для получения достоверных и качественных результатов необходимо проведение мультицентровых исследований. Специальное противоопухолевое лечение требует от врача ответственности, контроля и настороженности.
Благодаря введению в рутинную практику неонатального скрининга (определение уровней TREC/KREC) теперь удается выявлять ПИДС с дефектом клеточного иммунитета. Это одна из наиболее уязвимых групп больных с данным диагнозом, которым рекомендована трансплантация гемопоэтических стволовых клеток до развития жизнеугрожающих инфекционных осложнений. Но остается проблемой своевременная диагностика и других форм ПИДС. Так как это генетически детерминированные заболевания, важен тщательный сбор семейного анамнеза.
Раннее выявление ПИДС может позволить пациентам получить наиболее подходящую и, главное, своевременную терапию. Ведь дети со ЗНО и ПИДС подвержены высокому писку неблагоприятного исхода из-за развития инфекционных осложнений, вторичных опухолей и др. Своевременная постановка диагноза ПИДС имеет важное прогностическое значение для семей таких пациентов.

















