Статьи
Расширяя границы
Новая опция
В марте 2018 года FDA объявило приоритетной задачей рассмотрение вопроса о расширении показаний к применению энзалутамида. В настоящее время энзалутамид показал свою эффективность в лечении больных с метастатическим кастрационно-резистентным РПЖ как в 1-й линии терапии, так и во 2-й линии после прогрессирования на химиотерапии с применением доцетаксела. В случае положительного решения, которое должно быть принято FDA до июля 2018 года, энзалутамид будет одобрен к применению у больных с неметастатическим кастрационно-резистентным РПЖ (КРРПЖ).
Основанием для такого решения стала публикация результатов исследования PROSPER. Исследование PROSPER — это рандомизированное двойное слепое исследование 3 фазы, сравнивающее эффективность андроген-депривационной терапии (АДТ) в монорежиме с комбинацией АДТ и энзалутамида (160 мг/сутки) у больных КРРПЖ без рентгенологически выявляемых метастазов и со временем удвоения ПСА <10 месяцев.
Исследование показало снижение риска развития метастазов или смерти на 71 %; выживаемость без метастазов (metastases-free survival) среди больных, получивших комбинацию энзалутамида и АДТ, составила 36,6 меся-ца, по сравнению с 14,7 месяца в группе больных, получивших АДТ в монорежиме (ОР, 0,29; 95 % ДИ, 0,24–0,35; P <,0001). Один из руководителей исследования — д-р Cora Sternberg (госпиталь San Camillo-Forlanini, Италия) — во время выступления на ЕАУ 2018 отметила, что, даже несмотря на отсутствие финальных данных по общей выживаемости, уже был намечен тренд на ее улучшение.
Добавление энзалутамида также позволило на 93 % снизить риск биохимического прогрессирования и на 21,9 месяца увеличить медиану времени до применения следующего противоопухолевого препарата. Частота побочных явлений в исследовании значимо не различалась между группами пациентов, получающих комбинацию энзалутамида с АДТ или только АДТ (87 % vs. 77 %), в том числе в отношении выраженных (grade ≥3) побочных явлений (31,4 % vs. 23,4 %).
В настоящее время в США у больных с неметастатическим кастрационно- резистентным РПЖ уже одобрен апалутамид на основании результатов плацебо-контролируемого исследования SPARTAN (N Engl J Med, 2018), в Европе его одобрение ожидается в ближайшее время. В данном исследовании применение апалутамида позволило на 72 % снизить риск развития метастазов или смерти: медиана выживаемости без метастазов увеличилась с 16,2 месяца в группе плацебо до 40,5 месяца при использовании апалутамида (ОР 0,28; 95 % ДИ, 0,23–0,35;P <,0001). «У части больных раком предстательной железы после лечения определяется повышение уровня ПСА в крови без видимого проявления метастатического процесса. До настоящего времени оптимальная тактика лечения таких больных не была определена, современные руководства рекомендуют продолжить андроген-депривационную терапию, а на основании данных исследований мы можем надеяться на значительно лучший результат», — отмечает Cora Sternberg.
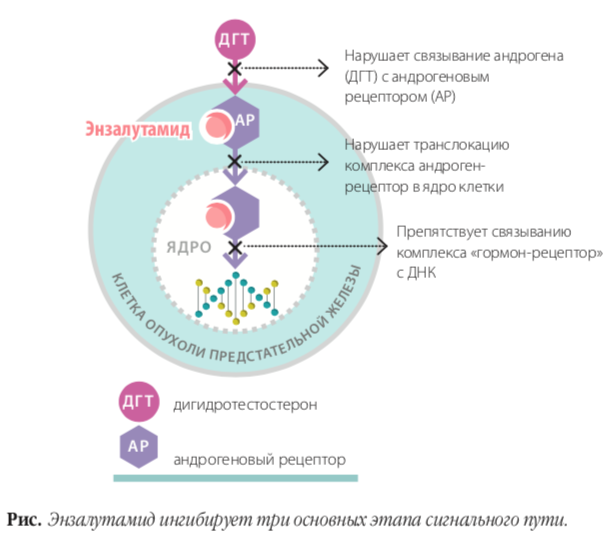
На конгрессе ASCO 2018 были дополнительно представлены результаты анализа качества жизни у больных, вошедших в исследование PROSPER. Изучение этого показателя нельзя недооценивать при проведении терапии пациентов с бессимптомной болезнью, т. е. в том случае, когда получаемое от лечения преимущество не должно быть сведено на нет высокими рисками, связанными с его проведением. Качество жизни, связанное со здоровьем (health-related quality of life), в исследовании PROSPER оценивалось на старте терапии и далее каждые 16 недель по опросникам FACT-P и Brief Pain Inventory.
Большинство пациентов отметили либо повышение уровня качества жизни, либо его стабильный уровень, также исследователи выявили выраженное снижение риска клинически значимого ухудшения качества жизни при использовании энзалутамида, согласно ряду опросников FACT-P.
Таким образом, исследования PROSPER и SPARTAN дали надежду на новый прорыв в лечении больных раком простаты. Рекомендации Американского общества урологов уже успели отреагировать на свежие доказательные данные, и в обновленной версии рекомендаций 2018 года появилось заключение: «У больных с неметастатическим кастрационно-резистентным раком предстательной железы и высоким риском развития метастатической болезни рекомендовано применение энзалутамида или апалутамида на фоне продолжающейся андроген-депривационной терапии».
Новый критерий одобрения
За чередой порой утомляющих статистических данных представленных исследований, а также за новостью об одобрении препаратов со стороны FDA затерялся один важный и интересный факт: впервые для одобрения препаратов к клиническому использованию FDA приняло за основу своего решения положительный результат по такой конечной точке, как выживаемость без метастазов, которая рассчитывается во временном интервале от начала терапии до появления рентгенологически видимых метастазов или летального исхода. Директор Oncology Center of Excellence при FDA д-р Richard Pazdur в пресс- сообщении по этому событию отметил, что «наличие ярко выраженного положительного эффекта в исследовании позволило агентству быть приверженным к использованию новых конечных точек для ускорения принятия к использованию новых эффективных методов лечения». Эксперт FDA Abhi Nair также считает, что использование показателя выживаемости без метастазов как обоснования для принятия препарата к применению как нельзя лучше может отражать эффективность лечения больных с неметастатическим раком предстательной железы. Руководитель исследования PROSPER Maha Hussain (Robert H. Lurie Comprehensive Cancer Center, Чикаго, США) во время выступления на конгрессе ASCO GU 2018 пояснила: «Задержка в проявлении клинически значимых метастазов у больных раком предстательной железы обладает высоким потенциалом в снижении канцер-специфической летальности и увеличении общей выживаемости».
Интересным является вопрос конкуренции одобренных препаратов за преобладание на фармрынке: апалутамид первым получил одобрение при неметастатическом КРРПЖ и имеет больше времени для продвижения у данной категории пациентов, однако энзалутамид для онкоурологов — более знакомый в применении препарат и имеет значительно более широкие показания: две линии терапии метастатического КРРПЖ и неметастатический КРРПЖ. При этом, по данным аналитиков, объем дополнительных доходов для фармкомпаний при одобрении нового показания к применению препаратов может достигать $1 млрд. Тем не менее, однозначного преимущества при неметастатическом КРРПЖ нет ни у одного препарата: результаты исследований практически идентичны, а прямых сравнительных исследований не проводилось.
Заключение
Появление возможности лечения больных с неметастатическим кастрационно- резистентным раком предстательной железы открывает новую главу в лечении этого заболевания. При этом наличие сразу двух препаратов, показавших свою эффективность, дает возможность выбора варианта терапии, что вселяет еще большую надежду на развитие этого направления в лечении пациентов с РПЖ.

















