Статьи
Реактивируя иммунитет
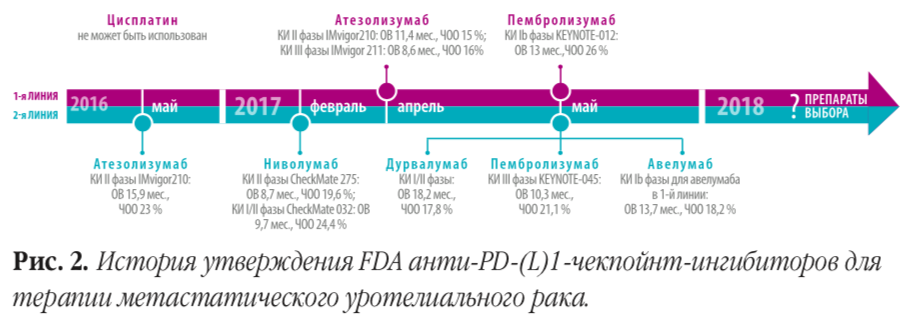
В 2016 году FDA одобрило первый ингибитор иммунных контрольных точек (модуляторов иммунного синапса) атезолизумаб для лечения пациентов с распространенным уротелиальным раком, прогрессирующим на платиносодержащей химиотерапии. В 2017 году список иммунопрепаратов, рекомендованных FDA для применения после химиотерапии, увеличился до пяти — одобрены ниволумаб, пембролизумаб, дурвалумаб и авелумаб. Согласно одобрению FDA и современным американским (NCCN) и европейским (EAU) гайдлайнам, атезолизумаб и пембролизумаб могут применяться и в первой линии, в случае если пациент не может получать цисплатинсодержащую химиотерапию.
Череда одобрений сопровождалась как оптимизмом, так и критикой. Ведь все перечисленные препараты являются абсолютно новой опцией в терапии онкологических заболеваний, и тем более — в лечении метастатического рака мочевого пузыря, для которого последние 30 лет стандарты практически не менялись. Практически все решения FDA были приняты по результатам клинических исследований I и/или II фаз, что и было предметом критики. И пока исключение составляет лишь один препарат — пембролизумаб. Он получил одобрение по результатам клинического исследования III фазы KEYNOTE-045 [1], в котором было показано достоверное увеличение общей выживаемости по сравнению со стандартным лечением. Атезолизумаб также изучался в качестве препарата второй линии в клиническом исследовании
III фазы IMvigor211 [2], в котором, однако, не было продемонстрировано значимого увеличения общей выживаемости по сравнению с химиотерапией.
Разумеется, процедуры ускоренного одобрения по незрелым результатам и данным исследований I/II фаз многими экспертами были расценены как преждевременные. И, действительно, в ряде случаев, «дозревая», данные менялись и продолжают меняться. Например, спустя год после одобрения атезолизумаба компания Roche опубликовала пресс-релиз с обновленной информацией по исследованию IMvigor211: атезолизумаб не увеличивал общую выживаемость по сравнению с химиотерапией [3]. Тем не менее доверие к ингибиторам иммунных контрольных точек не подорвано, и они продолжают менять взгляд на лечение метастатического рака мочевого пузыря.
На настоящий момент понятно, что преимущества от применения иммунотерапии получит не более половины пациентов [4]. Но если пациенту такая терапия подошла, то полученный ответ будет длительным и стойким [5]. Кроме того, у значительной части пациентов рак мочевого пузыря развивается на седьмом-восьмом десятилетии жизни, в связи с чем значимую роль приобретает профиль токсичности: до 50% пациентов не могут получать химиотерапию в силу возраста и сопутствующих заболеваний, но могут быть кандидатами для иммунотерапии [6].
Реактиваторы иммунитета
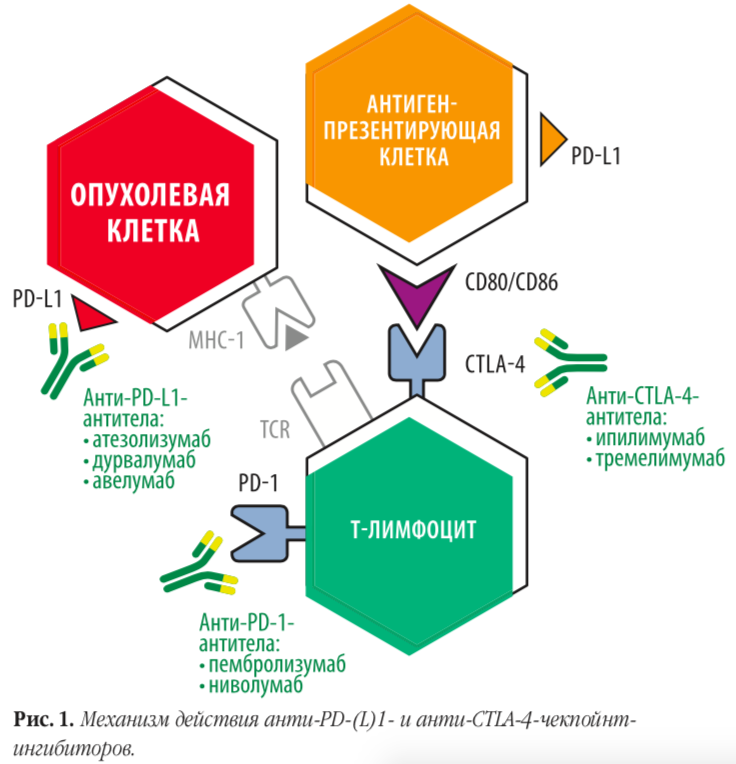
Терапия ингибиторами иммунных контрольных точек — лечение, направленное на восстановление собственного противоопухолевого иммунитета, подавленного злокачественной опухолью. Несмотря на различающиеся механизмы действия, все препараты отмеченной группы «снимают защиту» с опухоли и делают ее «видимой» для иммунитета. Ингибиторы сигнального пути PD-1/PD-L1/PD-L2 блокируют либо рецептор PD-1 на цитотоксических лимфоцитах, либо один из лигандов данного рецептора — PD-L1.
Атезолизумаб, дурвалумаб и авелумаб — это моноклональные антитела к PD-L1 — лиганду рецептора программируемой клеточной смерти 1 (PD-1). Связывание антител с PD-L1 делает невозможным взаимодействие лиганда с рецептором PD-1, что приводит к прекращению PD-L1/PD-1 опосредованного подавления иммунного ответа и вызывает реактивацию противоопухолевого иммунитета. PD-L1 может экспрессироваться на опухолевых клетках и инфильтрирующих опухоль иммунных клетках, участвуя в подавлении противоопухолевого иммунного ответа в микроокружении опухоли.
Ниволумаб и пембролизумаб блокируют сам рецептор PD-1, который имеет два лиганда — PD-L1 и PD-L2. В результате происходит прерывание ингибирующего сигнала через оба лиганда. Ингибиторы PD-L1 не затрагивают взаимодействие рецептора PD-1 с лигандом PD-L2, они блокируют только часть сигнального пути PD-1/PD-L1/PD-L2.
Согласно американским и европейским гайдлайнам, любой из ныне одобренных FDA ингибиторов PD-1/PD-L1 может быть использован во второй линии терапии метастатического рака мочевого пузыря после прогрессирования на платиносодержащей химиотерапии. Поскольку прямых сравнительных исследований этих препаратов не проводилось, возможно лишь отметить разную степень доказательности существующих данных для названных препаратов. Учитывая отмеченные выше ускоренные процедуры одобрения препаратов, в EAU Guidelines 2018 во второй линии терапии более высокую степень рекомендации имеет пембролизумаб (1b) по сравнению с атезолизумабом (2a) или ниволумабом (2a). Согласно гайдлайну NCCN, пембролизумаб является препаратом выбора для 2-й линии терапии, а остальные одобренные ингибиторы PD-1/PD-L1 отнесены к возможным альтернативным вариантам лечения.
Одной из первичных конечных точек в большинстве исследований являлась частота объективных ответов. К сожалению, не все пациенты имели объективный ответ на терапию ингибиторами PD-1/PD-L1. Кроме того, у достаточно большого числа пациентов отмечалось прогрессирование. Возможно, частично прогрессирование было связано с отсроченной реализацией ответа на иммунотерапию, но, безусловно, сыграл свою роль и неправильный отбор пациентов. Поэтому одна из основных задач — поиск предикторов ответа на терапию иммуноонкологическими препаратами.
Уже сейчас понятно, что эффективность терапии ингибиторами PD-1/PD-L1 зависит от подтипа рака мочевого пузыря. Так, в регистрационном исследовании ниволумаба CheckMate 275 пациенты с 1-м подтипом базального уротелиального рака мочевого пузыря и экспрессией PD-L1 > 5% чаще отвечали на терапию ниволумабом [8].
В исследовании атезолизумаба IMvigor210 при базальном варианте уротелиального рака чаще наблюдалась повышенная экспрессия PD-L1 на иммунных и опухолевых клетках по сравнению с люминальным раком, но не коррелировала с ответом на терапию [9]. Достоверно наибольшая частота объективных ответов регистрировалась при 2-м подтипе люминального рака по сравнению с остальными подтипами по TCGA (34%, p=0.0017) [10].
Согласно FDA, а также гайдлайнам NCCN и EAU, атезолизумаб и пембролизумаб рекомендованы для применения в первой линии у пациентов, у которых проведение химиотерапии цисплатином невозможно по разным причинам. Кроме этого, пембролизумаб получил одобрение FDA в еще одном показании — при нерезектабельных или метастатических солидных опухолях с нарушенной системой репарации ДНК (dMMR — mismatch repair deficiency) или высокой микросателлитной нестабильностью (MSI-H — high microsatellite instability), прогрессирующих после предшествующего лечения при отсутствии эффективных альтернативных вариантов лечения [11]. Нарушения в системе репарации ДНК и ассоциированная с ней микросателлитная нестабильность наблюдаются при разных типах опухолей, в том числе и при раке мочевого пузыря, и рассматриваются как маркеры эффективности терапии [12].
В настоящее время в РФ представлены не все препараты: дурвалумаб и авелумаб появились недавно и зарегистрированы пока только в США. В РФ с данным показанием зарегистрированы атезолизумаб, ниволумаб и пембролизумаб.
В первой линии
На сегодняшний день в первой линии терапии распространенного уротелиального рака ингибитор PD-1/PD-L1 может назначаться только в том случае, если имеются противопоказания к применению цисплатина. При отсутствии противопоказаний цисплатинсодержащая химиотерапия остается стандартом первой линии лечения.
Пока нет окончательных результатов рандомизированных исследований, сравнивающих эффективность иммуноонкологических препаратов и платиносодержащей химиотерапии у больных метастатическим раком мочевого пузыря, иммунотерапия не может заменить цисплатин как стандарт лечения в первой линии. Кроме того, предварительные данные исследований Keynote-361 и IMvigor130 показали ухудшение выживаемости больных распространенным раком мочевого пузыря при терапии пембролизумабом или атезолизумабом, соответственно, в первой линии по сравнению с химиотерапией при низком уровне экспрессии PD-L1 [13,14].
И согласно Европейскому агентству по контролю за оборотом лекарственных средств (EMA), пембролизумаб и атезолизумаб показаны в виде монотерапии при местнораспространенном или метастатическом уротелиальном раке у взрослых пациентов, которые получали предшествующую платиносодержащую химиотерапию. EMA отмечает, что оба препарата могут применяться в виде монотерапии при метастатическом уротелиальном раке у взрослых пациентов, которые не подходят для цисплатинсодержащей химиотерапии и чьи опухоли экспрессируют PD-L1≥10% на опухолевых и иммунных клетках (CPS, combined positive score) (для пембролизумаба) и PD-L1≥5% на иммунных клетках (для атезолизумаба) [15]. Необходимость диагностики экспрессии PD-L1 при выборе опции лекарственного лечения 1-й линии при распространенном уротелиальном раке отражена в гайдлайне NCCN.
Возможно, в первую линию терапии войдут ипилимумаб и/или тремелимумаб, которые относятся к анти-CTL4 — антителам. Оба препарата изучаются в клиническом исследовании III фазы DANUBE: дурвалумаб в монорежиме и/или в комбинации с тремелимумабом назначается в качестве терапии первой линии у пациентов, подходящих для получения химиотерапии. Уже в сентябре следующего года ожидаются результаты этого, на данный момент единственного исследования, сравнивающего ингибиторы контрольных точек с химиотерапией в когорте пациентов, подходящих для назначения химиотерапии [16].
Предсказать ответ
Вне зависимости от того, какой ингибитор PD-1/PD-L1 выбран, не более половины пациентов получат преимущества. Поэтому краеугольный камень иммунотерапии — применение маркеров, позволяющих предполагать успешность лечения.
Можно ли считать PD-L1 предиктивным маркером ответа на иммунотерапию? Для применения в 1-й линии терапии — да. Вместе с тем данные исследований ингибиторов PD-1/PD-L1 во 2-й линии по данному вопросу противоречивы. Результаты Keynote-361 и IMvigor130 предварительные и могут быть справедливыми только для той популяции пациентов, которая являлась объектом исследования. Так, в исследовании KEYNOTE-045 было получено преимущество пембролизумаба в общей выживаемости больных уротелиальным раком во всех подгруппах, в том числе при PD-L1<1% по сравнению с химиотерапией, и наблюдалось отсутствие влияния степени экспрессии PD-L1 на частоту объективных ответов. В исследовании IMvigor211, напротив, различий в общей выживаемости больных метастатическим раком мочевого пузыря с экспрессией PD-L1>5% при терапии атезолизумабом или химиотерапией выявлено не было, но ответ на терапию при повышенной экспрессии PD-L1 был почти в 2 раза выше, чем в общей группе (23% против 13,4%) [17].
Причиной противоречий данных могут быть как гетерогенность опухоли, так и различие методов оценки экспрессии. Кроме того, в различных исследованиях используется разное пороговое значение по экспрессии PD-L1, от 1% до 15% и более, что также не позволяет привести данные к общему знаменателю. Тем не менее, согласно FDA, NCCN, EMA, при применении пембролизумаба или атезолизумаба в 1-й линии терапии должна быть проведена оценка экспрессии лиганда.
Путаница, связанная с попытками применить PD-L1 в качестве маркера эффективности терапии, относится не только к раку мочевого пузыря, но и к другим опухолям. В отношении прогнозирования эффективности лечения в литературе отмечается потенциальная возможность оценивать мутационную нагрузку опухоли и внутриопухолевую неоантигенную гетерогенность [18]. Однако мутационная нагрузка — слишком нестандартизуемый показатель, поэтому перспективы ее клинического применения пока неясны.
В настоящее время многие данные пересматриваются в зависимости от молекулярного подтипа опухоли и ее мутационной нагрузки. Кроме того, экспрессия гена гамма-интерферона была изучена в четырех исследованиях с применением атезолизумаба, ниволумаба, дурвалумаба и пембролизумаба, и была показана связь с увеличением частоты объективных ответов выживаемости без прогрессирования и общей выживаемости [19]. Однако эти данные требуют подтверждения в проспективных исследованиях, прежде чем они получат клиническое приложение.

Заключение
Время иммунотерапии при раке мочевого пузыря только начинается. Уже проводится целый ряд исследований по оценке эффективности ингибиторов PD-1/PD-L в комбинации с CTLA-4-ингибиторами и другими иммуноонкологическими препаратами, с препаратами таргетной терапии и классической химиотерапии, а также с лучевой терапией. Кроме того, изучаются препараты, которые индуцируют цитотоксический ответ Т-клеток посредством ингибирования других мишеней, не PD-1 и CTLA-4 [20]. И уже сейчас в исследовании DART изучается возможность использования иммунотерапии при редких опухолях мочевого пузыря [21] и исследуется эффективность иммунотерапии при неметастатическом раке мочевого пузыря в сочетании с БЦЖ-терапией или без нее. Перспективами персонализированного подхода в лечении больных раком мочевого пузыря с учетом того, что не все пациенты отвечают на терапию ингибиторами PD-1/PD-L1, является также активно изучаемое сейчас применение ингибиторов семейства рецепторов фактора роста фибробластов FGFR до или после иммунотерапии.
В ближайшие годы, как мы надеемся, будет получено много новых данных, которые внесут изменения в текущие стандарты лечения распространенного рака мочевого пузыря.

















