Статьи
Терапия донорскими NK-клетками детей с острыми лейкозами группы высокого риска после аллогенной ТГСК
Трансплантация гемопоэтических стволовых клеток (ТГСК) — эффективный метод лечения ряда злокачественных новообразований (ЗНО). Однако рецидивы и посттрансплантационные осложнения, такие как реакция транс плантат против хозяина (РТПХ) и инфекции, остаются серьезными проблемами, снижающими эффективность ТГСК и приводящими к посттрансплантационной летальности.
Дополнительные методы клеточной терапии, в том числе с применением NK-клеток (natural killer cells, натуральные киллеры), экспрессирующих CD56+, представляют собой перспективный подход к усилению противоопухолевого иммунного ответа и улучшению результатов ТГСК у пациентов со ЗНО, в том числе лейкозами. Являясь звеном врожденного иммунитета, NK-клетки в качестве иммунотерапевтического агента обладают такими преимуществами по сравнению с Т-клетками, как независимое от главного комплекса гистосовместимости класса I (MHC I, major histocompatibility complex I) распознавание опухолей и низкий риск токсичности. Однако их применение в клинической практике связано с рядом проблем, в частности с ограниченной персистенцией in vivo и низким абсолютным количеством NK-клеток. Совершенствование методов их применения представляется перспективным направлением дополнительной клеточной терапии пациентов с лейкозами группы высокого риска, в особенности детей, в том числе после аллогенной ТГСК.
ВИДЫ И ФУНКЦИИ
NK-клетки относятся к субпопуляции цитотоксических лимфоцитов, которые в отличие от Т- и В-клеток являются эффекторными клетками не адаптивного, а врожденного иммунитета, способными распознавать и уничтожать злокачественные (рис. 1) и инфицированные клетки без участия главного комплекса гистосовместимости и антител, благодаря чему защитный эффект этих клеток наступает очень быстро. Механизм действия NK-клеток сходен с таковым у цитотоксических Т-лимфоцитов и обусловлен высвобождением перфорина и гранзимов, индуцирующих апоптоз целевых клеток.
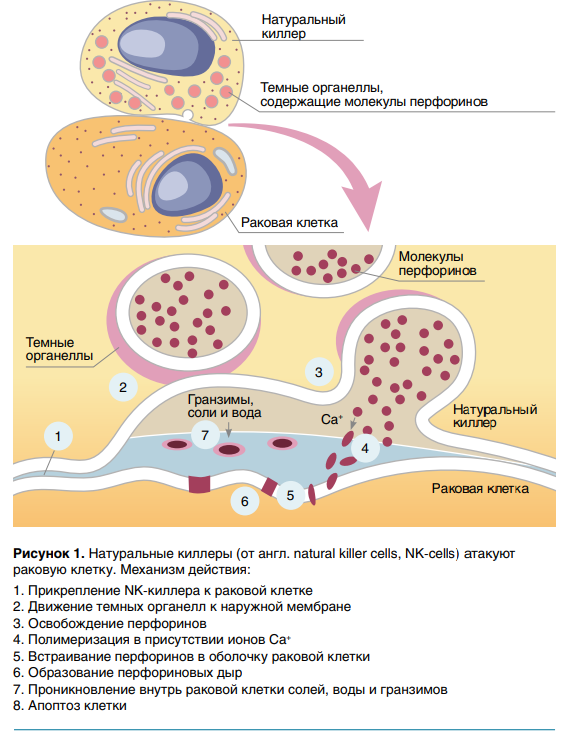
NK-клетки состоят из различных субпопуляций, различающихся по экспрессии клеточных рецепторов, функциям, фенотипу и локализации в тканях. Большинство NK-клеток в периферической крови (> 95 %) относятся к цитотоксической (зрелой) субпопуляции CD56DIMСD16+ . Остальные же (< 5 %) представлены клетками CD56brightСD16- (незрелая или регуляторная субпопуляция), которые локализуются в лимфоидных органах и печени, выделяя большое количество интерферона и фактора некроза опухоли альфа, и при активации размножаются гораздо быстрее, чем NK-клетки CD56DIMCD16+ . Значительное количество NK-клеток находится в лимфоидных органах, они составляют до 5 % мононуклеарных клеток в лимфатических узлах.
NK-клетки лимфатических узлов быстро приобретают цитотоксическую способность и экспрессируют большинство ингибирующих и активирующих рецепторов при стимуляции интерлейкином 2 (IL‑2). Таким образом, активация превращает лимфатические NK-клетки в цитотоксические эффекторные лимфоциты CD56dimCD16+ периферической крови.
Механизмы, с помощью которых NK-клетки отличают здоровые клетки от видоизмененных мишеней, составляют основу их функций. Активация NK-клеток представляет собой сложный процесс интеграции сигналов от набора активирующих и ингибирующих рецепторов, которые определяют, является ли соседняя клетка целью для уничтожения или нет.
NK-клетки буквально чувствуют отсутствие MHC и нападают на эти злокачественные клетки. Кроме того, посредством своих активирующих рецепторов NK-клетки могут уничтожать и специфические MHC-I-адекватные опухолевые клетки, обнаруживая стресс-триггерные самоконтролируемые лиганды. Гипотеза стресс-триггерных самоконтролируемых NK-клеток подразумевает распознавание инфицированных или трансформированных клеток посредством повышения регуляции лигандов для активирующих рецепторов, которые не экспрессируются на нормальных клетках.
ПРОТИВ ОПУХОЛЕЙ
Благодаря мощной цитотоксической активности NK-клеток их использование стало важным направлением в области иммунотерапии опухолей. Она включает в себя инфузию ex vivo активированных NK-клеток для усиления противоопухолевых иммунных реакций. NK-клетки могут быть получены от пациента (аутологичные) или от здорового донора (аллогенные).
Активация эндогенных NK-клеток и стимуляция их пролиферации у пациентов были целями ранних исследований, направленных на повышение противоопухолевой активности собственных NK-клеток.
Введение аутологичных активированных с помощью цитокинов (IL‑2, IL‑12, IL‑15 и IL‑18) NK-клеток применялось при различных ЗНО, включая лимфомы, лейкозы и солидные опухоли. Этот метод имеет преимущество за счет низких рисков РТПХ и иммунного отторжения, однако эндогенные NK-клетки могут не обладать достаточной цитотоксичностью для борьбы с прогрессией опухоли.
Терапия аллогенными NK-клетками имеет преимущество в обеспечении более мощной популяции NK-клеток. Эта стратегия позволяет использовать NK-клетки от здоровых доноров, которые могут обладать повышенной цитотоксичностью и обходить ингибирующие сигналы от опухолевых клеток. Этот подход показал свою эффективность как при онкогематологических заболеваниях, так и при солидных ЗНО, а также подтвердил свою безопасность и техническую осуществимость. Однако такие проблемы, как оптимизация пролиферации NK-клеток, недостаточная цитотоксичность и иммуноопосредованное отторжение из-за несоответствия MHC, еще предстоит решить.
КЛИНИЧЕСКИЙ ПРИМЕР
Представляем пример клеточной терапии с использованием NK-клеток двух пациентов с острым миелоидным лейкозом (ОМЛ) и острым лимфобластным лейкозом (ОЛЛ). Оба пациента в процессе предшествующего протокольного лечения были отнесены к группе высокого риска.
В связи с этим им была выполнена аллогенная ТГСК в качестве единственного радикального метода терапии. В качестве дополнительной клеточной противоопухолевой терапии для профилактики рецидива лейкоза пациентам вводились аллогенные NK-клетки, экспрессирующие CD56.
Основными критериями успешного применения метода были безопасность (отсутствие побочных реакций), увеличение количества донорских NK-клеток, определяемое как > 100 таких клеток в мкл периферической крови у пациента на 14‑й день после инфузии (абсолютное число лимфоцитов/мкл) × (% лимфоцитов, которые являются CD56+/ CD3– NK-клетками) × (% донорского химеризма с использованием стандартного тестирования коротких тандемных повторов), оценка ответа в соответствии с IWG 2006 ALL или IWG AML и корреляционная иммунобиология.
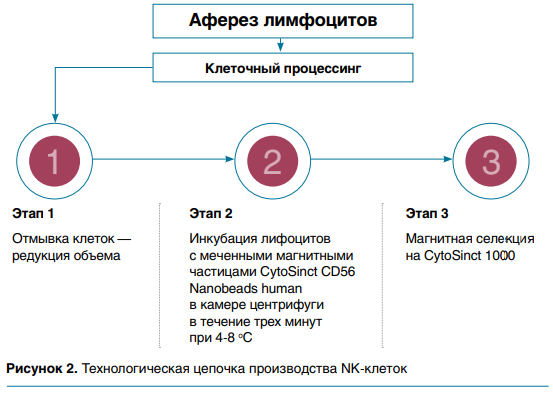
Получение продуктов, обогащенных NK-клетками, проводилось с использованием специальных методик. Немобилизованные донорские мононуклеарные клетки периферической крови были собраны с помощью системы Spectra Optia Apheresis System (Terumo BCT). Далее осуществлялась отмывка, редукция объема и инкубация меченными магнитными частицами NK CD56+ (CytoSinct CD56 Nanobeads, human) в системе Sepax C-Pro Cell Processing System. Продукты афереза были очищены от Т- и В-лимфоцитов с помощью системы отбора клеток и полного набора CytoSinctTM1000 (GenScript), обладающих активирующим действием.
Использовались следующие критерии выпуска: эндотоксинегативные клеточные продукты с содержанием менее 5,00 × 105 донорских Т-клеток на кг массы тела пациента, менее 3 % донорских В-клеток от общего количества ядерных клеток и с жизнеспособностью более 70 % по данным проточного цитометра BD FACSCantoTMII. Максимально допустимая доза клеток составляла 5 х 107 на кг. С учетом начала первой трансфузии в контрольный +30‑й день от аллогенной ТГСК, в качестве стартовой дозы было взято число 1 × 106 клеток/кг.
Оба пациента перенесли трансфузию NK-клеток без осложнений, синдрома высвобождения цитокинов не наблюдалось. На 7‑й и 14‑й дни после трансфузии донорских NK-клеток они были обнаружены в достаточном количестве в крови обоих больных. По результатам контроля основного заболевания в декретированные сроки у обоих пациентов констатирована клинико-гематологическая ремиссия и отсутствие маркеров минимальной остаточной болезни. Осложнений не было.
Таким образом, NK-клетки обладают большим терапевтическим потенциалом и безопасностью, являясь важным компонентом иммунотерапии опухолей. Необходимы дальнейшие исследования и разработки для оптимизации терапии ЗНО на основе NK-клеток.

















