Статьи
Вектор на гибкость
Ретроградная интраренальная хирургия (RIRS, Retrograde IntraRenal Surgery и по-русски РИРХ) — наиболее дорогостоящий среди всех существующих методов оперативного удаления камней почек. Как отмечает Özcan Kılıç с соавторами в обзоре 2017 года, стоимость расходных материалов на одну процедуру может превышать 1000 долларов. И такие расчеты проведены в экспертном центре с большим объемом выполнения данного вида хирургического лечения, что снижает ее стоимость [1].
Тем не менее ретроградная интраренальная хирургия активно развивается, завоевывая сторонников. И если сначала она использовалась при неэффективности дистанционной ударно-волновой литотрипсии, для удаления камней нижней чашечки и камней менее 1,5 см, то в настоящее время ограничений стало значительно меньше. Она уже рекомендована к применению в качестве терапии первой линии при камнях менее 2 см наряду с дистанционной литотрипсией и может быть альтернативой чрескожной нефролитотрипсии при камнях более 2 см [2].
От курьеза к практике
Урология — одна из специальностей, с которой началось активное развитие хирургии через естественные отверстия, выросшая в отдельное хирургическое направление для многих специальностей NOTES (Natural Orifice Transluminal Endoscopic Surgery).
Но если современному цистоскопу в текущем году исполняется уже 140 лет (M. Nitze и J. Leiter создали его прообраз в 1878 году), то уретероскопу не более 40 лет. Именно в 80-е годы прошлого века стали выпускаться ригидные инструменты для уретероскопии и эндоскопических операций на верхних мочевых путях. Ригидная уретероскопия стала рутинной и позволяет решать большую часть задач по эндоскопической ликвидации заболеваний мочеточников. Однако она не обеспечивает доступ ко всем элементам чашечно-лоханочной системы. Поэтому гибкий уретерореноскоп — не блажь, а необходимость.
Интересно, что гибкую уретероскопию урологи выполнили даже раньше, чем ригидную. Так, в 1964 году V. Marshall провел в мочеточник пациента бороскоп и увидел конкремент [3]. Публикация обеспечила первенство в гибкой эндоскопии верхних мочевых путей, однако специальные уретерореноскопы с ирригационным каналом и хорошо управляемым кончиком появились только к концу 1980-х годов, тогда же и началось их клиническое применение. Можно оспаривать, что гибкая уретероскопия была выполнена раньше, чем ригидная. Ведь H. Young еще в 1912 году провел эндоскоп (цистоскоп) из мочевого пузыря в мочеточник и увидел чашечно-лоханочную систему у младенца с инфравезикальной обструкцией и тяжелым уретерогидронефрозом. Но это был курьез и случайно выполненное исследование, информация о котором была опубликована спустя 17 лет, когда автор стал авторитетным специалистом. С исторической точки зрения курьез интересен, но к обычной/современной уретероскопии не имеет отношения.
Совершенствование гибких эндоскопов происходило довольно быстро, и в первую очередь развитие шло в сторону уменьшения диаметра инструмента и увеличения угла изгиба его кончика. В 1994 году были доложены результаты применения инструмента диаметром 7,5 Fr и рабочим каналом 3,6 Fr [4]. В 2001-м был создан эндоскоп, способный изгибаться в обе стороны на 2700 [5]. Настоящим прорывом стало создание цифрового гибкого уретероскопа в 2006 году [6]. Качество изображения многократно превзошло таковое у классических фиброволоконных инструментов, и появилась надежда, что гибкие эндоскопы станут более «живучими». К сожалению, на практике оказалось, что цифровые уретерореноскопы оказались не намного прочнее фиброскопов и по сей день одной из серьезных проблем остается уязвимость гибкого уретероскопа и небольшой срок его службы [7].
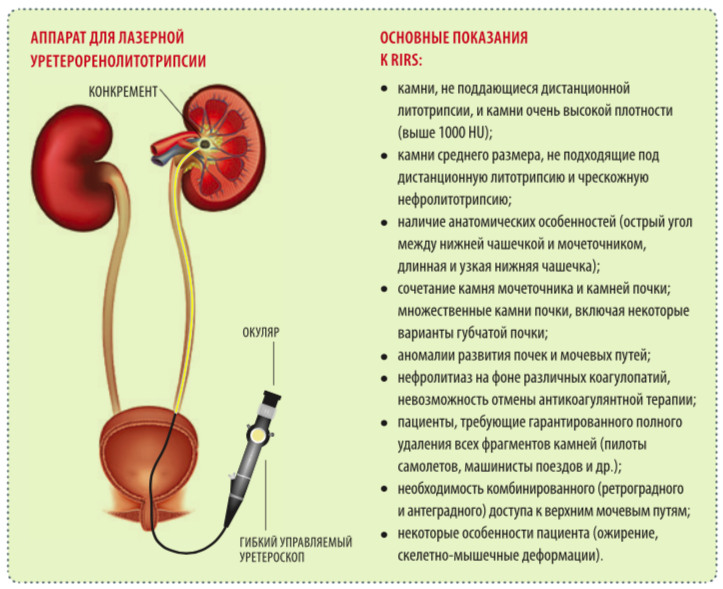
RIRS
Ретроградная интраренальная хирургия — максимально безопасный и эффективный метод оперативного удаления почечных камней. И если сначала она использовалась при неэффективности дистанционной ударно-волновой литотрипсии, камнях нижней чашечки и камнях менее 1,5 см, то теперь рекомендована в качестве терапии первой линии при камнях менее 2 см наряду с дистанционной литотрипсией и может быть альтернативой чрескожной нефролитотрипсии при камнях более 2 см.
Основным противопоказанием является активный инфекционно- воспалительный процесс в мочевых путях, а также любые причины, не позволяющие проводить общую анестезию. Иных специфических противопоказаний к этому виду хирургического лечения не существует [8].
Это действительно наименее инвазивная методика из всех возможных на сегодняшний день эндоурологических процедур. Главными из возможных осложнений являются инфекционно-воспалительные — по данным разных авторов, встречаются в 4–25% наблюдений. Даже отрицательные результаты бактериологического исследования мочи и нормальный ее общий анализ не гарантируют, что в послеоперационном периоде не разовьется инфекционное осложнение. Поэтому всем пациентам с неизмененными анализами проводится периоперационная антибактериальная профилактика, продолжающаяся как минимум еще сутки после операции [10]. В качестве препаратов выбора в настоящее время следует рассматривать цефалоспорины или фторхинолоны [11]. При лабораторных признаках воспалительного процесса в мочевых путях операция проводится только после курса антибактериальной терапии в соответствии с данными бактериологического исследования мочи и антибиотикограммой [12].
RIRS: детали
Предстентирование мочеточника. Дискутабельным остается необходимость предстентирования мочеточника перед выполнением вмешательства. С одной стороны, стентирование является фактором надежной пассивной дилатации всех отделов мочеточника [13], и все ретроградные эндоскопические операции на верхних мочевых путях после предстентирования проходят быстрее, легче и с меньшим количеством осложнений. В то же время стентирование верхних мочевых путей нередко сопровождается такими жалобами, как дизурия, боль, пузырно-мочеточниковый рефлюкс по стенту, которые могут существенно ухудшить состояние пациентов [14].
В соответствии с рекомендациями EAU рутинное стентирование перед уретерореноскопией не показано, но у предстентированных пациентов выше частота полного избавления от камней и ниже уровень интраоперационных осложнений. К такому выводу пришли ученые на основании довольно масштабных исследований, наибольшее из которых было организовано отделением клинических исследований Международного эндоурологического общества (CROES) [15].
Анестезия. Наиболее приемлемой является эндотрахеальная общая анестезия. Только этот метод позволяет полностью обездвижить пациента и управлять его дыхательными движениями, что необходимо, так как дыхательная экскурсия почки может осложнять прецизионную работу при лазерной литотрипсии. Эндотрахеальный наркоз позволяет в таких ситуациях пользоваться управляемым апноэ, что делает работу хирурга быстрее и безопаснее [16]. Интересным представляется применение высокочастотной вентиляции легких для проведения эндоурологических операций, которое предложено коллегами из Санкт-Петербурга [15]. Эта техника анестезии обеспечивает неподвижность почек и не сопровождается проблемами, которые могут иметь место при управляемом апноэ, но требует специфической анестезиологической аппаратуры.
Мочеточниковый кожух. Вмешательство может быть проведено с применением мочеточникового кожуха и без него. Любая операция начинается с проведения в мочеточник струны-проводника при помощи цистоскопа или ригидного уретерореноскопа, что менее травматично для уретры. В мочеточник может быть дополнительно установлена страховочная струна. Целесообразно выполнять ригидную уретероскопию, проводя инструмент до чашечно- лоханочной системы, для оценки состояния мочеточника, исключения его патологических изменений (стриктуры, камни и др.). Это также способствует механической дилатации мочеточника, облегчающей последующие манипуляции. Также предварительная ригидная уретероскопия обеспечивает точную установку рабочей струны в просвет мочевых путей, что исключает возможность перфорации при последующем проведении под рентгеновским контролем мочеточникового кожуха.
Кожух устанавливается в верхнюю треть мочеточника, но не в лоханку. Это в первую очередь обеспечивает сохранность проксимального конца гибкого уретероскопа, оплетка которого при движении согнутого инструмента на себя может быть повреждена о край кожуха в случае его нахождения в лоханке.
Применение мочеточникового кожуха дает свободное, многократное, быстрое и безопасное проведение в верхние мочевые пути гибкого уретероскопа. Также кожух обеспечивает беспрепятственный отток ирригационного раствора из чашечно-лоханочной системы при адекватном соотношении диаметра эндоскопа и внутреннего просвета кожуха, что служит профилактикой пиеловенозных рефлюксов и уменьшает вероятность инфекционно- воспалительных осложнений. Благодаря возможности достаточной ирригации он улучшает эндоскопическую видимость. Важно отметить, что вероятность стриктуры мочеточника после ретроградной интраренальной хирургии с использованием мочеточникового кожуха не велика — 1,4% [16].
Если мочеточниковый кожух не используется, то уретеропиелоскоп проводится в верхние мочевые пути по предварительно установленной туда струне под рентгеновским контролем. При прохождении устья мочеточника следует помнить, что рабочий канал эндоскопа, в котором находится струна, децентрирован и инструмент следует развернуть на 1800 (как и при ригидной уретероскопии). При такой технике проведения гибкого эндоскопа важным вопросом является качество рабочей струны. Для указанных целей лучше пользоваться современными моделями струн с гидрофильным покрытием и гибкими, атравматичными обеими концами. Это помогает уберечь нежное покрытие рабочего канала эндоскопа от повреждений, которые не редки при использовании классических струн с одним жестким концом, на который и «надевается» эндоскоп. Диаметр струны желателен 0,035– 0,038 дюйма, длина — не менее 120 см.
Релокация камней. Доказано, что релокация камней из нижней чашечки в более удобное положение повышает частоту полного избавления от камней по сравнению с литотрипсией на месте [17]. Введение по каналу эндоскопа контрастного вещества помогает точно ориентироваться при совмещении эндоскопической и рентгенологической картины. При обнаружении конкре- ментов принимается решение о необходимости их релокации для последующей лазерной литотрипсии. Это целесообразно делать, если камни расположены в нижней чашечке. Релокация камней имеет две цели: создание удобных условий для разрушения камня и предотвращение поломки эндоскопа.
Следует помнить, что существенное сгибание эндоскопа с лазерным волокном может привести к микродефектам и поломке. Прорывающаяся при этом сквозь оплетку волокна лазерная энергия неминуемо повреждает рабочий канал эндоскопа, что полностью выводит его из строя. Поэтому чем менее согнут эндоскоп во время лазерной литотрипсии, тем ниже вероятность его повреждения.
Избавление от камней
Релокацию камней, а также их извлечение осуществляют при помощи корзинчатых литоэкстракторов. Принимая во внимание, что рабочий канал гибкого уретероскопа обычно 3,6 Fr, самыми подходящими считаются нитиноловые экстракторы диаметром менее 2 Fr. Они минимально ограничивают сгибание эндоскопа и ирригацию [18]. Вероятность повреждения рабочего канала эндоскопа такими корзинками практически равна нулю. Корзинки должны быть округлыми, атравматичными («О» — тип, tipless). Ирригация должна обеспечивать адекватную видимость при минимальных рисках пиеловенозного рефлюкса, который считается основной причиной развития инфекционно-воспалительных осложнений. Считается, что безопасное давление ирригационного раствора в чашечно-лоханочной системе не должно превышать 40 см водного столба. Оптимальный ирригационный раствор — физиологический. Ирригация по каналу гибкого уретерореноскопа снижается всегда при проведении дополнительного инструмента (лазерное волокно, корзинка). На сегодняшний день есть только одна модель уретерореноскопа с двумя рабочими каналами (Wolf Cobra), один из которых ирригационный, обеспечивающий бесперебойный поток ирригационного раствора.
В гибкой эндоскопии верхних мочевых путей для разрушения камней может применяться только два вида литотрипторов: лазерные и электрогидравлические. Последние травматичнее как для тканей, так и для эндоскопа. Гольмиевый лазер является на сегодняшний день золотым стандартом литотрипсии при ретроградной интраренальной хирургии. Его энергии всегда достаточно для разрушения мочевых камней любого состава [18]. При этом мощность лазера может быть и невысокой — 20 Вт вполне достаточно. Однако, как правило, более мощные аппараты дают больше возможностей в выборе различных режимов литотрипсии. Современные гольмиевые лазеры позволяют получать различные эффекты литотрипсии, варьируя установками энергии и частоты, а иногда и формами импульса. При малой энергии (0,3–0,5 Дж) и высокой частоте (15–20 Гц) мы получаем эффект разрушения камня в «пыль». При высокой энергии (1–2 Дж) и низкой частоте (4–5 Гц) получаем фрагментацию камня. Если лазерный аппарат позволяет регулировать длину импульса лазерного излучения, то длинный импульс будет способствовать эффекту «пыль», а короткий — фрагментации.
Нужно ли удалять камни или достаточно разрушить их на мельчайшие фрагменты, которые самостоятельно отойдут в послеоперационном периоде? По этому поводу существовали разные мнения, но уже доказано, что фрагменты можно не удалять [19]. Важно достичь хорошей фрагментации. Для оценки размера фрагментов камней их нужно сравнивать с диаметром лазерного волокна, которым осуществляется литотрипсия. Для ретроградной интраренальной хирургии подходят волокна диаметром 200–400 микрон, но наилучшая ирригация и гибкость эндоскопа достигается при применении волокон до 270 микрон. Нужно помнить, что заявляемый производителем диаметр волокна касается его оптической части без учета пластиковой оплетки. Истинный диаметр волокна в оплетке, как правило, вдвое больше заявленной цифры.
При этом уменьшение заявляемого диаметра световода, то есть диаметра оптической части, как правило, ведет к ограничению мощности использования лазера с данным типом светового волокна. Однако современные производители стремятся к уменьшению толщины оплетки без уменьшения диаметра оптического волокна и выпускают специальные световоды с тонкой оплеткой.
Следует помнить, что лазерное волокно опасно для эндоскопа как в рабочем состоянии, так и вне активности лазерного излучения. Волокно следует проводить по рабочему каналу только выпрямленного эндоскопа и никогда не активировать лазер, если проксимальный конец волокна не виден на эндоскопическом мониторе.
Оптическая система гибких эндоскопов не имеет угла наклона, т.е. 00. Значит, если волокно видно на мониторе, лазерная энергия безопасна для инструмента. Наиболее комфортным для работы является длина волокна, которое мы видим на эндоскопической картине, в 1/4 диаметра камня.
Ретроградную интраренальную хирургию целесообразно завершать стентированием верхних мочевых путей. Это препятствует обструктивным послеоперационным осложнениям, способствует отхождению фрагментов разрушенных камней. Вместе с тем проведен ряд исследований, демонстрирующих отсутствие абсолютной необходимости в рутинном стентировании [20, 21]. Явных преимуществ, в том числе и в отношении профилактики появления стриктур, от стентирования нет. Однако отмечается, что послеоперационная боль чаще имела место у пациентов без стента, а необходимость в экстренном стентировании после операции была в 11,9% наблюдений. Необходимым стентирование является при повреждении мочеточника любой степени, перфорации, геморрагии, инфекции мочевых путей, беременности и при единственной почке. Точных указаний по оптимальным срокам стентирования нет. Большинство урологов определяют этот срок в 1–2 недели.
Есть исследование, доказывающее, что вероятность лихорадки и боли в поясничной области возрастает после 15 дней стентирования [22].
Заключение
Благодаря совершенствованию инструментария и появлению все большего опыта ретроградной интраренальной хирургии увеличивается эффективность и безопасность данного вида вмешательства. Основными осложнениями остаются инфекции мочевых путей и сепсис, кровотечение, формирование внутрипочечной гематомы, повреждение слизистой мочеточника, его перфорация и отрыв. В наиболее масштабном проспективном исследовании CROES, посвященном уретерореноскопии, среди 11 885 пациентов только 15% выполнялась гибкая ретроградная интраренальная хирургия [23]. Общая частота послеоперационных осложнений составила 3,5%, в основном 1-й и 2-й степени по классификации Clavien-Dindo. Только 0,2% пациентов нуждались в переливании крови. Было доложено о 5 смертельных исходах по причине сепсиса, тромбоэмболии легочной артерии, полиорганной недостаточности и сердечных приступов.
Ретроградная интраренальная хирургия — хорошо зарекомендовавшая себя процедура с постоянно совершенствующейся техникой. Ее малая инвазивность и хорошие результаты обеспечивают высокую популярность во всем мире. Однако в РФ учреждения, в которых систематически проводится ретроградное интраренальное удаление камней, можно пересчитать по пальцам. Основная причина — высокая стоимость операции и отсутствие надлежащего финансирования этого направления. Поэтому на вопрос «Станет ли эндоурология гибче?» есть только один ответ «Да, когда данный вид помощи окажется в списке высокотехнологичной медицинской помощи и на выполнение этих операций будут выделяться адекватные финансовые квоты». Подошло время, когда урологическая общественность должна активно выступить в поддержку этого метода.
В завершение не могу не отметить, что текущий год для отечественной урологии ознаменовался появлением на рынке одноразовых уретерореноскопов и системы для микроперкутанной нефролитотрипсии. Думаю, совсем скоро мы сможем увидеть изменяющиеся тренды в эндоурологии.
Список литературы находится в редакции

















