Статьи
Выбор адъювантной терапии гормоночувствительного рака молочной железы
Предлагаем вниманию читателей обзор доклада профессора Сергея Алексеевича Тюляндина, содержащий основные положения его выступления на VIII конференции имени М.Л. Гершановича «Как мы будем лечить завтра?», которая состоялась в рамках VIII онкологического форума «Белые ночи – 2022».
ПРОБЛЕМА ПЕРСОНАЛИЗАЦИИ
Популяция больных с гормоночувствительным раком молочной железы (РМЖ) потенциально восприимчива как к гормоно-, так и к химиотерапии (ГТ и ХТ). Чтобы понять, какую адъювантную терапию назначать таким женщинам, мы ориентируемся на клинические характеристики пациентки и морфологические характеристики опухоли. В частности, проверяем, не относится ли женщина к группе неблагоприятного прогноза, где добавление адъювантной ХТ к адъювантной ГТ (АХТ и АГТ) может заметно улучить результат.
К сожалению, в нашей рутинной практике многое так и остается невидимым. Прогноз и течение заболевания зависят от биологических свойств опухоли, о которых стандартные обследования и тесты, используемые в клинике, дают недостаточное представление. Поэтому у больных с хорошим, казалось бы, прогнозом опухоль может иметь неблагоприятные биологические свойства и прогрессировать после оперативного лечения. В то же время существует большая когорта пациенток с опухолями, обладающими клиническими и морфологическими признаками плохого прогноза, но при этом новообразование имеет неагрессивное течение и может быть успешно пролечено с помощью одной лишь АГТ.
Обратимся к факторам риска прогрессирования опухоли у женщин с гормоночувствительным РМЖ:
-
третья стадия РМЖ;
-
неопределенный гистологический тип опухоли;
-
определение по классификатору ТНМ: Т 3/4, N2/N3;
-
Ki-67 >30 %;
-
уровень экспрессии эстрогеновых и прогестероновых рецепторов — ER <10 % и/или PgR <20 %;
-
оценка ложа остаточной опухоли (residual cancer burden, RCB) — III;
-
геномные сигнатуры, в том числе Oncotype DX, — группа высокого риска.
Биологические свойства опухоли точнее всего оценивает геномная сигнатура. Одна из задач такого анализа состоит в персонализации адъювантной терапии для пациенток с операбельным HR+/HER2- РМЖ. Наиболее популярная сегодня геномная сигнатура Oncotype DX позволяет проанализировать экспрессию 21 гена, в основном отвечающего за пролиферацию опухолевых клеток. По результатам этого теста рассчитывается риск развития рецидива РМЖ:
-
0 — низкий риск;
-
от 11 до 25 — промежуточный риск;
-
>26 — высокий риск.
Данный показатель имеет прогностическое значение, подтвержденное рядом исследований.
Вопрос в том, насколько уверенно можно назначать тот или иной вид адъювантной терапии на основании этого теста? Ответом на него стало крупное многоцентровое исследование TAILORx (2018). В нем участвовали свыше 10 тыс. пациенток с HR+/HER2- РМЖ стадий Т1–Т2, N0. Всем участницам исследования определяли риск прогрессирования по Oncotype DX. По его результатам пациенток разделили на 4 группы. Больные с низким риском (1629 женщин) получали адъювантную эндокринную терапию (ЭТ), а с высоким — АХТ вместе с АГТ (1389). Пациенткам с промежуточным риском назначалась либо только АГТ (3399), либо АГТ вместе с АХТ (3312 больных).
Оказалось, что в группе промежуточного риска добавление химиотерапии не приводит к улучшению результатов. В течение 9 лет в обеих подгруппах данной группы наблюдались примерно одинаковые уровни выживаемости без прогрессирования (ВБП): 83 % — в подгруппе АГТи 84 % — в подгруппе АХТ + АГТ. Показатели выживаемости без локального рецидива (92 % против 93 %) и без отдаленных метастазов (94 % против 95 %) также не различались. Таким образом, у женщин с промежуточным риском, определенным при помощи теста Oncotype DX, добавление химиотерапии не приводило к улучшению результатов лечения, а значит, им достаточно проводить только адъювантную эндокринотерапию.
К сожалению, у больных с наивысшим риском развития рецидива, несмотря на то что все они получали дополнительно к эндокринотерапии адъювантную химиотерапию, показатель общей выживаемости (ОВ) все равно оказался значительно хуже, чем в трех остальных группах, внутри которых существенных различий ОВ не было. Авторы исследования пришли к выводу, что для большинства женщин с HR+/HER2- операбельным РМЖ одной только гормонотерапии достаточно, чтобы контролировать болезнь. Добавлять же АХТ нужно только больным с высоким риском рецидивирования.
Однако при дополнительном анализе все же удалось выделить когорту больных с промежуточным риском рецидива, которым АХТ, видимо, все-таки нужна. Это женщины моложе 50 лет с риском развития рецидива по результатам теста Oncotype DX от 16 до 25 единиц. Хотя они еще находятся в группе промежуточного риска, но уже очень близки к риску высокому. И вот для таких женщин в пременопаузе исследование TAILORx показало существенный выигрыш от добавления химиотерапии к АГТ. На фоне комплексного лечения показатель 9-летней ВБП повысился на 6,5 % по сравнению с аналогичными по возрасту больными с тем же уровнем риска рецидивирования, получавшими только АГТ. Это значит, что таким пациенткам показано добавление химиотерапии к эндокринотерапии.
ЭФФЕКТ ПЕРЕЛЕЧИВАНИЯ
В исследование TAILORx включали женщин без метастазов (N0) в подмышечные лимфоузлы. Для них тест Oncotype DX оказался надежным прогностическим критерием при выборе адъювантной терапии. Но можно ли столь же эффективно использовать этот тест для назначения адъювантной терапии женщинам с метастатическим поражением лимфатических узлов (N1)? Этот вопрос прояснился в результате другого исследования — RxPonder. В нем участвовали 5015 женщин с операбельным HR+/HER2- РМЖ стадий Т1–Т2, N1 и с низким и промежуточным рисками рецидивирования по Oncotype DX (от 0 до 25). Согласно рандомизации химиотерапию с последующей эндокринотерапией получали 2509 пациенток, а 2506 — только АГТ. Безрецидивная ОВ считалась первичной конечной точкой этого исследования, а вторичной — ОВ, как в исследовании ТAILORx.
И, как и в исследовании ТAILORx, несмотря на наличие поражения лимфатических узлов, у женщин в постменопаузе никакого выигрыша от добавления химиотерапии к гормонотерапии не обнаружилось. А значит, они в такой комбинации не нуждаются. Зато у больных в пременопаузе в результате добавления ХТ к ЭТ относительный риск прогрессирования снизился на 46 %.
Если же говорить об общей 5-летней выживаемости, то для больных в постменопаузе она не изменилась после добавления химиотерапии, а для женщин в пременопаузе выросла, но лишь на 1,3 %.
На основании этих двух исследований был сформулирован совет онкологам (уже вошедший в клинические рекомендации NCCN 2022, а скоро он появится и в рекомендациях по раннему РМЖ ESMO 2022), как выбрать различные варианты адъювантной терапии для больных с ЕR+/HER2- РМЖ стадий Т1–Т2, N0–1 в зависимости от различных показателей риска рецидивирования по тесту Oncotype DX (рис. 1).
Женщинам в постменопаузе c указанной разновидностью РМЖ независимо от N1 или N0 при низком (0–10) или промежуточном (11–25) риске рецидивирования назначают АГТ, а при высоком риске (>26) к ней добавляют АХТ. Женщинам в пременопаузе при риске от 0 до 15 и N1 необходимы гормонотерапия и овариальная супрессия, а при риске от 16 до 26 — ГТ, овариальная супрессия (ОС) и ХТ (рис. 1). У пациенток в пременопаузе без метастазов (N0) и при низком риске развития рецидива от 0 до 20 нужно применять ГТ. При риске от 21 до 25 — ГТ и овариальную супрессию, а при риске свыше 26 — адъювантную ГТ, овариальную супрессию и ЭТ. При высоком клиническом риске только гормонотерапию назначают больным при вероятности рецидивирования от 0 до 15, а при риске от 16 до 20 — гормонотерапию и овариальную супрессию. При риске же рецидивирования свыше 21 к эндокринотерапии добавляют химиопрепараты.
В результате все более широкого следования онкологов данным рекомендациям в развитых странах назначение АХТ больным с Т1–2, N0–1 РМЖ сократилось как минимум в 2 раза. Это большой экономический выигрыш! И еще больший выигрыш для женщин, которые теперь избавлены от непосредственной токсичности ХТ и ее отдаленных последствий (миелодисплазия, прогрессирование кардиологических заболеваний, серьезные психологические и сексуальные проблемы).
Чарльз Шапиро (Charles L. Shapiro), профессор Института онкологии (Нью-Йорк, США), известный специалист по РМЖ, в комментарии порталу Medscape Medical News отметил, что результаты исследований TAILORx и RxPonder способны совершить революционный переворот в существующей клинической практике. Около половины всех случаев РМЖ вполне соответствуют популяции исследования: это пациентки с гормонозависимым HER2-негативным раком N0. У трети таких больных РМЖ неизбежно прогрессирует в течение 10 лет после лечения. АХТ призвана сократить риск рецидивирования, но, по словам профессора Ч. Шапиро, абсолютный выигрыш составляет всего 3–5 %. «Это означает, что многих женщин мы перелечиваем. Гормональной терапии в их случае будет достаточно», — поясняет он.
А НАМ-ТО ЧТО ДЕЛАТЬ?
Поставив такой вопрос, С.А. Тюляндин пояснил, что в России недоступен не только тест Oncotype DX, но и другие, используемые для определения риска развития рецидива (MammaPrint®, EndoPredict® и РАМ50®). И нет никакой надежды, что ситуация изменится в ближайшем будущем. А значит, российские онкологи не могут применять описанный выше инновационный способ выбора адъювантной терапии. Тогда как же им определить популяцию больных, которым показана только АГТ?
Ответом на этот вопрос стало исследование POETIC, предпринятое британскими учеными в 2020 году. С помощью теста Ki-67 по показателю безрецидивной выживаемости оценивалось влияние на динамику пролиферативной активности опухоли короткого (2–3 недели) предоперационного курса с использованием ингибиторов ароматазы у 2363 женщин старше 50 лет в постменопаузе с наличием рецепторов стероидных гормонов и ЕR+/HER2- РМЖ. Эта работа показала, что использование теста Ki-67 после гормональной биологической пробы позволяет заметно надежнее оценить прогноз пациентки по сравнению с результатами первичной биопсии. Определяя величину Ki67 дважды: в биоптате при постановке диагноза и в операционном материале после короткого курса гормонотерапии, — исследователи разделили больных на три группы риска:
-
низкий-низкий (величина Ki67 в биопсийном и послеоперационном материале <10 %),
-
высокий-низкий (Ki67 был >10 % в биопсийном материале и стал <10 % в послеоперационном анализе),
-
высокий-высокий (значение Ki67 не опускалось ниже 10 %).
При сроке наблюдения более 5 лет риск рецидива в этих группах составил 4,3 %, 8,4 % и 21,5 % соответственно. Об этом свидетельствуют кривые безрецидивной выживаемости (рис. 2).
Итак, исследование POETIC определило популяцию женщин в постменопаузе с низкими значениями Ki67 в послеоперационном материале (низкий-низкий, высокий-низкий), которые имеют и низкий шанс прогрессирования при проведении АГТ. Примечательно, что у 73 % больных с изначально высоким Ki67 было зарегистрировано снижение, то есть фактически нормализация этого показателя <10 % после курса гормонотерапии (группа «высокий-низкий»).
В то же время пациентки с высоким Ki-67 после курса ГТ (примерно 20 % участниц исследования) имеют высокую вероятность прогрессирования и нуждаются в комбинированной адъювантной терапии (гормоно- и химиотерапия, а при необходимости и таргетные средства). Такая группа неблагоприятного прогноза составляла те же 20–25 %, что и по результатам теста Oncotype DX. Итак, в отсутствие генетических тестов короткий предоперационный курс гормонотерапии вместе с определением в динамике маркера Ki67 может стать ориентиром в выборе адъювантной терапии у пациенток в постменопаузе, значительно сократив назначение токсичной АХТ.
КАЛЬКУЛЯТОР В ПОМОЩЬ
Но как же быть с больными в пременопаузе с операбельным ЕR+/HER2- РМЖ? Результаты исследований TEST и SOFT, проведенных с 2003 по 2011 год при участии 2672 и 3066 пациенток соответственно, позволяют выбрать оптимальные варианты адъювантной терапии именно для них. Цель обеих работ состояла в том, чтобы по показателям выживаемости без отдаленных метастазов (ВБМ) и ОВ сравнить эффективность разных вариантов АГТ для женщин пременопаузального возраста. Лечение здесь проводилось с использованием овариальной супрессии и добавления к ней либо эксеместана, стероидного ингибитора ароматазы III поколения, либо (для другой группы пациенток) тамоксифена, нестероидного антиэстрогенного препарата, блокатора рецепторов эстрогенов.
Добавление тамоксифена к овариальной супрессии достоверно увеличило ВБМ и ОВ. Замена тамоксифена на эксеместан в комбинации с овариальной супрессией дополнительно снижала частоту рецидивов, включая отдаленные. Но достоверных различий в ОВ при замене тамоксифена на эксеместан не наблюдалось. Исследователи пришли к выводу, что эффективность овариальной супрессии, применяемой в формате адъювантной терапии, может быть повышена при добавлении гормонотерапии. Причем эксеместан имеет определенные, хотя и непринципиальные, преимущества перед тамоксифеном.
Однако у работ TEST и SOFT был и другой результат, оказавшийся еще более важным в перспективе 11 лет, прошедших с момента окончания этих исследований. Их участниц разделили на группы в зависимости от исходного риска отдаленного рецидива. При оценке такого риска учитывали:
-
возраст (с интервалом в 5 лет);
-
число пораженных регионарных лимфоузлов (0, 1–3, 4 или больше);
-
размер первичной опухоли (≤2 см, >2 см);
-
экспрессию рецепторов эстрогенов (<50 %, ≥50 %);
-
экспрессию рецепторов прогестерона (<20 %, 20–49 %, ≥50 %);
-
степень анаплазии (G1, G2, G3);
-
экспрессию Ki-67 (<14 %, 14–19 %, 20–25 %, ≥26 %).
Исходя из значений отдельных рисков, определенных для каждого из указанных параметров (согласно модели пропорциональных рисков Кокса), с помощью созданного авторами исследований калькулятора рассчитывали индивидуальный композитный индекс риска прогрессирования (CRI), или, проще говоря, композитный риск (КР). Такой подсчет проводился для каждой пациентки.
По итогам анализа авторы пришли к заключению, что степень различий между изученными режимами гормонотерапии в значительной степени зависела от показателя КР. У больных с высоким риском применение эксеместана на фоне овариальной супрессии (по сравнению с тамоксифеном вместе с ОС) увеличивало 8-летнюю выживаемость без отдаленных рецидивов на 10–15%. У пациенток промежуточного риска такое различие в пользу эксеместана и ОС составило лишь 4–5 %. У женщин с низким риском рецидива различий практически не было. Причем 8-летняя выживаемость без отдаленных рецидивов превысила 97 % для всех участниц, независимо от приема эксеместана или тамоксифена.
Калькулятор, использовавшийся в исследованиях TEST и SOFT, сейчас размещен на интернет-портале Российского общества клинической онкологии rosoncoweb.ru. Там же находится и инструкция по его использованию для определения композитного риска прогрессирования опухоли у пациенток в пременопаузе с операбельным ЕR+/HER2-РМЖ. Определив такой риск, можно выбрать адъювантную терапию с максимальной объективностью (рис. 3).
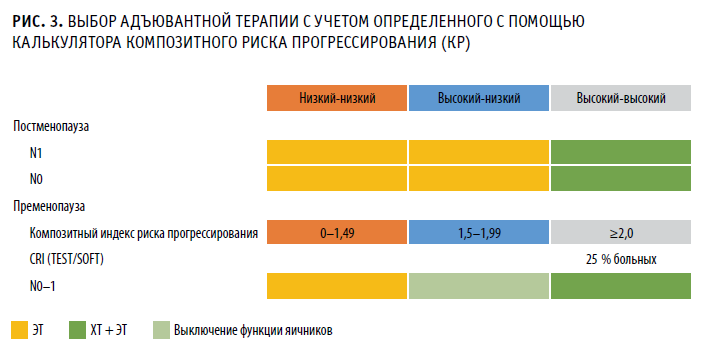
Если калькулятор показал значение КР от 0 до 1,49, то риск прогрессирования низкий и нужна лишь адъювантная гормонотерапия. При промежуточном риске (от 1,5 до 1,99) показано выключение функции яичников в дополнение к гормональному препарату. Превышение КР уровня 2,0 указывает на высокий риск и требует комбинированной АХТ и АГТ, но без овариальной супрессии.
Исследования TAILORx, RxPONDER, POETIC, TEST/SOFT позволили стратифицировать больных с ЕR+/HER2- РМЖ стадий Т1–2, N0–1 в зависимости от риска прогрессирования и выбрать для каждой группы риска оптимальную адъювантную терапию из всех имеющихся вариантов (гормонотерапия, гормонотерапия и овариальная супрессия, химиотерапия и эндокринотерапия).
В отечественной клинической практике, где недоступен геномный тест Oncotype DX, стоит использовать суррогатные модели (калькуляторы), разработанные при проведении исследований POETIC и TEST/SOFT. С помощью подобных калькуляторов онколог сможет дополнить стандартно оцениваемые факторы прогноза и сумеет максимально объективно назначить рациональную АТ каждой пациентке. А это неминуемо сократит, причем без потери в эффективности лечения, применение химиопрепаратов.
Александр Рылов, к.м.н

















