Статьи
Радий-223 — таргетная терапия на костные метастазы
У большинства больных метастатическим кастрационно-резистентным раком предстательной железы (мКРРПЖ) выявляются костные метастазы, которые более чем в 50 % случаев сопровождаются различными скелетными осложнениями, приводящими к значимому ухудшению качества жизни или летальному исходу. Традиционно используемые методики, такие как дистанционная лучевая терапия, применение радионуклидов стронция-89 и самария-153, бисфосфонатов, носят лишь паллиативный характер, направленный на снижение риска развития костных осложнений. С момента одобрения радия-223 для клинического применения у больных мКРРПЖ в 2013 году суммарно более 50 тысяч пациентов по всему миру получили терапию, из них почти 12 тысяч — в 23 странах Европы. О том, чего позволило добиться внедрение в практику радия-223 и насколько безопасно такое лечение, — в материале «Онкологии Сегодня» с комментариями ведущего эксперта.
УВЕЛИЧИВАЕТ ВЫЖИВАЕМОСТЬ
Идеальной схемой лечения при метастатическом опухолевом процессе считается та терапия, которая позволяет не только снизить клинические проявления болезни, но и увеличить продолжительность жизни. Опубликованные в 2013 году в журнале NEJM данные исследования ALSYMPCA показали, что терапия радием-223 достоверно увеличивает медиану общей выживаемости (ОВ) по сравнению с плацебо (14,9 vs 11,3 мес.). «Это исследование стало неким рубежом, позволившим открыть новую эру специфического лечения костных метастазов рака предстательной железы», — отмечает профессор Дмитрий Александрович Носов.
ALSYMPCA — рандомизированное плацебо-контролируемое клиническое исследование 3-й фазы, в котором больные метастатическим КРРПЖ с симптомными метастазами в костях получали стандартную противоопухолевую и сопроводительную терапию в комбинации с плацебо или радием-223. В исследование были включены пациенты с прогрессированием заболевания после или на фоне терапии доцетакселом (единственным препаратом на то время, показавшим улучшение общей выживаемости) или не получавшие такую терапию по различным причинам. В исследование не включались пациенты с висцеральными метастазами. Терапию радием-223 получили 615 пациентов (6 внутривенных введений 1 раз в 4 недели в дозе 50 кБк/кг массы тела), а плацебо — 307. Проведение терапии позволило увеличить медиану общей выживаемости и отсрочить время до наступления клинически значимых костных осложнений (15,6 vs 9,8 мес., р = 0,00037). В целом лечение переносилось хорошо, и частота тяжелых побочных явлений (3/4 степени) не различалась значимо между двумя группами. Наиболее характерными побочными явлениями терапии радием-223 были анемия, тромбоцитопения и диарея, но частота тяжелых осложнений из этой группы (3–4 ст.) не превышала 5 %.
Более половины пациентов (58 %) прошли все 6 запланированных курсов терапии. Интересным является вопрос — имеет ли какое- либо негативное влияние снижение количества проведенных курсов или увеличение промежутка между ними? В исследовании ALSYMPCA общая выживаемость была выше у пациентов, получивших практически полную программу лечения (не менее 5 курсов из 6 запланированных). Медиана ОВ после 5–6 инъекций Ra-223 составила 17,9 мес., а после 1–4 инъекций — 6,2 мес. (p < 0,0001). Профессор Д. А. Носов обратил внимание на тот факт, что, возможно, продолжительность жизни пациентов, получивших меньшее число курсов терапии, была связана с низким соматическим статусом и большой распространенностью процесса этих пациентов. Другими словами, по его мнению, вероятнее всего прекращение терапии ранее запланированного срока было обусловлено быстрым прогрессированием опухоли и худшим общим состоянием, что само по себе (а не меньшая продолжительность терапии) и являлось причиной худших результатов лечения.
Однако в любом случае благодаря столь значимым в отношении увеличения общей выживаемости результатам радий-223 заслуженно занял свое место во 2-й линии терапии в рекомендациях по лечению мКРРПЖ ведущих медицинских сообществ, таких как ESMO, NCCN и EAU.
НЕ ДОЖИДАЯСЬ СИМПТОМОВ
Важно отметить, что в исследовании ALSYMPCA результаты лечения улучшались вне зависимости от предшествующей химиотерапии доцетакселом. Европейский экспертный совет в 2014 году опубликовал консенсусное соглашение, в котором отражена возможность проведения радионуклидной терапии радием-223 как до, так и после химиотерапии доцетакселом (Eur J Cancer, 2014).
Одним из важнейших недостатков исследования ALSYMPCA является то, что в нем не было пациентов с мКРРПЖ, получавших в 1-й линии терапии современные гормональные препараты, такие как абиратерон и энзалутамид, ныне широко используемые в лечении таких больных. Возможность применения радия во 2-й линии терапии после абиратерона или энзалутамида оценивалась в проспективном исследовании EAP IIIb фазы (Lancet Oncol, 2016). В это исследование было включено 696 пациентов, которые в 1-й линии терапии получали доцетаксел (60 % пациентов), абиратерон (40 % пациентов) или энзалутамид (8 % больных). Медиана выживаемости в этом исследовании составила 16 месяцев, что было сопоставимо с результатами, полученными в исследовании ALSYMPCA.
Дмитрий Александрович Носов обращает внимание на то, что в настоящее время нет особых противопоказаний, которые бы не позволили использовать радий-223 после терапии с включением гормональных препаратов нового поколения. Более того, данные исследования ALSYMPCA указывают на возможность безопасного использования радия-223 у больных, получавших ранее лучевую терапию на область костных метастазов.
Важно подчеркнуть, что радий-223 одобрен к применению у больных с симптомами метастатического поражения костей, что на самом деле отражает более продвинутую стадию метастатической болезни. Однако многие специалисты склонны считать, что препарат нужно назначать и больным с бессимптомной болезнью. Крис Паркер (Chris Parker) из Royal Marsden Hospital (Великобритания) в интервью для интернет-портала onclive.com отмечал, что нет научного обоснования того, почему радий-223 будет работать у больных с симптомами очагового поражения и не будет работать у пациентов без клинических проявлений. «Обоснованием для одобрения препарата у больных с симптомами было соответствие критериям включения в исследовании ALSYMPCA, — отмечает Крис Паркер. — Однако у большинства пациентов в исследовании выраженность болевого синдрома была минимальной, т.е. корригировалась минимальной анальгетической терапией».
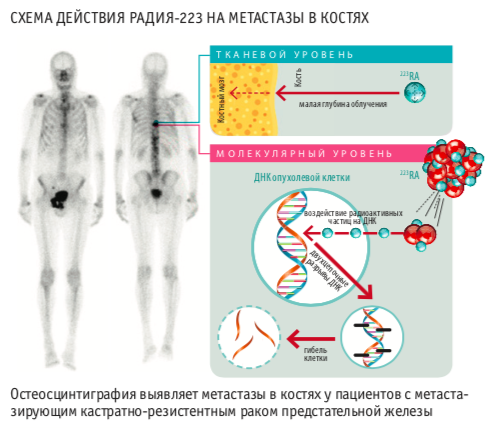
БЕЗОПАСНОЕ ОБЛУЧЕНИЕ
Радий-223, являясь излучателем альфа-частиц, выгодно отличается от бета-эмиттеров (самарий и стронций) меньшей проникающей способностью (длина пробега в тканях < 100 мкм) и значительно большей линейной передачей энергии. Облучение альфа-частицами вызывает невосстановимое двухцепочное повреждение ДНК в прилегающих опухолевых клетках. Наибольшая доза облучения (16 Гр) после полной программы облучения (6 введений в дозировке 50 кБк/кг) приходится на эндост, а на красный костный мозг — лишь 1,6 Гр. Это позволяет обеспечить более локальную противоопухолевую активность с гораздо менее выраженной гематологической токсичностью.
После внутривенной инъекции радий-223 действует как аналог кальция, концентрируясь в местах интенсивной минерализации и высокой остеобластной активности. Экскреция Ra-223 происходит в основном через кишечник, поэтому препарат не обладает нефро- или гепатотоксичностью, а спустя 24 часа от введенной дозы в крови определяется 1 %. Период полураспада Ra-223 составляет 11,4 дня.
В доклинических и клинических исследованиях не было выявлено клинически значимого накопления дочерних радиоактивных изотопов.
ПРОСТОЙ РЕГЛАМЕНТ ЛЕЧЕНИЯ
Порядок использования радия-223 в клинических условиях у больных с метастатическим КРРПЖ детально прописан в рекомендациях Европейского общества по ядерной медицине (EANM, European Association of Nuclear Medicine), опубликованных осенью 2017 года в журнале European Journal of Nuclear Medicine and Molecular Imaging.
В целом проведение курса лечения не требует соблюдения особых правил радиационной безопасности.
Лечение осуществляется в специализированных отделениях, занимающихся радионуклидной терапией. При этом важно отметить, что проведение терапии при соблюдении всех правил обращения с препаратом не связано с риском радиоактивного воздействия на медицинский персонал и окружающих.
Введение препарата выполняется в амбулаторных условиях через периферический венозный катетер путем медленного струйного вливания в течение 1 минуты. После инъекции рекомендовано краткосрочное наблюдение за пациентом в течение нескольких часов, а затем он может покинуть клинику. При развитии побочных эффектов (диарея, тошнота, рвота) применяется стандартная симптоматическая терапия. На протяжении одной недели после введения препарата пациенту рекомендуется соблюдать простые гигиенические правила (например, несколько раз смывать воду в туалете), при этом не требуется выполнения специфических требований по радиационной безопасности, таких как сон в отдельной комнате или минимизация времени пребывания с детьми.
Контрольный осмотр рекомендуется проводить в течение 10 дней до планируемой даты начала следующего курса с одновременной сдачей общего анализа крови, в котором уровень тромбоцитов должен быть не ниже 50 х 109/л, а число нейтрофилов — не менее 1 х 109/л. К сожалению, четко прописанных стандартов по оценке ответа на лечение и решению вопроса о прерывании терапии не существует. Тем не менее в рекомендациях EANM отмечено, что проведение контрольного обследования (любой визуализационный метод и биохимия крови) обоснованно при значимом клиническом ухудшении состояния пациента (шкала Карновского < 50 % или ECOG > 2).
«Главные критерии оценки эффективности лечения — это клиническое состояние пациента, биохимические маркеры (причем в большей степени важен уровень щелочной фосфатазы, а не ПСА) и радиологическое исследование с оценкой по критериям PCWG, — считает профессор Д. А. Носов. — При этом важно отметить, что при суждении о той или иной динамике опухолевого процесса следует учитывать изменения как минимум двух параметров. Также важно помнить, что в 30 % случаев у пациентов может наблюдаться транзиторное повышение ПСА в короткие сроки после начала лечения с последующим его снижением (феномен «выброса»)».
ПОЗВОЛИТЕЛЬНА ЛИ КОМБИНАЦИЯ?
Хорошая переносимость радия-223 оставляет открытым вопрос о целесообразности дополнения терапии другими классами препаратов, в первую очередь энзалутамидом или абиратероном. Частично ответ на этот вопрос был получен в уже описанном исследовании EAP, в котором почти у четверти пациентов (27 %) терапия радием-223 комбинировалась с абиратероном (25 %), энзалутамидом (5 %) или с обоими препаратами одновременно (2 %). Результаты лечения оказались схожими с таковыми в исследовании ALSYMPCA — медиана общей выживаемости составила 16 месяцев. При проведении комбинированной терапии (радий-223 с абиратероном или энзалутамидом) медиана общей выживаемости не была достигнута, а при терапии только радием она составила 13 месяцев, схожие различия были и при комбинировании с деносумабом.
Это исследование позволило получить ответ на вопрос, оставшийся после исследования ALSYMPCA. Терапия радием-223 была эффективна у больных без клинических проявлений метастатического процесса, не вошедших в исследование ALSYMPCA.
С другой стороны, в исследовании ERA 223 была выявлена тенденция к меньшей продолжительности жизни и повышению частоты переломов у больных, получающих комбинацию радия-223 с абиратероном и преднизоном по сравнению с терапией абиратерон + преднизон (J Clin Oncol, 2015). На основании этих предварительных данных исследования Европейское медицинское агентство в июле 2018 года опубликовало предостережение о совместном использовании радия-223 и абиратерона. Однако для подтверждения положительного влияния на долгосрочную выживаемость необходимы дальнейшие рандомизированные исследования.
«Пока остаются не совсем понятными причины повышения частоты переломов у больных, получавших комбинацию радия-223 с абиратероном в исследовании ERA 223, по данным предварительного анализа результатов данного исследования. Вероятнее всего, повышение частоты скелетных осложнений обусловлено приемом абиратерона, как это было в исследовании COU-301, в котором проводилось сравнение между абиратероном и плацебо. Поэтому до появления высококачественных данных об онкологической целесообразности и адекватной переносимости к использованию данной комбинации вне рамок клинических исследований следует относиться критически», — отмечает Дмитрий Александрович Носов.
На конгрессе Американского общества урологов в 2018 году были представлены результаты многоцентрового исследования 2-й фазы по сравнению безопасности и переносимости комбинации энзалутамида и радия-223 среди мужчин с симптоматическим течением мКРРПЖ и костными метастазами. Исследование, однако, было небольшим по объему (39 пациентов) и нерандомизированным. Тем не менее эти результаты позволили показать удовлетворительную переносимость комбинированной терапии — у больных отмечалось снижение выраженности болевого синдрома, улучшение качества жизни и стабильный уровень общего состояния.
Для более достоверной оценки эффективности комбинации энзалутамида и радия-223 в настоящее время проводится набор пациентов в многоцентровое рандомизированное исследование 3-й фазы PEACE 3 (NCT02194842). В это исследование планируется набрать 560 пациентов в 51 клинике, которые после рандомизации будут получать энзалутамид 160 мг/сут в монорежиме или в комбинации с радием-223 в дозе 55 кБк/кг каждые 4 недели на протяжении 6 месяцев. Критерии включения подразумевают отсутствие висцеральных метастазов и бессимптомное либо клинически минимально выраженное проявление костных метастазов. Первичная конечная точка — выживаемость без рентгенологического прогрессирования. Результаты исследования ожидаются к 2021 году.
Благодаря своим свойствам радий-223, будучи достаточно простым и безопасным в использовании остеотропным препаратом нового поколения, позволяет не только существенно снизить риски развития костных осложнений, но и значимо увеличить продолжительность жизни больных метастатическим КРРПЖ.

















