Статьи
Целиакия и болезнь Крона: трудности диагностики при поражении желудочно-кишечного тракта
Захарова Ирина Николаевна
Д.м.н., профессор, заведующая кафедрой педиатрии им. академика Г.Н. Сперанского ФГБОУ«ДПО Российская медицинская академия непрерывного профессионального образования» Минздрава РФ
Дмитриева Диана Кирилловна
Аспирант кафедры педиатрии имени академика Г.Н. Сперанского ФГБОУ ДПО «РМАПО» Минздрава РФ, Москва
Майкова Ирина Дмитриевна
К.м.н., заместитель главного врача по медицинской части ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Радченко Елена Равильевна
Гастроэнтеролог 1-го педиатрического отделения ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Новикова Екатерина Юрьевна
Гастроэнтеролог гастроэнтерологического отделения ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Скоробогатова Екатерина Владимировна
К.м.н., зав. отделением гастроэнтерологии ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Воробьева Александра Сергеевна
Заведующая педиатрическим отделением ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Кошурникова Анастасия Сергеевна
К.м.н., врач-эндоскопист первой категории, заведующая эндоскопическим отделением ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Епифанова Елена Игоревна
Патологоанатом патологоанатомического отделения ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва Екатерина Александровна ТАШИРОВА Патологоанатом ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Гостюхина Анастасия Дмитриевна
Педиатр, аспирант кафедры педиатрии имени Г.Н. Сперанского ФГБОУ ДПО «РМАНПО» Минздрава России
ПЛАТФОРМА ДЛЯ ИЗУЧЕНИЯ
Целиакия—это иммуноопосредованное системное заболевание, вызываемое глютеном у генетически предрасположенных лиц, с глютен-зависимыми симптомами, повышением в сыворотке крови специфических антител, присутствием в генотипе гаплотипов HLA-DQ2 или HLA-DQ8 и энтеропатией. Особый интерес в данной группе представляют воспалительные заболевания кишечника (ВЗК, табл.).
В систематическом обзоре, опубликованном в 2022 году, продемонстрировано, что ВЗК у пациента увеличивает риск развития целиакии в среднем в 2,9 раза, в большей степени предрасполагая к болезни Крона. В то же время в итальянском исследовании 2017 года показано, что и диагноз «целиакия» повышает риск развития ВЗК. Механизмы связи целиакии с ВЗК включают общие генетические маркеры, сходные средовые провоцирующие факторы и системное воздействие компонентов иммуновоспалительного ответа, стартующего в слизистой оболочке (СО) кишечника. В стимуляции аутоиммунных реакций при несвоевременно выявленной и нелеченой целиакии важное значение может иметь повышение проницаемости СО тонкой кишки для пищевых и бактериальных антигенов. Это важнейший аспект патогенеза ВЗК. Патологический иммунный ответ, формирующийся при обоих заболеваниях, сопровождается активным выбросом в СО кишечника провоспалительных цитокинов, к числу которых можно отнести фактор некроза опухоли-бета (TNF-β), интерферон-гамма (IFN-γ), интерлейкин-17 (ИЛ-17).
Целиакия — генетически детерминированное заболевание, ассоциированное с генами главного комплекса гистосовместимости HLA DR3-DQ2 (HLA-DQ2.5), HLA DQ3-DQ7 (HLA-DQ2.2) и HLA DR4-DQ8, расположенными на 6р21-хромосоме. Гетеродимер DQ2 обнаруживается примерно у 90–95 % больных, DQ8 — у оставшихся 5–10 %. В зависимости от количества и сочетания аллелей, представленных у конкретного больного, могут колебаться риск возникновения и тяжесть клинических проявлений заболевания. Наибольший риск развития целиакии имеют гомозиготы DQ2.
Гетеродимеры HLA-DQ2/DQ8 встречаются в популяции с частотой 30 %, при этом частота целиакии, по данным современных эпидемиологических исследований, составляет 1 %. Гены HLA определяют риск развития заболевания лишь на 36–53 %, являясь обязательным, но недостаточным компонентом патогенеза. Поиск других возможных генетических факторов, ответственных за развитие болезни, продолжается.
Генетические исследования последних лет позволили установить возможную связь развития целиакии с не-HLAгенами, расположенными на хромосомах 5 (5q31–33), 2 (2q33), 19 (19p13), 4 (4q27). Современные генетические исследования демонстрируют, что из 39 типичных не-HLA-генов, определяемых у пациентов с целиакией, 64 % могут быть выявлены еще хотя бы при одном аутоиммунном заболевании. В частности, гены, кодирующие вспомогательный белок рецептора интерлейкина-18 (IL-18 RAP), белков PTPN2, TAGAP, PUS10, описаны в генотипе как пациентов с целиакией, так и болезнью Крона. Обсуждается роль указанных генов в регуляции продукции цитокинов, активации естественных киллеров, Т- и В-лимфоцитов, а также в поддержании барьерной функции СО тонкой кишки.
ВЗК и целиакия имеют весьма похожие кишечные (диарея, боль в животе и потеря веса) и внекишечные (артриты, рецидивирующий афтозный стоматит) симптомы, а также ассоциированные аутоиммунные (АИ) заболевания, включая АИ эндокринопатии, АИ заболевания печени и желчевыделительных путей, системные заболевания соединительной ткани. Указанные особенности могут затруднять процесс дифференциального диагноза и в ряде случаев приводить к некорректной тактике ведения пациентов. Представляем два клинических наблюдения ассоциации целиакии с болезнью Крона, выявленной на разных стадиях течения глютензависимой энтеропатии.
КЛИНИЧЕСКИЙ СЛУЧАЙ 1
В педиатрическое отделение ДГКБ имени З.А. Башляевой в январе 2023 года поступил подросток пятнадцати лет с жалобами на боли в животе, учащенный разжиженный стул, эпизоды повышения температуры до фебрильных цифр. Ухудшение состояния началось в октябре 2022 года, когда впервые появились указанные симптомы на фоне нарастающей общей слабости. При первичном амбулаторном обследовании в ноябре того же года в клиническом анализе крови была выявлена гипохромная микроцитарная анемия средней степени тяжести: гемоглобин (НGB)— 83 г/л, эритроциты (RBC) — 4,9, среднее содержание гемоглобина в эритроците (MCН)—16,2 пг, средний объем эритроцитов (MCV) — 62 фл. Наблюдались также умеренно выраженный тромбоцитоз (425 тыс.) и лейкоцитоз (11 тыс.) с нейтрофильным сдвигом (абсолютное количество нейтрофилов—8140).
По рекомендации педиатра проводилась терапия антибактериальными препаратами (азитромицин), нифуроксазидом, комбинированными пробиотиками, регуляторами моторики (тримебутин), препаратами железа (III), на фоне чего был достигнут частичный эффект в виде нормализации температуры тела, исчезновения болей в животе при сохранении учащенного стула. Дифференциальный диагноз проводился между течением инфекционного гастроэнтерита, целиакией, дебютом ВЗК.
В декабре по результатам дополнительных лабораторных исследований выявлено повышение сывороточной концентрации аутоантител к тканевой трансглуаминазе (IgA — до 61,6 Ед/мл при норме 0,0–9,9), концентрации фекального кальпротектина до 988 мкг/г (норма — 0–80); исследование кала на гемоглобин-гаптоглобиновый комплекс в кале: маркеров скрытой крови не выявлено. Для углубленного обследования и окончательной верификации диагноза мальчик был направлен в стационар.
Нутритивный статус на момент поступления соответствовал умеренной белково-энергетической недостаточности: рост — 148 см (SDS роста — –0,1), масса тела — 45 кг, индекс массы тела — 15,9 кг/м2 (SDS — –2).
В клиническом анализе крови сохранялась гипохромная микроцитарная анемия средней степени тяжести (НGB — 89 г/л, RBC — 5,29, MCV — 56 фл, MCH — 16,9 пг, умеренный нейтрофильный лейкоцитоз — 11 тыс. (абсолютное количество нейтрофилов — 8100).
Биохимический анализ крови выявил глубокое железодефицитное состояние (сывороточное железо — 2,8 мкмоль/л, ферритин—12,7 нг/мл), недостаточность витамина D — 11,38 нг/мл, умеренную гиперпротеинемию — 84 г/л за счет гипергаммаглобулинемии (общий IgG в сыворотке крови — 19,74 г/л).
Результаты ПЦР и серологических исследований позволили исключить инфекционное поражение желудочно-кишечного тракта (ЖКТ), включая инфекцию C. difficile, глистные и паразитарные инвазии. В то же время данные контрольных иммунологических исследований выявили повышение концентрации антител к сахаромицетам ASCA (IgG — 25,1 Ед/мл при норме 0–10), а также значимый прирост концентрации антител к тканевой трансглутаминазе (IgA до 147,75 Eд/мл при норме 0,0–9,9), что с высокой вероятностью позволило предполагать наличие у пациента двух иммуноопосредованных заболеваний ЖКТ — болезни Крона и целиакии.
Эндоскопическое исследование обнаружило картину поверхностного гастродуоденита, илеоколита с максимально выраженными изменениями в илеоцекальной области в форме множественных эрозий терминального отдела подвздошной и начальных отделов слепой кишки, мелких язвенных дефектов в куполе слепой кишки.
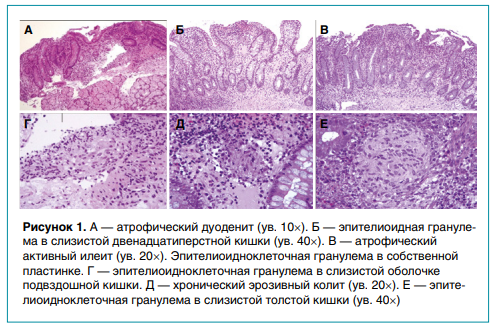
Результаты гистологического исследования выявили хроническое гранулематозное воспаление в СО различных участков ЖКТ: хронический хеликобактерный, умеренно активный гастрит антрального отдела желудка с гигантоклеточной гранулемой, хронический гранулематозный атрофический активный дуоденит, илеит, хронический гранулематозный эрозивноязвенный высокоактивный тотальный колит (рис. 1). Обращали на себя внимание особенности гистологической картины в биоптатах двенадцатиперстной кишки: наряду с доказанным гранулематозным воспалением структурные изменения СО имели форму атрофической регенераторной энтеропатии с гиперплазией крипт и межэпителиальным лимфоцитозом. С учетом серологических маркеров это позволило констатировать сочетанный характер поражения тонкой кишки, ассоциированный с целиакией и болезнью Крона. В отделении ребенка перевели на строгую безглютеновую диету, инициировали противовоспалительную терапию (преднизолон, азатиоприн, препараты 5-АСК), провели курс эрадикационной терапии (метронидазол, амоксициллин, омепразол). В результате была достигнута четкая положительная клиническая динамика в виде улучшения общего самочувствия, урежения частоты стула с тенденцией к нормализации его консистенции.
КЛИНИЧЕСКИЙ ПРИМЕР 2
Девочка семи лет с ранее установленным диагнозом «целиакия» госпитализирована в гастроэнтерологическое отделение ДГКБ имени З.А. Башляевой для углубленного обследования в связи с неполным эффектом диетотерапии, низкими темпами прибавки веса, неустойчивым характером стула (эпизоды разжиженного стула с примесью слизи), множественной непереносимостью пищевых продуктов.
В анамнезе с 2 с половиной лет с началом посещения детского сада и значительных изменений в рационе питания (увеличение количества молочных и глютенсодержащих продуктов) появились боли в животе, неоформленный обильный стул. Клиническая ситуация рассматривалась как проявление инфекционного энтероколита. По рекомендации педиатра проводилась терапия пробиотиками, сорбентами (без четкого эффекта). В динамике боли в животе участились, появились эпизоды интенсивного абдоминального болевого синдрома, по поводу которого неоднократно обращались в стационар для исключения острой хирургической патологии. В этот же период в стуле стали отмечаться прожилки крови, расцениваемые как следствие анальной трещины.
В 3 года из рациона ребенка исключили молочные продукты, на этом фоне боли в животе не исчезли, но стали менее выраженными, явления гемоколита были купированы. Строгую безмолочную диету девочка соблюдала в течение года, при этом в рационе значимо увеличилось количество глютенсодержащих продуктов. Боли в животе на этом фоне сохранялись, стул чередовался от оформленного до разжиженного. В 5 лет при минимальной травме зафиксирован перелом фаланги пальца руки, девочка перестала прибавлять в весе и росте.
Особенности клинической картины послужили основанием для первого стационарного обследования, в ходе которого была диагностирована целиакия. Основанием для этого послужили результаты двух видов обследования — серологического (избыток концентрации аутоантител к тканевой трансглутаминазе IgA — более чем в 10 раз выше нормы) и гистологического (в биоптатах слизистой двенадцатиперстной кишки наблюдалась картина атрофической энтеропатии с межэпителиальным лимфоцитозом в стадии Marsh 3B).
Результаты дополнительных лабораторноинструментальных исследований продемонстрировали дефицитные состояния (латентный дефицит железа, умеренно выраженная остеопения, по данным рентгеновской денситометрии поясничного отдела позвоночника), значимое повышение концентрации общего IgE в сыворотке (более 1000 Ед/мл при норме 0–90) с поливалентной сенсибилизацией к пищевым аллергенам. Повышение фекального кальпротектина до 720 мкг/г (норма — 0–80) стало основанием для фиброколоноскопии с лестничной биопсией, по результатам которой данных за дебют ВЗК не получено. По результатам обследования начато соблюдение строгой безглютеновой диеты с дополнительным исключением из рациона продуктов в соответствии с результатами аллергодиагностики, проведена коррекция дефицитных состояний.
В период дальнейшего катамнестического наблюдения сохранялись эпизоды гемоколита, потребовавшие повторной коррекции пищевого рациона, а также умеренно выраженные преходящие боли в животе, упорное персистирование белково-энергетической недостаточности, в том числе в условиях невозможности адекватного проведения нутритивной поддержки в связи с неудовлетворительной переносимостью ребенком лечебных смесей.
По данным лабораторных исследований, в клиническом анализе крови зафиксированы эпизоды эозинофилии с максимальным повышением количества клеток до 3500, а также длительное сохранение иммунологической активности целиакии с нормализацией концентрации специфических аутоантител к тканевой трансглутаминазе лишь спустя 2 года от начала диетотерапии. Все это потребовало очередного углубленного обследования для оценки степени восстановления СО на фоне безглютеновой диеты, исключения эозинофильного поражения и дебюта ВЗК.
К моменту госпитализации ребенок находился на строгой элиминационной диете с сохранением в рационе крайне ограниченного количества безглютеновых злаков, овощей, одного вида мяса. Нутритивный статус при поступлении соответствовал умеренной степени белково-энергетической недостаточности: рост — 121,5 см (SDS роста — –0,5), масса тела—18,7 кг, индекс массы тела— 12,6 кг/м2 (SDS — –2,3). Результаты лабораторных исследований выявили латентный дефицит железа (НGB — 129 г/л, RBC — 4,68, MCV — 72 фл, MCH — 21 пг), субклинический гипотиреоз (тиреотропный гормон — 6,68 мкМЕ/мл при норме 0,70–4,17, свободный тироксин — 0,99 нг/дл при норме 0,70–1,48).
По результатам аллергологического исследования, повышена концентрация общего IgE до 181 МЕ/мл (норма 0–90) при отсутствии сенсибилизации к пищевым аллергенам.
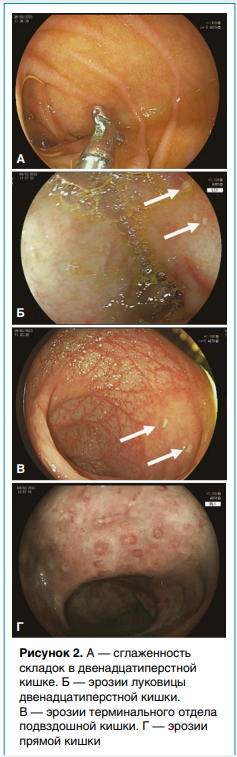
Ультразвуковое исследование обнаружило выраженные изменения в илеоцекальной области — утолщение стенок терминального отдела подвздошной и слепой кишок в сочетании с локальной лимфаденопатией. Эндоскопическое исследование выявило эрозивное поражение двенадцатиперстной, подвздошной и прямой кишок, признаки тотального колита (рис. 2).
Гистологическое исследование установило картину хронического выраженного атрофического бульбита, дуоденита, эрозивного атрофического илеита, слабоактивного колита с эпителиоидной гранулемой, поверхностными эрозиями, панетовской метаплазией. Признаков эозинофильного поражения в исследованных биоптатах не обнаружено. Таким образом, клиникоанамнестические данные и результаты обследования позволили диагностировать у ребенка дебют болезни Крона и определили необходимость начала противовоспалительной терапии (преднизолон, азатиоприн, препараты 5-АСК в форме ректальных суппозиториев) на фоне продолжения элиминационной диеты.
ВМЕСТО ЗАКЛЮЧЕНИЯ
Представленные клинические примеры демонстрируют сочетание целиакии с болезнью Крона у пациентов разного возраста. В первом случае оба заболевания диагностировали одновременно, поэтому достоверно судить о том, какое из них дебютировало раньше, невозможно. При этом результаты морфологического исследования продемонстрировали атрофическую энтеропатию с межэпителиальным лимфоцитозом в слизистой двенадцатиперстной кишки. С учетом доказанного гранулематозного воспаления (в том числе в тонкой кишке) указанные изменения могли быть расценены в комплексе гистологических маркеров болезни Крона. Однако результаты серологического исследования (нарастающая в динамике концентрация аутоантител к тканевой трансглутаминазе) не позволили исключить целиакию как вторую причину выявленной энтеропатии. Упущенный диагноз целиакии в данном случае мог привести к несвоевременному назначению диетотерапии, что определило бы упорное сохранение активности иммунного воспаления в СО тонкой кишки и могло стать фактором, негативно влияющим на эффективность медикаментозной противовоспалительной терапии.
Второй клинический пример демонстрирует развитие ВЗК у ребенка с отягощенным аллергоанамнезом на фоне целиакии с длительным сохранением иммунологической активности заболевания. Сочетанный характер поражения СО стал причиной отсутствия ожидаемой клинической ремиссии глютеновой энтеропатии, упорного сохранения белково-энергетической недостаточности и кишечного синдрома. Стоит отметить, что болезнь Крона в описанном случае развивалась постепенно, что могло объясняться строгой элиминационной диетой с крайне ограниченным количеством продуктов в рационе ребенка

















