Статьи
Атерогенные нарушения у детей и подростков
Невероятно, но факт: заниматься профилактикой атеросклеротического поражения сердечно-сосудистой системы (ССС) у младенцев в ряде случаев уже поздно, ведь оно берет начало еще во внутриутробном периоде. Что же тогда говорить о детях, выросших из пеленок, и подростках: те из них, у кого обнаруживаются расстройства липидного обмена или факторы риска атерогенных нарушений, требуют самого пристального внимания!
В российской популяции высока распространенность атерогенных дислипидемий (ДЛП), включая семейную моногенную гиперхолестеринемию (1:173) и полигенные формы семейной ДЛП (1:100–200). Распространенность ожирения, которое сопровождается атеро- генной ДЛП, у детей и подростков колеблется на уровне от 4 до 8 %. В Москве, где проживает около двух млн детей до 18 лет, наследственными нарушениями липидного обмена страдают по меньшей мере 33,5 тыс. из них. От 84 до 168 тыс. детей имеют атерогенную ДЛП на фоне ожирения. Кроме того, в помощи липидологов нуждаются несколько тысяч педиатрических пациентов, страдающих вторичными дислипидемиями на фоне эндокринных, нефрологических, а также ревматологических заболеваний.
С САМОГО ДЕТСТВА
Атеросклероз относится не только к наиболее распространенным патологическим явлениям, но и к наиболее спорным. Казалось бы, он вдоль и поперек изучен: мы знаем, как формируются холестериновые бляшки с последующим разрастанием в них соединительной ткани и кальцинозом стенки сосуда, что приводит к его деформации, сужению просвета вплоть до полной обтурации. Но при этом до сих пор не определена нозологическая сущность атеросклероза! Академики И.В. Давыдовский (1987–1968) и Ю.М. Лопухин (1924– 2016) вообще отвергали ее, считая атеросклероз не медицинской, а биологической проблемой. Выдающийся патологоанатом Ипполит Васильевич Давыдовский смотрел на атеросклероз как на естественный возрастной процесс, который берет начало в детстве и которого не избежать никому. Ведь это общебиологическое явление, закономерный путь развития живого организма от жизни к смерти.
Но если какого-то явления нельзя избежать, это не значит, что его ход нельзя замедлить, занявшись ранней профилактикой. Между здоровьем и болезнью существуют переходные (донозологические) состояния. Таким донозологическим, сопровождающим нашу жизнь явлением может быть атеросклероз — патофизиологический процесс, способный на разных этапах жизни осложняться разными заболеваниями, как правило, сердечно-сосудистыми. Их список всем известен: ишемическая болезнь сердца (стенокардия, инфаркт миокарда, аритмия); цереброваскулярные заболевания (транзиторная ишемическая атака, ишемический инсульт); атеросклероз аорты и артерий (мезентериальных, почечных, периферических и т. д.). При этом признаки атеросклероза в виде липидных пятен или полосок на стенках артерий обнаруживаются уже в раннем детстве.
Как ни парадоксально это звучит, но атеросклероз — педиатрическое заболевание, которое клинически проявляется в более позднем возрасте, а значит, его профилактика должна начинаться с детства. Особое внимание при организации профилактических мероприятий следует уделять выявлению факторов риска (ФР) развития и определению биохимических маркеров атерогенных нарушений.
К наиболее значимым ФР относятся:
• семейная предрасположенность;
• гиперлипидемия (гиперхолестеринемия);
• артериальная гипертензия (АГ);
• сахарный диабет;
• неблагоприятная экологическая обстановка;
• малоподвижный образ жизни;
• пре- и постнатальная гипотрофия;
• ожирение;
• курение (которое, к сожалению, не редкость у подростков);
• эмоциональное перенапряжение (например, на фоне подготовки к ЕГЭ);
• гипотиреоз.
Пусковая роль в развитии атерогенеза принадлежит окислительному стрессу (ОС), вызывающему энергетические нарушения в клетках, дестабилизацию их мембран, повреждение сосудистого эндотелия, инициацию воспалительных и аутоиммунных процессов, а также метаболических, эндокринных и других расстройств. Патологический процесс приобретает волнообразное прогрессирующее течение с характерной сменой стадий и фаз, что говорит о необходимости ранней коррекции возникающих атерогенных сдвигов. ОС возникает из-за повышенного образования свободных радикалов: активных форм кислорода (АФК) и продуктов перекисного окисления липидов (ПОЛ). Происходит окисление богатых холестерином (ХС) липопротеинов низкой плотности (ЛПНП). Окисленные ЛПНП активно захватываются эндотелиальными клетками с помощью скавенджер-рецепторов (от англ. scavenger — «мусорщик») и переносятся в субэндотелиальное пространство, где и происходит основной процесс клеточного окисления ЛПНП под влиянием АФК, секретируемых моноцитами и Т-лимфоцитами. В результате развивается эндотелиальная дисфункция, повышается сосудистая проницаемость, усиливается адгезия тромбоцитов и моноцитов к эндотелию. Последние в большом количестве проникают во внутреннюю оболочку сосудов, где превращаются в макрофаги и начинают активно продуцировать цитокины (интерлейкин-1 — ИЛ-1, фактор некроза опухоли — ФНО, тромбоцитарный фактор роста — ТФР и др.), усиливающие воспалительный процесс за счет стимуляции клеточной пролиферации, лейкоцитарной инфильтрации и миграции клеток.
Поглощая окисленные ЛПНП, макрофаги превращаются в нагруженные липидами ксантомные (пенистые) клетки. В результате интима утолщается, гладкомышечные клетки под влиянием ТФР мигрируют во внутреннюю оболочку сосудов, пролиферируют, синтезируют протеогликаны, коллагеновые и эластические волокна, формируя основу атеросклеротической бляшки. Из межклеточного вещества образуется фиброзная покрышка, под которой располагаются секретирующие факторы роста ксантомные клетки. При их распаде освобождается богатая липидами атероматозная масса.
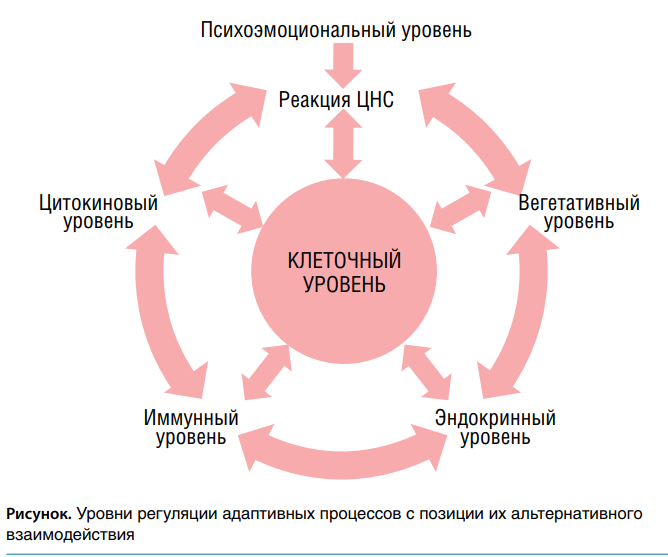
Окисляясь, ЛПНП приобретают антигенные свойства и вызывают повышенную продукцию антител, что ведет к развитию аутоиммунного воспалительного процесса. При этом ОС и воспаление стимулируют друг друга по принципу замкнутого круга. При стрессе активизируются как защитные (антистрессовые) процессы, так и повреждающие механизмы. Адаптационные реакции в организме осуществляются благодаря альтернативному взаимодействию в первую очередь катаболических и анаболических процессов, направленных на образование и сохранение энергии и взаимодействующих по принципу обратной связи, что можно назвать законом альтернативного взаимодействия. При хроническом стрессе включаются механизмы долговременной адаптации. На первых этапах отмечается умеренное повышение в крови уровня катехоламинов и глюкокортикостероидов (ГКС) и достаточно выраженное уменьшение содержания инсулина. Из-за этого ткани становятся более чувствительными к действию стрессовых гормонов, а состояние резистентности достигается на фоне менее выраженного катаболического повреждения. Преобладание катаболических реакций ведет к истощению защитных механизмов.
Ради самосохранения организм мобилизует качественно новые адаптационно-компенсаторные трофотропные реакции. Они направлены на повышение пластических и энергетических ресурсов, реорганизацию тканевых, клеточных и субклеточных структур, изменение метаболических процессов. Анаболическая стадия стрессреакции, возникающая вслед за катаболической и характеризующаяся длительной активацией синтеза нуклеиновых кислот и белка, способствует развитию долговременной адаптации. Смена стадий развития хронического стресса наглядно демонстрируется результатами наших собственных исследований адаптационнокомпенсаторных реакций у детей с недостаточной и избыточной массой тела.
Характер адаптационно-компенсаторных реакций у детей с недостаточной массой тела изучался нами в ходе исследования функционального состояния вегетативной нервной системы (ВНС). Установлено, что у детей с пре- и постнатальной гипотрофией I и II степени возникает нарастающая симпатикотония, которая при гипотрофии III степени сменяется ваготонией. Так надсегментарный уровень вегетативной регуляции сменяется сегментарным, автономным уровнем.
При оценке функционального состояния коры надпочечников у детей с пре- и постнатальной гипотрофией чаще всего определялись два типа реакции: дисфункция и гипофункция коры надпочечников. В первом случае отмечалось повышение уровня ГКС и снижение минералокортикостероидов (МКС), а во втором — отчетливое уменьшение и ГКС и МКС. Первый тип реакции коры надпочечников у детей с I и II степенью гипотрофии можно рассматривать как маркер хронического стресса в стадии резистентности. Реакция второго типа, отмечавшаяся у детей с III степенью гипотрофии, говорит об истощении функции коры надпочечников и срыве адаптации — стадии декомпенсации хронического стресса. Целесообразность установленной нами дисфункции коры надпочечников заключается в энергетическом обеспечении механизмов долговременной адаптации с переключением метаболизма преимущественно на липидный обмен. Для детей с гипотрофией характерна гиперлипидемия, которую ряд авторов считают признаком хронического стресса. При I и II степени гипотрофии гиперлипидемия в основном связана с увеличением уровня общих липидов, триглицеридов (ТГ), ХС, эфиров ХС и фосфолипидов, при III степени — с повышением уровня неэстерифицированных жирных кислот (ЖК) за счет их плохой утилизации. Под влиянием ГКС усиливается биосинтез фосфолипидов в основном за счет фосфатидилхолина, необходимого для стабилизации клеточных мембран. При II степени гипотрофии, в отличие от I и III степени, установлено достоверное повышение уровня лизофосфатидилхолина при одновременном уменьшении содержания фосфатидилхолина. Это значит, что при II степени гипотрофии отмечаются наиболее выраженные признаки дестабилизации клеточных мембран и наиболее значительное напряжение адаптационно-компенсаторных механизмов. Для сохранения жизнедеятельности клеток организм переключается на новый уровень адаптации за счет децентрализации регуляции и перехода на автономные, эволюционно более древние механизмы регуляции, что мы и наблюдали при III степени гипотрофии. Это позволяет рассматривать ее в целом как проявление хронической стрессовой реакции, осуществляющей энергетическое обеспечение адаптационно-компенсаторных механизмов за счет мобилизации нейтрального жира из жировых депо, что сопровождается развитием атерогенных нарушений.
У детей с целиакией и гипотрофией I и II cтепеней мы также выявляли дисфункцию коры надпочечников с повышенным синтезом ГКС и пониженным — МКС. Если же у этих детей на фоне аглиадиновой диеты и лечения накапливался избыточный вес, то дисфункция коры надпочечников у них характеризовалась преобладанием секреции МКС. Соотношение лизофосфатидилхолина к фосфатидилхолину у детей с недостаточной и избыточной массой тела было одинаковым и достоверно большим, чем в контрольной группе. У детей с целиакией при смене недостаточной массы тела на избыточную просматриваются две стадии: первая — с преобладанием активности катаболических (энерготропных) процессов, вторая — анаболических (трофотропных). Более глубокое представление о закономерностях развития и течения хронического стресса можно получить при исследовании клеточного энергообмена с определением ферментного статуса лейкоцитов, функции которых в первую очередь зависят от интенсивности окислительного фосфорилирования в митохондриях. Цитохимическим маркером указанного процесса является сукцинатдегидрогеназа (СДГ) — ключевой фермент цикла Кребса. Важную роль в обеспечении окислительного фосфорилирования играет α-глицерофосфатдегидрогеназа (α-ГФДГ), участвующая в челночном механизме переноса ионов водорода из цитоплазмы в митохондрии и осуществляющая связь гликолиза в цитоплазме с биологическим окислением в них. Этот фермент принимает активное участие в биосинтезе ТГ и фосфолипидов. Выраженность катаболических процессов в клетках можно оценивать по активности кислой фосфатазы (КФ) и лактатдегидрогеназы (ЛДГ). КФ — показатель дестабилизации лизосомальных мембран, ЛДГ — индикатор анаэробного гликолиза, катализирующего взаимопревращение лактата и пирувата. При хроническом стрессе повышается активность кислой и щелочной фосфатаз, но снижается активность СДГ и α-ГФДГ.
Цитохимический анализ активности некоторых митохондриальных ферментов лимфоцитов периферической крови по методу Пирса в модификации Р.П. Нарциссова проводился нами у 158 детей с гипотрофией (у 111 — с пренатальной) в возрасте от 1 до 12 мес. Гипотрофия I степени диагностирована у 77, II степени — у 68, III степени — у 13 детей. Контрольную группу составили 23 ребенка с нормальными весоростовыми показателями. У детей с пре- и постнатальной гипотрофией I–III степени активность СДГ и α-ГФДГ была достоверно (р < 0,05) снижена, а активность КФ — достоверно (р < 0,05) повышена. Снижение активности СДГ у детей с гипотрофией свидетельствует об угнетении окислительновосстановительных процессов, обусловленных накоплением продуктов липидного обмена, в том числе продуктов ПОЛ. Это связано с переключением обмена веществ при гипотрофии с преимущественно углеводного на преимущественно липидный профиль. Однако усиленное привлечение липидов для энергетического обеспечения организма ограничивается депрессией окислительного фосфорилирования, что указывает на механизмы обратной связи на уровне клеточного метаболизма. Снижение активности α-ГФДГ свидетельствует о нарушении окислительного фосфорилирования, липосинтеза и дестабилизации клеточных мембран при гипотрофии.
Достоверное (в большинстве случаев) различие цитохимических показателей при гипотрофии II и III степеней объясняется переключением регуляции с центрального на автономный уровень, что наблюдалось при гипотрофии III степени. Наши данные указывают на атерогенный характер изменений в организме детей с гипотрофией, ассоциированный с хроническим стрессовым состоянием. Признаки хронического стресса на разных иерархических уровнях мы выявляли и у детей с ожирением.
Под наблюдением находились 150 детей и подростков в возрасте от 10 до 15 лет. Из них 83 ребенка были с ожирением, при этом у 65 определялась первичная артериальная гипертензия (ПАГ). Среди 67 детей без ожирения ПАГ зафиксирована у 36, а 31 ребенок (без ожирения и ПАГ) составил контрольную группу. У всех детей, помимо общепринятых лабораторно-клинических и традиционных биохимических показателей, оценивались данные липидограммы крови и углеводного обмена. У большинства детей определялись гормоны щитовидной железы (ТТГ, свободный Т3 , свободный Т4 ), инсулин, С-пептид, адреналин, норадреналин, дигидроксифенилаланин, дофамин, ванилилминдальная и гомованилиновая кислоты. Использовались ЭКГ, кардиоинтервалография (КИГ), суточное мониторирование АД, ЭхоКГ, цитохимический анализ активности некоторых митохондриальных ферментов лимфоцитов периферической крови (СДГ, α-ГФДГ, ЛДГ).
При оценке показателей КИГ, характеризующих состояние вегетативной нервной системы (ВНС), мы по собственной методике выделяли фазы напряженной адаптации (ФНА), относительной компенсации (ФОК) и декомпенсации (ФД). Для ФНА характерно одинаковое повышение активности симпатического и парасимпатического отделов ВНС; для ФОК при высокой активности симпатического отдела — недостаточная компенсаторная активность парасимпатического отдела; для ФД на фоне повышения активности симпатического отдела — снижение активности парасимпатического отдела.
При ПАГ у детей с ожирением симпатикотония встречалась в 1,5 раза чаще, чем без него, а у детей с ожирением без ПАГ — в 2,5 раза чаще, чем без ожирения и ПАГ. При ПАГ у детей как с ожирением, так и без него ФД определялась в 70 % случаев, что связано с некомпенсированной гиперсимпатикотонией. Кроме того, у детей с ожирением достаточно часто (24 % случаев) обнаруживалсь ФНА как результат усиления ренинангиотензин-альдостероновой системы (РААС), которая «подпитывает» ВНС и обеспечивает ее адаптацию по механизму обратной связи. При ПАГ у детей с ожирением отмечается тенденция к нарастанию образования адреналина и кортизола, а также более высокие показатели средних значений С-пептида, индекса инсулинорезистентности (ИР) и инсулина.
Высокая функциональная активность надпочечников (коркового и мозгового слоев) и щитовидной железы определяют выраженную симпатикотоническую направленность вегетативного гомеостаза у детей с ожирением без ПАГ. Гиперсимпатикотония может быть причиной развития ОС, ИР, гиперинсулинемии и гиперлипидемии. Гиперинсулинемия оказывает рестимулирующее действие на симпатическую нервную систему, замыкая порочный круг формирования ожирения. Помимо стимуляции симпатической нервной системы, инсулин усиливает продукцию катехоламинов, повышает активность РААС, способствует увеличению содержания в эндотелии сосудов ионов натрия и кальция.
При анализе липидного спектра крови у детей с ожирением (по сравнению с контрольной группой) достоверно выше были показатели общего ХС (р = 0,037), ТГ (р = 0,03), индекса атерогенности (р = 0,004), а меньше — липопротеинов высокой плотности (ЛПВП; р = 0,049). Повышение уровня ЛПНП у детей с ожирением оказалось недостоверным. Установлена достоверная взаимосвязь активности лейкоцитарных ферментов у детей с ожирением с основными метаболическими и функциональными показателями. У половины определялась гиперактивация СДГ (ФНА), у 1/3 — гиперактивация, сдерживаемая ее внутренним ингибированием (ФОК), у 1/5 — снижение активности (ФД). В контрольной группе примерно у половины детей отмечалась нормальная активность СДГ, у 1/4 — повышенная и у 1/4 — сниженная.
По данным корреляционного анализа, показатель активности СДГ соотносится с уровнем среднего систолического АД (r = 0,6; р < 0,05), а также с концентрацией инсулина (r = –0,5; р < 0,05), С-пептида (r = –0,7; р < 0,05) и индексом ИР (r = –0,5; р < 0,05). Можно предположить, что активность фермента угнетается под влиянием вагоинсулярной системы и гипергликемии. Снижение активности СДГ — один из компонентов патогенеза ИР, а последняя — один из факторов атерогенеза.
У детей с ожирением установлена прямая корреляция показателя активности α-ГФДГ с уровнем ТГ (r = 0,7; р < 0,05) и отрицательная — с уровнем С-пептида (r = –0,6; р < 0,05) в крови. Это говорит о дестабилизации клеточных мембран под влиянием ТГ, а следовательно, о снижении чувствительности рецепторов и развитии ИР, что обусловливает компенсаторное усиление образования инсулина. У детей с ожирением повышена активность ЛДГ с развитием метаболического ацидоза, который сопровождается угнетением окислительного фосфорилирования. Активность ЛДГ коррелирует с уровнями С-пептида (r = –0,4; р < 0,05), ХС (r = 0,5; р < 0,05) и ЛПНП (r = 0,5; р < 0,05). Следовательно, в условиях метаболического ацидоза угнетается синтез инсулина и усиливается атерогенез. У детей с ожирением и ПАГ значительно уменьшена эндотелийзависимая вазодилатация (ЭЗВД) и утолщен комплекс интима-медиа общей сонной артерии. Величина этих показателей коррелирует с массой тела ребенка и выраженностью ПАГ. Кроме того, установлена обратная корреляционная связь значения ЭЗВД с индексом ИР и уровнем ЛПВП.
При оценке состояния детей с недостаточной и избыточной массой тела установлены однотипные ответы на разных уровнях организма, отличающиеся фазностью развития. Как у детей с гипотрофией, так и с ожирением при оценке вегетативного гомеостаза часто определяется гиперсимпатикотония, повышение уровня стрессовых гормонов, а также гиперлипидемия, признаки ОС и дестабилизации клеточных мембран. Все это указывает на хронический стресс, в развитии которого можно выделить энерготропную и трофотропную стадии. Высокая симпатико-адреналовая активность у детей с ожирением должна рассматриваться как компенсаторная реакция альтернативной системы, обусловливающая фазовый характер течения стрессовой реакции. На основании данных исследования клинических проявлений, функционального состояния ВНС, эндокринного и метаболического статуса, маркеров стадий и их фаз нами предложена классификация хронического стресса (табл.).

Важнейшую роль в патогенезе хронического стресса играют метаболические расстройства на уровне наиболее древних клеточных структур (митохондрий, клеточных мембран). Изменяясь первыми при патологическом воздействии, они стимулируют включение адаптационных реакций в эволюционно более молодых надстроенных системах: цитокиновой, иммунной, гормональной, вегетативной, центральной нервной. При хроническом стрессе как патогенетической основе атеросклероза, организация лечебных и профилактических мероприятий должна проводиться с учетом установленных стадий и фаз его развития. Это позволит индивидуализировать подход к выбору метода лечения.
Сейчас много говорят о здоровом поколении детей, которых удалось вырастить благодаря современным технологиям профилактики и диагностики целого ряда заболеваний, в том числе редко встречающихся, а также благодаря инновационным методам лечения в педиатрии и достаточному ее финансированию, когда речь идет о дорогостоящей терапии. Сегодня мы становимся свидетелями того, какой большой путь проделала педиатрия за последние 10 лет. Даже несмотря на то что врачи, возможно, слишком сильно погружены в протоколы, схемы, стандарты, критерии и клинические рекомендации, этот прогресс невозможно не заметить.

















