Статьи
Атеросклероз сосудов: что может ВСУЗИ?
Несмотря на наличие арсенала действенных лечебных средств, ишемическая болезнь сердца (ИБС) продолжает занимать первые позиции по заболеваемости и смертности. Это справедливо и в отношении атеросклероза (АС) — неизменного «сателлита» многих патологических состояний. Именно атеросклеротическая бляшка (АСБ) представляет собой хорошо, казалось бы, изученный морфологический субстрат самого распространенного сосудистого поражения.
Как известно, качественно лечит тот, кто качественно диагностирует. И в этом отношении «золотым стандартом» для ИБС остается коронарная ангиография (КАГ). Однако она не дает полной информации о стенке сосуда, так как предоставляет своего рода «силуэтные» изображения венечных артерий. На рубеже столетий наряду с рентгеноконтрастной коронарографией одной из составляющих клинической практики стало внутрисосудистое ультразвуковое (УЗ) исследование (ВСУЗИ). Благодаря значительной глубине проникновения УЗволн этот метод позволяет не только изучать состояние просвета артерии, но и осуществлять томографическую визуализацию сосудистой стенки в реальном времени, более того — анализировать детали ее строения на различных участках. Получаемые с помощью ВСУЗИ точные количественные и подробные качественные характеристики помогают оценить степень атеросклеротического поражения и выбрать оптимальный метод лечения.
Обычно АСБ развиваются незаметно и практически бессимптомно до тех пор, пока они остаются интактными. По мере прогрессирования возрастает вероятность разрыва этих образований, что влечет за собой атеротромбоз различных локализаций с большим количеством осложнений. Поэтому одинаковое значение имеют как ранняя диагностика, так и стратификация риска — разделение бляшек на относительно стабильные и нестабильные (склонные к разрывам).
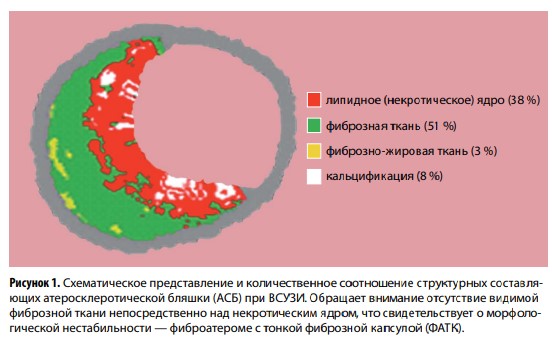
Ранее считалось, что размеры АСБ и сужение артериального просвета служат главными предикторами острых ишемических кардиоваскулярных событий. Однако к настоящему времени появляется все больше свидетельств в пользу того, что решающее значение имеет состав бляшек. Именно ВСУЗИ отводится важная роль в установлении их протяженности и морфологии. В процессе исследования с использованием серой шкалы формируется двумерное изображение, при этом качественный анализ и соответствующие характеристики АСБ определяются различной эхоплотностью тканей. Таким образом, бляшки с большим липидным ядром представляются эхонегативными, тогда как кальцинированные образования дают гиперэхогенный сигнал с акустической тенью.
Благодаря спектральному анализу частотных показателей отраженного УЗ-сигнала стала возможной более детальная оценка строения АСБ с выделением их морфологических компонентов. Такая визуализация обозначается в литературе термином «виртуальная гистология» (ВГ; англ. VH, virtual histology). Программное обеспечение VH-IVUS (англ. virtual histology, intravascular ultrasound) позволяет различать при обработке ВСУЗИ-изображений (ВСУЗИ-ВГ) 4 типа структур с соответствующей цветовой маркировкой:
- фиброзная (зеленый);
- фиброзно-жировая (светло-зеленый или желтый);
- липидное/некротическое ядро (красный);
- кальцификация (белый).
Американская кардиологическая ассоциация (AHA) разработала классификацию АСБ, основанную на возможности их идентификации. Неатеросклеротические отложения, содержащие пенистые клетки без некроза или фиброзной покрышки (колпачка), описываются как ксантомы интимы. В классификации выделяются следующие основные фенотипы АСБ, ассоциированные с различными стадиями атеросклеротического процесса:
- Патологическое утолщение интимы (включает все компоненты с преобладанием фиброзно-жирового).
- Фиброатерома (ФА) c визуализируемой толстой фиброзной капсулой (англ. ThCFA, thick-cap fibroatheroma), покрывающей некротическое ядро.
- Фиброатерома с тонкой фиброзной капсулой (ФАТК, англ. TCFA, thick-cap fibroatheroma) и крупным липидным ядром.
- Фиброзная АСБ (без липидного ядра, с признаками умеренной кальцификации).
- Кальцинированная АСБ (с некротическим ядром или без него, содержащая небольшое количество воспалительных клеток).
Особого внимания среди перечисленных морфологических вариантов заслуживает ФАТК — структурно нестабильный тип АСБ (рис. 1). Чувствительность и специфичность ВСУЗИ-ВГ в выявлении этого фенотипа варьируют по данным различных авторов в пределах 64–92 и 78–93 % соответственно.
В ряде крупных исследований — PROSPECT, VIVA, ATHEREMO-IVUS, CULPLAC — доказана связь нестабильности АСБ с наступлением неблагоприятных сердечно-сосудистых событий. Известно, что острый коронарный синдром чаще возникает в результате разрыва или эрозии фиброзной покрышки, которая прикрывает богатое липидами некротическое ядро. При этом по данным КАГ степень стеноза может быть не столь выраженной, что также отмечено в результатах протокола PROSPECT.
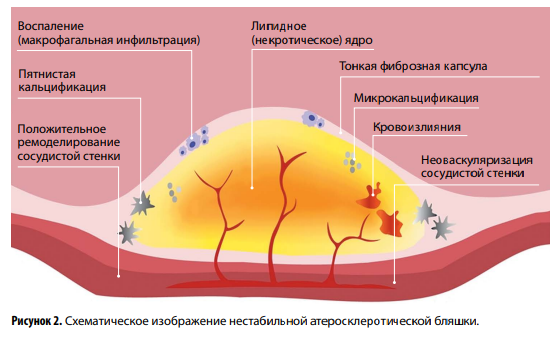
В настоящее время существуют следующие критерии повышенной нестабильности (уязвимости) бляшек (рис. 2):
- большие размеры липидного/некротического ядра (>40 % общего объема);
- тонкая (<65 мкм) фиброзная капсула;
- включения кальцинатов;
- неоваскуляризация;
- положительное ремоделирование коронарного русла в зоне расположения АСБ (направление роста бляшки наружу сосуда, что способствует расширению наружной эластической мембраны и сохранению артериального просвета);
- степень стеноза;
- локализация поражения.
Несколько исследовательских протоколов последних лет имели целью определение морфотипа АСБ в стволе левой коронарной артерии (ЛКА) и проксимальном участке передней нисходящей артерии (ПНА). Склонные к разрывам образования чаще локализовались в пределах проксимальной трети ПНА (в 83 % случаев — в 10– 40 мм от ее устья), не затрагивая ствол ЛКА. Отсюда следует, что ВСУЗИ-ВГ является полезным и эффективным решением для идентификации нестабильных бляшек, что позволяет выявить категорию пациентов с высоким риском неблагоприятных коронарных событий.
Что касается осложнений ВСУЗИ, то их частота согласно различным данным составляет от 1 до 3 %. Преимущественно встречается преходящий спазм венечной артерии, обычно быстро купируемый интракоронарным введением нитроглицерина. Серьезные осложнения, такие как диссекция и окклюзия сосуда, наблюдаются в <0,5 % случаев.
Рассматриваемая методика служит ценным дополнением к КАГ или чрескожному коронарному вмешательству (ЧКВ). Существенную помощь ВСУЗИ может оказать в сложных клинических ситуациях, например при поражении ствола ЛКА, бифуркационном стенозе, промежуточной значимости стеноза и других состояниях, когда по данным рентгеноконтрастной ангиографии не удается полностью решить все диагностические проблемы. В таких крупных протоколах, как IVUS-XPL и ULTIMATE, оценивалась эффективность ВСУЗИ при стентировании коронарных артерий. Результаты показали преимущество этой опции по сравнению с ангиографически контролируемым вмешательством для оптимизации ЧКВ при протяженных поражениях, что проявлялось в статистически достоверном снижении частоты сердечной смерти, инфаркта миокарда, тромбоза стента. В другом исследовании (ADAPT-DES) помимо значимого уменьшения частоты неблагоприятных кардиоваскулярных исходов использование ВСУЗИ приводило к изменению стратегии ЧКВ в 74 % случаев, чаще всего — к выбору более крупного стента/баллона.
Таким образом, ВСУЗИ — важный диагностический инструмент (в т. ч. на любом этапе ЧКВ) для оценки объема и морфологии АСБ, ремоделирования просвета артерии и, следовательно, для точного определения тактики эндоваскулярного лечения в каждом конкретном случае.
Читайте также
- Точка пересечения
- Пероральные антикоагулянты при неклапанной фибрилляции предсердий у больных преклонного возраста: проблемы и противоречия
- Митральная недостаточность: новые горизонты диагностики и лечения
- Гарантированная первичная профилактика в одной капсуле
- Приверженность терапии: как лечить пациента, а не заболевание?
- В повседневную практику - Клиническая задача СК №1,2024

















