Статьи
Когнитивные нарушения при сахарном диабете
Коморбидность СД и когнитивного дефицита у людей старшего возраста бьет рекорды по распространенности во всем мире, привлекая все большее внимание специалистов. Неспроста именно темой когнитивных расстройств при диабете открылся первый рабочий день крупнейшей европейской конференции по инновационным технологиям в диабетологии ATTD-2020 (Advanced Technologies & Treatments for Diabetes). В отечественной научной литературе и практической работе эта проблема также становится все более обсуждаемой.
ТРАЕКТОРИЯ ДИСФУНКЦИИ
Под когнитивными нарушениями понимают не только забывчивость — это снижение по сравнению с исходным уровнем одной или нескольких из шести когнитивных функций (КФ): память, праксис, гнозис, речь, внимание и интеллект.
Выделяют 3 степени когнитивных расстройств (КР).
1. Легкие (ЛКР). Пациент полностью ориентирован, контролирует свое поведение и эмоции, как правило, продолжает профессиональную деятельность. На некоторые странности в реализации КФ могут указывать родственники, а сам больной, как правило, никаких симптомов не замечает. Нарушения можно выявить только при проведении углубленного нейропсихологического тестирования, в частности, с исследованием нейродинамических функций (выявляется замедление скорости психомоторных реакций).
2. Умеренные (УКР) выявляются при проведении практически любых нейропсихологических тестов. Автономная повседневная активность еще сохраняется, но возникают препятствия к продолжению работы — больной уже не справляется с прежним объемом информации и обязанностей. Отличить УКР от деменции можно по трем главным признакам: сохранности повседневной активности, критике к своему состоянию и способности к компенсации дефекта.
3. Тяжелые (ТКР, или деменция) — это разной степени нарушения памяти и интеллекта в сочетании с разной выраженностью социальной дезадаптации. Патогномоничным симптомом перехода УКР в деменцию служит факт, что пациент «не справляется с жизнью». Из-за когнитивного дефекта он утрачивает способность к самообслуживанию и начинает нуждаться в посторонней помощи в элементарной и когда-то привычной повседневной активности.
ТРЕВОЖНЫЕ ПРОГНОЗЫ
Сегодня во всем мире насчитывается около 40 млн человек с деменцией. Ожидается, что их число будет удваиваться каждые 20 лет и превысит 110 млн в 2050 году. В то же время на нашей планете насчитывается 415 млн людей, страдающих СД, и по прогнозам к 2040 году их число превысит 640 млн.
Деменция имеет несомненные неблагоприятные физические, психологические, социально-экономические последствия. Когнитивные нарушения, особенно достигшие уровня деменции и сопровождающиеся расстройствами психической сферы, существенно снижают качество жизни не только самого пациента, но и родственников, которые ухаживают за ним. Поскольку пациент далеко не всегда полностью осознает глубину когнитивного дефекта и не критичен к своему поведению, окружающие страдают даже в большей степени.
РАСПРОСТРАНЕННОСТЬ ПРИ ДИАБЕТЕ
Хотя СД может увеличить риск развития деменции и в молодом возрасте (до 65 лет), подавляющее большинство пациентов с ТКР принадлежат к возрастной категории 65 +. По высокодостоверным данным выборки из 497 900 больных СД 2 типа старше 65 лет, деменция выявляется у 13,1 % в возрасте от 65 до 74 лет, что превышает уровень в общей популяции. А среди пациентов в категории от 75 лет и старше деменция развивается практически у каждого четвертого.
Ведение больных СД с деменцией — нелегкая задача, причем не только из-за трудностей подбора целевого уровня гликемии. Большое значение имеют безопасность гипогликемической терапии, обязательный контакт с родственниками пациента и теми, кто за ним ухаживает. Необходимо учитывать другие проблемы, которые препятствуют адекватному контролю СД: поведенческие нарушения, ухудшение зрения и слуха, нарушения питания, одиночество и изоляцию, социальную зависимость.
Наблюдательное исследование, продолжавшееся 13,8 + 5,8 года при участии 1291 больных СД 2 типа и 5159 человек без СД, показало, что диабет ассоциирован с повышенным риском деменции, причем она впервые регистрируется на 1,7 года раньше, а смерть от нее наступает на 2,3 года раньше, чем в контрольной группе. По данным отечественного федерального регистра, старость и дегенеративные заболевания являются четвертой по частоте причиной смертности среди пациентов с СД.
Интересны и данные исследования, проведенного в Великобритании, цель которого состояла в оценке взаимосвязи между уровнем HbA1c, диабетическим статусом и последующим снижением когнитивных функций в течение 10-летнего наблюдения. Под ним находились 5189 человек (55,1 % женщин, средний возраст 65,6 ± 9,4 года) с исходным уровнем HbA1c от 15,9 до 126,3 ммоль/моль (3,6-13,7 %). Оказалось, что повышение уровня HbA1c на 1 ммоль/моль было достоверно связано с увеличением скорости снижения глобальных когнитивных способностей (после многовариантной коррекции результатов). В частности, у пациентов с преддиабетом и диабетом она изменялась на -0,012 и -0,031 в год соответственно по сравнению с участниками с нормогликемией.
ЧТО ТВОРИТСЯ С ГИППОКАМПОМ
Нарушения инсулиновой сигнализации и чувствительности рецепторов к инсулину в нейронах и дендритных клетках при нейродегенеративных заболеваниях вызвали к жизни гипотезу о том, что метаболическая и следующая за ней когнитивная дисфункция может быть связана с нарушением влияний инсулина. Рецепторы к инсулину экспрессируются в нейронах и, что более важно, в синаптических терминалях гиппокампа, которые играют ключевую роль в сохранении памяти. В головной мозг инсулин поступает из общего кровотока, ведь гематоэнцефалический барьер проницаем для этого гормона. Имеются также данные о том, что он может вырабатываться обонятельной луковицей и зубчатой извилиной и действовать не только на гиппокамп, но и на обонятельную луковицу.
Нормальная инсулиновая сигнализация улучшает память и стимулирует синаптическую пластичность в гиппокампе, который, как уже было сказано выше, играет важную роль в формировании памяти и процессе обучения. Инсулин также участвует в регуляции уровня нескольких важных нейротрансмиттеров (в том числе ацетилхолина и норадреналина), задействованных в механизмах формирования памяти, и способствует кумуляции рецепторов ГАМК на постсинаптической мембране. Тем не менее было показано, что использование инсулина не предотвращает развитие когнитивной дисфункции.
Актуальна также теория нейровоспаления. При диабете возрастает экспрессия провоспалительных цитокинов (NF-kB, IL-6, TNF и др.) в головном мозге, что играет важную роль в повреждении нейронов. В образцах гиппокампа страдающих СД наблюдается активация микроглии как при болезни Альцгеймера (БА). Нейровоспаление, в свою очередь, тесно связано с окислительным стрессом: конечные продукты гликирования стимулируют выработку активных форм кислорода (АФК), что усиливает воспаление и нейродегенерацию. TNF также подавляет нормальные сигнальные пути инсулина, что приводит к еще большему увеличению синтеза АФК и когнитивным нарушениям. В большинстве исследований СД 2 типа ассоциируется с атрофией головного мозга (рис. 1). Отмечаются и распространенные изменения в микроструктуре белого вещества, которые также возникают на фоне СД и явно связаны с когнитивной дисфункцией. Учитывая тесную ассоциацию СД и сосудистых заболеваний, очевиден интерес к проявлениям так называемой болезни мелких сосудов головного мозга. Ее маркерами при магнитно-резонансной (МР) визуализации служат лакунарные инфаркты мозга, гиперинтенсивность белого вещества, лейкоареоз и расширение периваскулярных пространств.
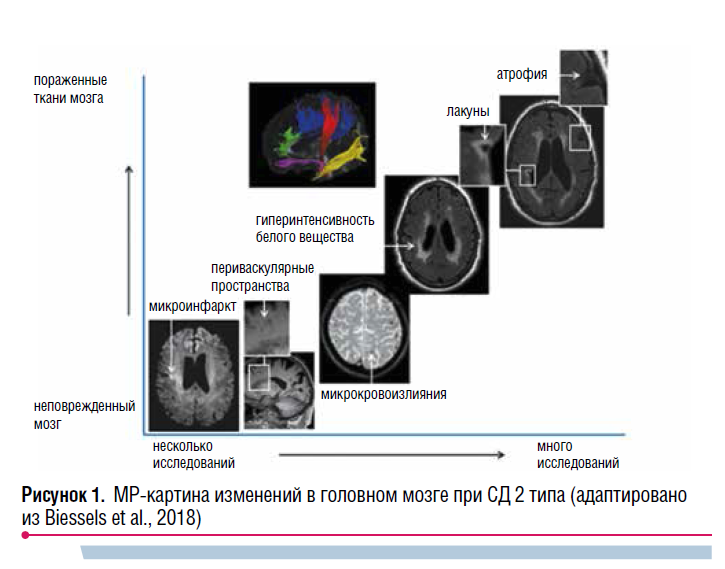
ЧТО ВАЖНЕЕ?
Длительное время ведущими факторами патогенеза когнитивного снижения при СД считались сосудистые нарушения и гипогликемия. Поскольку глюкоза — основной энергетический субстрат для головного мозга, гипогликемия служит одним из главных факторов риска когнитивного дефицита у больных СД. Рецидивирующая умеренная гипогликемия встречается более чем в 70 и 40 % случаев у пациентов с СД 1 и 2 типа соответственно — значительно чаще, чем тяжелая гипогликемия. Однако именно тяжелые гипогликемии в анамнезе ассоциированы с большим риском деменции, если сравнивать таких больных с пациентами без гипогликемий. Не говоря уже о том, что тяжелая гипогликемия может привести к развитию комы и создает угрозу для жизни пациента.
Связь между гипогликемией и КФ нельзя назвать односторонней — она, скорее, реципрокная. С одной стороны, гипогликемия потенцирует и ускоряет когнитивное снижение, а с другой — люди с низким когнитивным статусом допускают серьезные нарушения при самоконтроле и лечении. Забывая, приняли препарат или нет, делают это повторно. Увидев на глюкометре цифры, не соответствующие норме (по их мнению), самовольно повышают дозу сахароснижающих препаратов. Забывают поесть при введении инсулина. Все это создает значимый риск гипогликемии. Так возникает замкнутый круг, который очень непросто разорвать.
А ведь СД ассоциирован не только с сосудистой деменцией, но и деменцией альцгеймеровского типа. Механизм ее развития объясняется в основном персистирующей гипергликемией с токсическим влиянием на нейроны через осмотические инсульты и оксидативный стресс с выраженным повышением выработки конечных продуктов гликирования и провоспалительных цитокинов. Центральная инсулинорезистентность и гиперинсулинемия также меняют метаболизм бета-амилоида и тау-протеина, что может способствовать их депонированию в цитоплазме нейронов.
ДИАГНОСТИЧЕСКИЕ ТЕСТЫ
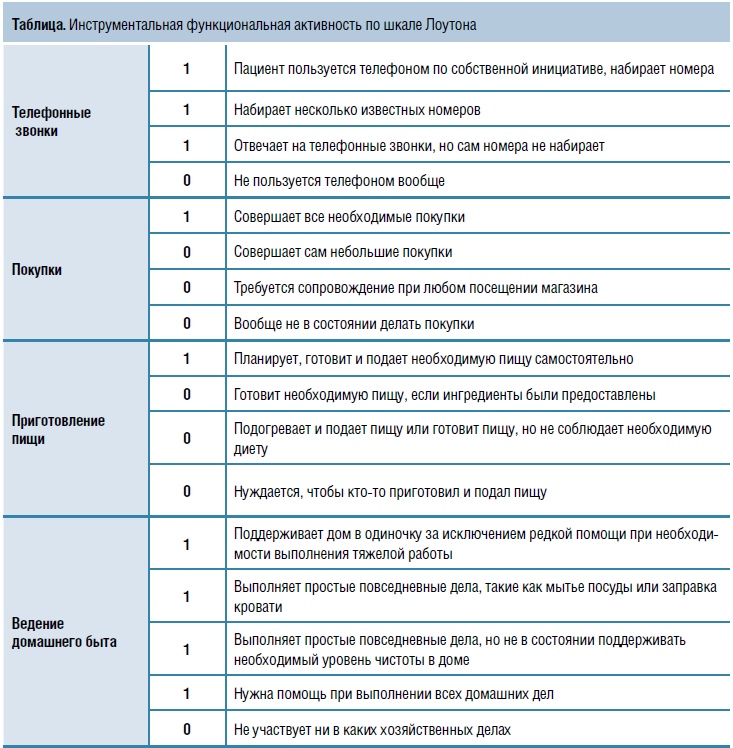
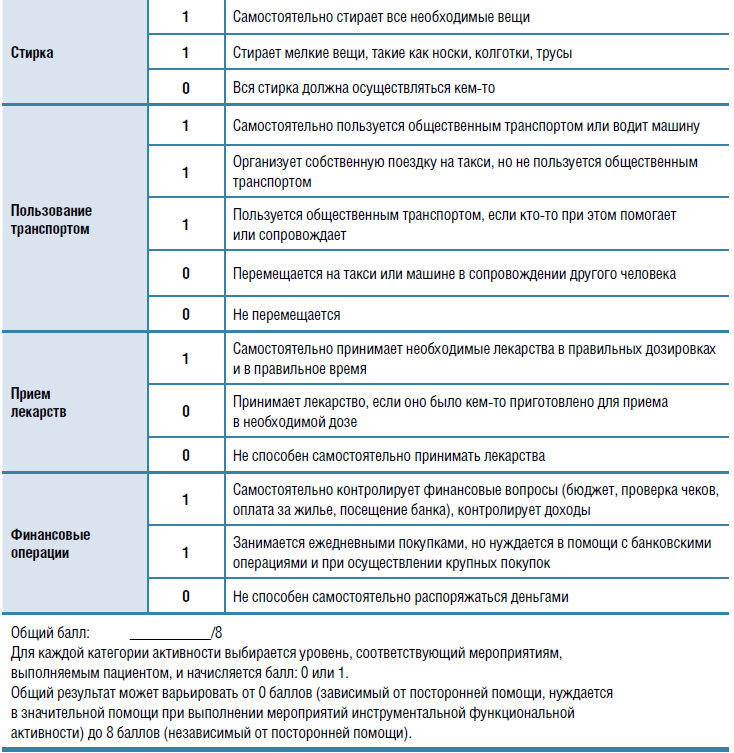
Пожилые пациенты обладают очень разными функциональными возможностями. Если человек способен сам выполнять повседневные дела (поход в магазин, приготовление пищи, уборка и т. д.), он считается функционально независимым, даже если нуждается в помощи, когда нужно добраться куда-то вне мест привычной доступности (например, поехать в другой район города). Функционально зависимые люди, которым требуется содействие со стороны в повседневной активности, чаще госпитализируются и меньше живут. Для оценки уровня ункциональной активности и степени
зависимости от посторонней помощи используются специальные шкалы — базовая (индекс Бартела) и инструментальная (шкала Лоутона) (табл.). Динамическая оценка состояния пациента по этим шкалам позволяет проследить течение и скорость прогрессирования функциональных нарушений.
Объективно оценить когнитивные функции гораздо сложнее. Для этого используются специализированные опросники: MMSE, тест рисования часов, батарея лобной дисфункции, MOCA-тест и др. Инструктаж пациента, заполнение тестов и особенно интерпретация результатов требуют времени и определенных навыков, поэтому лучше, если нейропсихологическое тестирование будет проводить специально подготовленный врач (невролог или психиатр). В качестве скрининга на нарушение КФ используют тест с часами. Он методически несложен и, хотя служит проверкой конструктивного праксиса, тем не менее отражает интегральные показатели КФ в целом.


КОГНИТИВНАЯ СОХРАННОСТЬ
Состояние пациента старшего возраста с медлительностью, общей слабостью, недостаточностью питания, непреднамеренной потерей веса называют синдромом старческой астении. Она делает человека уязвимым перед неблагоприятными факторами и ситуациями, в том числе перед агрессивной медицинской тактикой. Излишне активное лечение хронических заболеваний, частые госпитализации, избыточная диагностика, массивная лекарственная терапия, с одной стороны, могут привести к превышению риска этих мероприятий над их пользой и снижению качества жизни пациента. А с другой стороны, известное исследование ARIC при участии более чем 5 тыс. человек, которым в среднем было 76 лет, показало, что у людей старшего возраста без деменции сам СД и его длительное течение, а также неадекватный контроль гликемии ассоциированы с когнитивным ухудшением. Пациенты с хорошо контролируемым СД (HbAlc ниже 7 %о) не имели повышенного риска развития когнитивного дефицита. У больных с нормальным когнитивным статусом при включении в исследование СД и гликемический контроль были четко ассоциированы с развитием УКН.
К сожалению, пока еще не существует эффективных мер по предотвращению когнитивных нарушений, вызванных гипогликемией. В наших силах лишь наладить настройки сахароснижающей терапии так, чтобы она не наносила вреда больному. В отечественных рекомендациях отмечена нередкая избыточность такой терапии, что увеличивает риск гипогликемий, а значит, требует депрескрайбинга, особенно у пациентов с достигнутым HbAlc в рамках индивидуальной цели. Депрескрайбинг может осуществляться путем уменьшения дозы, перевода на препарат с низким риском гипогликемии или отмены медикаментозной терапии. Существуют таблетированные формы и инсулины с минимальным риском эпизодов гипогликемии. Необходимо отдавать предпочтение молекулам, показавшим отсутствие неблагоприятных фармакокинетических, фармакодинамических и клинических особенностей у пациентов старшего возраста. Нужно разъяснять родственникам и сиделкам, как и зачем контролировать показатели гликемии, почему нельзя допускать повторного приема и передозировки препарата или пропуска приемов пищи.
Екатерина Геннадьевна Демьяновская,
врач-невролог, к.м.н., доцент кафедры неврологии ФГБУ «Центральная государственная медицинская академия» УДП РФ
Благодарим главного научного сотрудника НМИЦ эндокринологии МЗ РФ,
д.м.н. Елену Викторовну Суркову за материалы, предоставленные в открытом доступе
Читайте также
- Эволюция подходов к терапии сахарного диабета 2 типа
- Современная борьба с акромегалией: опыт столицы
- «Прокрустово ложе» кардиоренометаболического континуума при СД 2 типа: есть выход!
- Пациенты с эндокринопатиями на второй волне пандемии COVID-19
- Деглудек: новый инъекционным инсулин длительного действия
- Формула любви
- Цифровые технологии управления диабетом
- Как подбирать дозы инсулина в реальной клинической практике?
- Диалог с пациентом: вместе мы сильнее
- Профессор Преображенский из повести Булгакова «Собачье сердце»: кто был прототипом?

















