Статьи
Комбинированная терапия метастатического рака предстательной железы
В рамках XXV Российского онкологического конгресса, прошедшего в Москве 9–11 ноября, состоялся сателлитный симпозиум, посвященный одному из наиболее актуальных вопросов онкологии — лечению метастатического рака предстательной железы. Спикеры обобщили имеющийся опыт, обсудили современные стандарты терапии и озвучили долгожданные итоговые результаты исследования ARCHES, впервые прозвучавшие на конгрессе ESMO 2021. Рассмотрение клинических примеров сделало общение еще более интересным и интерактивным.
Открывая сессию докладов сообщением «Эволюция антиандрогенов: ренессанс комбинированной гормональной терапии у больных метастатическим ГЧРПЖ», д. м. н. М.И. Волкова (ФГБУ «НМИЦ онкологии имени Н.Н. Блохина» Минздрава России) напомнила, что в настоящее время в нашей стране наблюдается прирост заболеваемости раком предстательной железы (РПЖ) и каждый пятый впервые выявленный случай — это диссеминированная форма заболевания. Ключевую роль в прогрессировании РПЖ играет стимуляция андрогенного сигнала, поэтому основой лекарственного лечения остается кастрационная терапия, независимо от фазы заболевания. Однако медикаментозная кастрация не полностью блокирует поступление андрогенов в опухоль, а аденокарцинома предстательной железы (ПЖ) характеризуется гиперэкспрессией андрогенных рецепторов с пиком на этапе кастрационной резистентности, поэтому перспективным способом усиления андрогенной блокады является дополнительный блок андрогенного рецептора. Реализовать эту концепцию позволили нестероидные антиандрогены второго поколения, которые, помимо связывания андрогенного рецептора на поверхности клеток, подавляют его транслокацию в ядро клетки, препятствуют связыванию с ДНК и нарушают транскрипцию соответствующего гена. Наиболее изученным препаратом данной группы с доказанной эффективностью при метастатическом гормоночувствительном РПЖ (мГЧРПЖ), неметастатическом кастрационно-резистентном РПЖ (нмКРРПЖ) и метастатическом кастрационнорезистентном РПЖ (мКРРПЖ) является энзалутамид. Исследование ENZAMET показало преимущества энзалутамида над антиандрогенами первого поколения по показателям общей выживаемости (ОВ) (80 % против 72 % выживших через 3 года наблюдения соответственно), времени до повышения уровня ПСА, клинического прогрессирования или смерти у пациентов с мГЧРПЖ.
ESMO 2021: результаты исследования ARCHES
Проф. Б.Я. Алексеев подробно рассказал об исследовании ARCHES, финальные результаты которого были представлены на конгрессе ESMO 2021. Это многоцентровое международное рандомизированное двойное слепое плацебо-контролируемое исследование III фазы, направленное на изучение энзалутамида в комбинации с андроген-депривационной терапией (АДТ) у пациентов с мГЧРПЖ, длившееся с марта 2016 года по конец мая нынешнего. Исследование проходило на всех континентах, в нем принимали участие пациенты в том числе из России. Всего в ARCHES было включено 1150 мужчин с первичным или рецидивным мГЧРПЖ.
Участники были рандомизированы в 2 группы. Одна из них получала энзалутамид 160 мг в сутки + АДТ (n = 574), другая — плацебо + АДТ (n = 576). Все пациенты были стратифицированы по объему опухолевого поражения (большой или малый) и предшествующему применению доцетаксела (нет, либо 1–5, либо 6 курсов). Распространенность злокачественного процесса оценивалась по критериям CHAARTED. Первичной конечной точкой была оценка выживаемости без радиологического прогрессирования (рВБП), вторичной — оценка ОВ. Средний возраст участников составлял 70 лет. Около 2/3 из них имели большой объем опухолевого поражения. Медиана ПСА находилась в диапазоне 5,10–5,40 нг/мл (с учетом применения АДТ до рандомизации).
Через 12 месяцев от начала лечения 84 % пациентов не имели радиологической прогрессии в группе энзалутамида и лишь 64 % — в группе плацебо. Добавление энзалутамида к АДТ у больных с мГЧРПЖ привело к достоверному снижению риска радиологического прогрессирования или смерти на 61 %. Подгрупповой анализ показал, что пациенты имели преимущество от применения энзалутамида независимо от объема опухоли и распространенности злокачественного процесса или предшествующего назначения доцетаксела. При малом объеме опухоли риск прогрессирования снижался на 75 %, при большом — на 57 %. Получение преимуществ также не зависело от группы риска, к которой относился пациент, по критериям LATITUDE. Спикер напомнил, что данные критерии определяют мГЧРПЖ высокого риска по наличию 2 критериев из 3: висцеральных метастазов, 3 и более костных метастазов любой локализации и сумме баллов по шкале Глисона 8 и более. По данной классификации также преимущество от применения энзалутамида наблюдалось у пациентов как низкого, так и высокого риска (снижение риска прогрессии на 58 и 66 % соответственно). Снижение риска радиологического прогрессирования у ранее не получавших доцетаксел составило 64 %, у предварительно пролеченных доцетакселом — 47 %.
На конгрессе EAU в 2019 году были представлены данные об эффективности энзалутамида у пациентов с впервые выявленным мГЧРПЖ и после предшествующего лечения. Было показано снижение риска радиологического прогрессирования на 66 % у пациентов с первично выявленным опухолевым процессом и на 70 % — у получавших местное лечение в виде радикальной простатэктомии (РПЭ) и/или облучения зоны предстательной железы. Особенно выраженное преимущество было отмечено у тех, кто получал энзалутамид после РПЭ — риск прогрессирования снижался на 82 %.
Далее проф. Б.Я. Алексеев привел результаты исследования ARCHES по вторичным конечным точкам. Добавление энзалутамида к АДТ показало снижение риска симптомного скелетного осложнения на 48 %, развития кастрационной резистентности — на 72 %. Еще более выраженным оказалось преимущество комбинации энзалутамида с АДТ, по сравнению с монотерапией АДТ, по времени выживаемости без биохимического прогрессирования: снижение риска на 91 % против 63 % соответственно.
Докладчик назвал прогностически важной оценку глубины снижения ПСА: исследование SWOG показало, что при достижении неопределяемого уровня ПСА (менее 0,20 нг/мл) прогнозируемая медиана ОВ может составлять более 6 лет. При назначении энзалутамида 68 % пациентов имели неопределяемый уровень ПСА в ходе лечения по сравнению с 17 % в группе плацебо (увеличение частоты неопределяемого уровня ПСА составило 51 %).
Переходя к обсуждению общей выживаемости, эксперт упомянул промежуточные «незрелые» данные исследования ARCHES, озвученные в 2019 году на симпозиуме ASCO GU. На тот момент длительность наблюдения за пациентами была еще недостаточной для окончательных выводов, но уже тогда было показано снижение риска смерти на 19 % в группе энзалутамида + АДТ.
На конгрессе ESMO 2021 были представлены финальные данные по общей выживаемости и времени до последующей противоопухолевой терапии. По состоянию на 28 мая 2021 года 397 (34,5 %) пациентов продолжали лечение, при этом медиана наблюдения составила 44,6 месяца. Средняя продолжительность лечения была 40,2 месяца для энзалутамида + АДТ и 13,8 месяца — для плацебо + АДТ, а также 23,9 месяца — для пациентов из группы плацебо, переведенных на терапию энзалутамидом (кроссовер).
Четырехлетняя ОВ составила 71 % среди пациентов в группе энзалутамида + АДТ и только 57 % — в группе плацебо + АДТ. Разница ОВ между группами в пользу энзалутамида + АДТ становилась все более очевидной по мере увеличения продолжительности лечения: через 2 года — 4 %, через 3 года — 9 %, через 4 года — 14 %. Комбинированная терапия энзалутамидом с АДТ достоверно увеличила ОВ больных мГЧРПЖ по сравнению с монотерапией АДТ, со снижением риска смерти на 34 %. Преимущество в отношении ОВ продемонстрировано во всех подгруппах независимо от объема опухоли и предшествующего лечения доцетакселом. Применение комбинации энзалутамида и АДТ достоверно увеличивало время до следующей линии терапии с учетом кроссовера (n = 184): 42 % пациентов, исходно получавших плацебо + АДТ, в последующем был назначен энзалутамид.
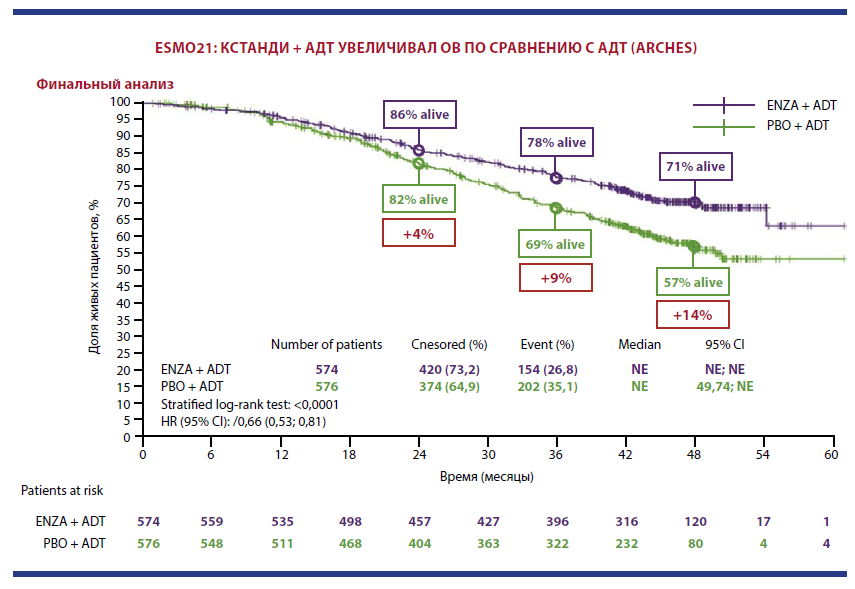
Применение энзалутамида не отразилось на безопасности лечения: частота нежелательных явлений была сопоставимой в обеих группах.
Таким образом, в исследовании ARCHES клинические преимущества энзалутамида были доказаны для обширной популяции пациентов с мГЧРПЖ по всем показателям эффективности — общей выживаемости, радиологической и биохимической выживаемости без прогрессирования, времени до начала новой противоопухолевой терапии, до первого скелетного осложнения, до развития кастрационной резистентности и частоте объективного ответа. Резюмируя сказанное, проф. Б.Я. Алексеев еще раз подчеркнул, что результаты исследования ARCHES подтвердили: комбинация энзалутамида и АДТ на сегодняшний день является стандартом лечения большинства подгрупп пациентов с мГЧРПЖ, позволяющим продлевать жизнь даже не на месяцы, а на годы.
Реальная клиническая практика
О применении энзалутамида у пациентов с мГЧРПЖ в реальной клинической практике рассказал К.М. Нюшко (МНИОИ имени П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России).
Клинический случай 1. У пациента 65 лет в январе 2016 года был диагностирован РПЖ сТ3аNxM0. С учетом прогрессирования в апреле 2016 года была проведена радикальная простатэктомия с расширенной тазовой лимфаденэктомией. По результатам гистологического исследования опухоль представляла собой ацинарную аденокарциному, 7 (3 + 4) баллов по шкале Глисона, в одном из 38 лимфатических узлов (ЛУ) был выявлен метастаз аналогичного строения без выхода за пределы капсулы лимфоузла. В итоге стадия была изменена на РПЖ рТ3bN1M0.
Ранее в исследованиях было показано, что пациенты с метастазами РПЖ не более чем в 2 регионарных ЛУ после хирургического лечения имеют очень хороший отдаленный прогноз и могут оставаться под наблюдением длительное время без необходимости немедленной адъювантной АДТ. На основании этих данных и действующих клинических рекомендаций пациенту было рекомендовано динамическое наблюдение без проведения гормональной терапии.
Безрецидивный период составил 13 месяцев, но в мае 2017 года был выявлен биохимический рецидив (рост уровня ПСА до 0,80 нг/мл). На ПЭТ-КТ обнаружен единичный ЛУ 1,5 × 1,2 см в проекции общей подвздошной артерии слева. Пациенту была проведена сальважная парааортальная лимфаденэктомия, и по результатам гистологического исследования в 3 из 22 ЛУ выявлены метастазы аденокарциномы без выхода за пределы капсулы ЛУ.
Через месяц после операции уровень ПСА составлял 0,02 нг/мл, безрецидивный период продлился 21 месяц. Однако при контрольном обследовании в апреле 2019 года снова было выявлено повышение уровня ПСА (0,50 нг/мл) с последующим его увеличением до 0,90 нг/мл в мае. По результатам ПЭТ-КТ подтверждено метастатическое поражение костей таза (3 метастаза) и поясничного отдела позвоночника (1 метастаз). В связи с рецидивом метастатического гормоночувствительного РПЖ пациенту была рекомендована АДТ аналогом лютеинизирующего гормона рилизинг-гормона (ЛГРГ) в сочетании с энзалутамидом. Первую дозу энзалутамида пациент получил в декабре 2019 года, и уже в марте 2020‑го (через 3 месяца после начала лечения) уровень ПСА снизился до 0,10 нг/мл. В настоящее время пациент продолжает получать терапию энзалутамидом в сочетании с АДТ, уровень ПСА на 02.11.2021 составлял 0,01 нг/мл.
Клинический случай 2. Пациент 69 лет, без предшествующих урологических жалоб, в феврале 2020 года обратился за медицинской помощью по поводу боли в спине. На МРТ было выявлено поражение позвонков поясничного отдела, предположительно, метастатического характера. Уровень ПСА составлял 264,00 нг/мл. По результатам биопсии ПЖ обнаружена ацинарная аденокарцинома, 8 (4 + 4) баллов по шкале Глисона. По данным дообследования выявлены множественные метастазы в костях таза и позвоночнике, единичный очаг в легком. В марте 2020 года пациенту диагностирован РПЖ сТ4NхM1b.
В связи с наличием первичного мГЧРПЖ с большим объемом опухолевого поражения больному было рекомендовано лечение аналогом ЛГРГ и энзалутамидом 160 мг в сутки. Первую дозу энзалутамида пациент получил в апреле 2020 года, а уже в мае, то есть через месяц, уровень ПСА составил 1,50 нг/мл. Болевой синдром в те же сроки редуцировался, а к настоящему моменту полностью купирован. Уровень ПСА на конец октября нынешнего года составил 0,30 нг/мл. Достигнута радиологическая стабилизация заболевания. В настоящее время пациент продолжает терапию по прежней схеме.
Приведенная клиническая практика сответствует существующим рекомендациям и данным метаанализов: предпочтительной опцией для увеличения ОВ при мГЧРПЖ является комбинация АДТ с энзалутамидом.
Тактика при развитии кастрационной резистентности
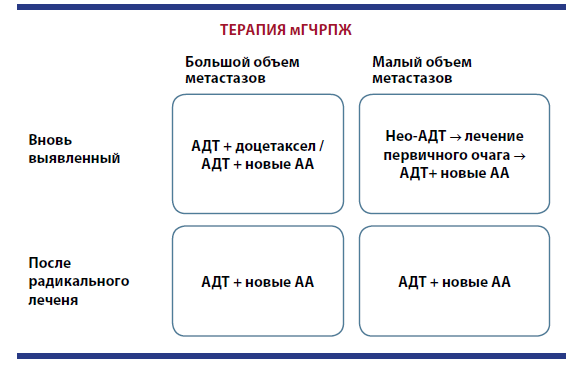
Член-корр. РАН В.Б. Матвеев («ФГБУ «НМИЦ онкологии имени Н.Н. Блохина» Минздрава России) начал свой доклад «Гормональная терапия больных КРРПЖ по современным стандартам» с напоминания, что КРРПЖ — совсем иное заболевание, все пациенты с РПЖ рано или поздно переходят в эту фазу. В свою очередь, популяцию пациентов с КРРПЖ можно разделить на три группы: больные с неметастатическим КРРПЖ; пациенты с КРРПЖ, получающие первую линию терапии; пациенты, получающие вторую и последующие линии терапии.
Известно, что время удвоения ПСА (ВУПСА) менее 10 месяцев коррелирует с увеличением риска смерти от прогрессирования заболевания и появлением костных метастазов при нмКРРПЖ. И назначение антиандрогенов второго поколения увеличивает общую выживаемость и выживаемость без метастазирования. Российские, европейские и американские рекомендации учитывают этот момент, предписывая назначение энзалутамида при нмКРРПЖ с ВУПСА менее 10 месяцев с уровнем доказательности I.
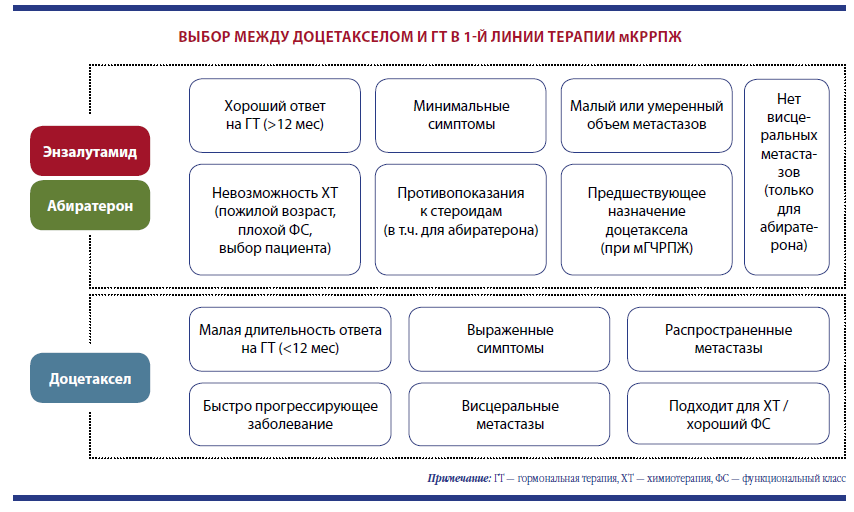
Согласно клиническим рекомендациям Минздрава РФ 2021 года, энзалутамид является одним из препаратов первой линии при мКРРПЖ до применения доцетаксела. Позиция основана на данных исследований, показавших достоверное увеличение ОВ по сравнению с плацебо (35,3 и 31,3 месяца соответственно) и снижение риска смерти на 23 %. Причем преимущество по ОВ сохраняется в динамике при 5‑летнем наблюдении. Важный аргумент в пользу энзалутамида — более благоприятный профиль безопасности и лучшая переносимость в сравнении, например, с абиратероном и доцетакселом. Энзалутамид показал одинаковую эффективность и хорошую переносимость у пациентов разного возраста, в том числе старше 75 лет, а также при наличии висцеральных метастазов и без них.
К.м.н. Н.В. Фадеева (ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины») проиллюстрировала современную тактику ведения пациентов с КРРПЖ на примерах из клинической практики.
Клинический случай 1. Пациент 44 лет на момент постановки диагноза (2016 год) предъявлял жалобы на боли в костях, в связи с чем было проведено обследование, которое выявило очаги в грудных позвонках. Было выдвинуто предположение, что очаги носят вторичный характер. Был заподозрен РПЖ, по результатам трансректального УЗИ обнаружено новообразование с признаками выхода за пределы капсулы ПЖ. Гистологическое исследование биоптата выявило аденокарциному ПЖ, индекс Глисона составил справа 7 (4 + 3), слева — 6 (3 + 3), уровень ПСА — 164,00 нг/мл. Пациенту был диагностирован первичный мГЧРПЖ Т3N0M1b.
С ноября 2016 по март 2018 года пациент получал гормонотерапию аналогами ЛГРГ и бисфосфонаты, 6 циклов доцетаксела, что позволило снизить уровень ПСА до 1,56 нг/мл. Однако в марте 2018 года было отмечено появление нового очага в проекции 9‑го ребра слева, выявлены метастазы в кости таза, уровень ПСА с марта по апрель 2018 года увеличился с 8,50 до 19,83 нг/мл. Были рекомендованы хирургическая кастрация и возобновление приема доцетаксела. Но даже на этом фоне уровень ПСА продолжал динамически нарастать, достигнув 52,60 нг/мл, в связи с чем в январе 2019 года была рекомендована терапия энзалутамидом.
Назначение энзалутамида позволило снизить уровень ПСА, уменьшить болевой синдром и улучшить общее состояние пациента уже к маю 2019 года. Всего пациент получил 15 циклов терапии энзалутамида с хорошим эффектом, однако в мае 2020 года вновь зарегистрировано прогрессирование заболевания с уровнем ПСА 48,51 нг/мл. Терапия третьей линии проводилась в рамках протокола клинического исследования (пембролизумаб + олапариб). Несмотря на лечение, в сентябре 2021 года было зафиксировано дальнейшее прогрессирование заболевания, выявлены новые очаги в костях. В настоящий момент пациент продолжает получать аналоги ЛГРГ и бисфосфонаты.
Таким образом, энзалутамид продемонстрировал высокий уровень эффективности в качестве терапии второй линии у пациента с мКРРПЖ после ранее проведенной химиотерапии доцетакселом. Применение энзалутамида позволило стабилизировать злокачественный процесс, улучшить состояние больного для проведения дальнейшего противоопухолевого лечения.
Клинический случай 2. У пациента 74 лет в августе 2010 года было выявлено увеличение уровня ПСА до 64,00 нг/мл. В сентябре с учетом результатов биопсии ПЖ диагностирован первичный мГЧРПЖ (аденокарцинома ПЖ) Т3N0M0. Индекс Глисона составил 7 (3 + 4). При проведении однофотонной эмиссионной компьютерной томографии (ОФЭКТ) поражения костей обнаружено не было. Следует отметить наличие у пациента сопутствующей патологии: ишемическая болезнь сердца, гипертоническая болезнь III стадии, артериальная гипертензия 0–I степени. В 1998 году пациенту было выполнено аортокоронарное шунтирование.
С учетом большого объема опухоли назначена максимальная андрогенная блокада (МАБ): гозерелин + бикалутамид. В феврале 2011 года удалось добиться снижения уровня ПСА до 0,67 нг/мл. Был проведен сплит-курс лучевой терапии на предстательную железу, парапростатическую клетчатку, семенные пузырьки. В дальнейшем пациент продолжал получать МАБ в течение 2 лет.
В начале 2016 года, когда пациент достиг возраста 80 лет, было зарегистрировано прогрессирование заболевания: нарастание уровня ПСА до 53,80 нг/мл, появление множественных скелетных метастазов. В апреле выполнена хирургическая кастрация, продолжена МАБ, терапия дополнена бисфосфонатами. В сентябре 2016 года уровень ПСА снизился до 8,67 нг/мл.
Однако в декабре 2017 года уровень ПСА увеличился до 75,70 нг/мл. В январе 2018 года в правой подвздошной кости был выявлен остеобластический очаг, в связи с чем в марте пациенту были назначены паллиативный курс лучевой терапии на правую подвздошную кость и доцетаксел (10 циклов). В июне 2018 года уровень ПСА снизился до 31,00 нг/мл, в сентябре — до 14,60 нг/мл, но в декабре резко увеличился до 514,00 нг/мл. Выполнено УЗИ ПЖ, которое выявило объемное образование 12 × 16 мм. ОФЭКТ выявила множественное поражение костей скелета с появлением новых очагов в боковом отрезке пятого ребра, правой лопатке, правой седалищной кости. Было принято решение о назначении энзалутамида.
Пациент получал энзалутамид с января 2019 по май 2020 года, что позволило снизить уровень ПСА до 210,00 нг/мл к январю 2020 года. Следует отметить хорошую переносимость препарата — токсические реакции не наблюдались. Дальнейшее прогрессирование заболевания отмечено через 15 месяцев терапии, в связи с чем была изменена схема лечения.
Этот клинический случай демонстрирует возможность назначения энзалутамида пациентам старшей возрастной группы с коморбидной патологией. Применение энзалутамида сопровождалось хорошей переносимостью с отсутствием токсических реакций на прием препарата.
Клинический случай 3. Пациент 58 лет, диагноз РПЖ был поставлен в 2012 году, верифицирован результатами гистологического исследования биоптата ПЖ (аденокарцинома, индекс Глисона 7 [3 + 4], Т2N0M0). На момент постановки диагноза метастазирования в кости скелета не выявлено. Наблюдался большой объем остаточной мочи (более 120 мл), в связи с чем в апреле 2013 года пациенту была проведена лучевая терапия в традиционном объеме и назначено лечение аналогом ЛГРГ (гозерелин). С 2013 по 2019 год больной получал интермиттирующую терапию аналогом ЛГРГ.
На этом фоне к апрелю 2019 года удалось достичь уровня ПСА 5,60 нг/мл. Однако уже в мае он увеличился до 42,09 нг/мл, в связи с чем к терапии был добавлен антиандроген первого поколения. Это привело к краткосрочной биохимической ремиссии (в июне 2019 года ПСА составило 10,23 нг/мл). В декабре 2019 года в связи с прогрессированием (нарастание ПСА до 24,97 нг/мл) выполнена билатеральная орхиэктомия. Однако в марте 2020 года уровень ПСА вновь увеличился (до 62,55 нг/мл), ВУПСА составило 3,5 месяца. КТ органов малого таза, брюшной полости, ОФЭКТ, рентгенография органов грудной клетки не выявили признаков отдаленного метастазирования. Пациенту был поставлен диагноз нмКРРПЖ, риск метастазирования оценен как высокий, в связи с чем был назначен энзалутамид.
Пациент получает препарат на протяжении 19 месяцев, уровень ПСА снизился до 5,20 нг/мл (октябрь 2021). Нежелательных явлений, токсических реакций не отмечено.
Этот кейс демонстрирует, что при нмКРРПЖ с помощью энзалутамида удается установить контроль над заболеванием. Дополнительным преимуществом является хорошая переносимость препарата.
Клинический случай 4. Пациент 70 лет обратился с жалобами по поводу острой задержки мочи в мае 2020 года, в связи с чем возникла необходимость установки цистостомы. Уровень ПСА на тот момент был 70,00 нг/ мл. По результатам проведенного в июне УЗИ объем ПЖ составлял 150 см3. Гистологическое исследование биоптата ПЖ показало наличие аденокарциномы, индекс Глисона составлял 8 (4 + 4). ОФЭКТ выявила множественные очаги в костях скелета, КТ органов грудной клетки показала наличие множественных очагов в легких с двух сторон. Пациенту был поставлен диагноз РПЖ Т3N1M1.
В июле 2020 году пациенту был назначен энзалутамид в комбинации с аналогом ЛГРГ и бисфосфонатами. К октябрю уровень ПСА снизился до минимального, составив 0,12 нг/мл. КТ органов грудной клетки показала отсутствие очаговой патологии. По данным ОФЭКТ, очаговые образования в костях скелета сохраняются, но не проявляют метаболической активности. На текущий момент пациент продолжает прием энзалутамида. Срок приема препарата составляет 16 месяцев. Нежелательные явления от терапии, токсические реакции не зарегистрированы.
Данный клинический случай показывает, что терапия с включением в схему первой линии энзалутамида позволяет в сжатые сроки достичь ремиссии с сохранением высокого качества жизни благодаря благоприятному профилю безопасности лечения.
Екатерина Демьяновская

















