Статьи
Практический курс по fusion-биопсии и интерпретации МРТ простаты
Значение МРТ и биопсии в диагностике рака простаты
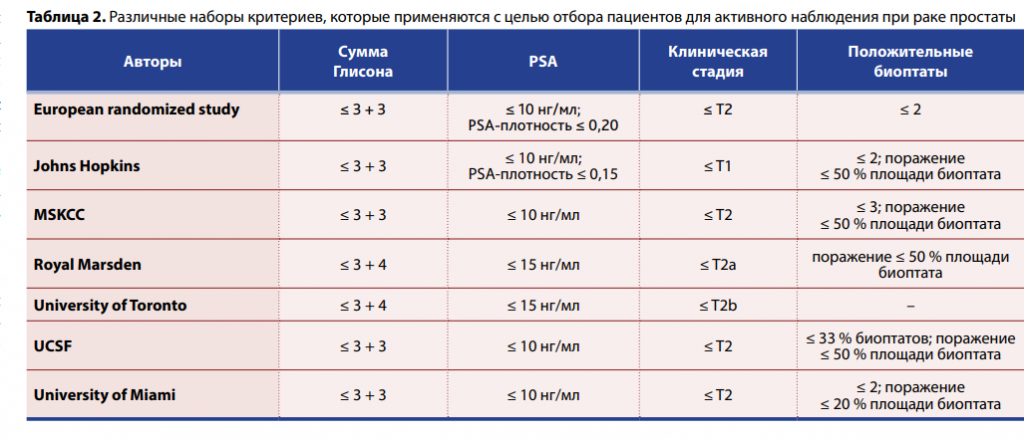
Как известно, в зависимости от показаний различают первичную и вторичную биопсию простаты. Под вторичной понимают повторную биопсию, которая выполняется при персистирующем повышении уровня PSA и сохранении подозрения на рак, когда при первой биопсии его выявлено не было. В клинической практике, конечно, встречаются и третичные, и четвертичные биопсии… Особо выделяют подтверждающую биопсию простаты в рамках протокола активного наблюдения при верифицированном клинически незначимом раке.
Биопсия простаты может выполняться трансректальным и трансперинеальным доступом. Трансректальная биопсия имеет ряд недостатков. Из-за прохождения иглы через прямую кишку риск микробной контаминации мочевых путей с развитием клинически выраженной инфекции составляет 10 %. Кроме того, затруднено получение материала из передней и апикальной частей простаты. По представленным на курсе данным, изза этого могут быть пропущены около 30 % злокачественных опухолей. Однако последний недостаток, в отличие от повышенного риска септических осложнений, может быть в значительной степени компенсирован опытом оператора. Промежностная биопсия характеризуется более высокой выявляемостью рака и хорошей конкордантностью с результатами гистологического исследования удаленной простаты. Риск инфекционных осложнений при ней значительно ниже, хотя частота острой задержки мочи может оказаться несколько более высокой (6,5 % против 5,0 %). Как правило, трансперинеальная биопсия более болезненна и требует наркоза, хотя на мастер-классе была продемонстрирована методика местной инфильтративной анестезии с поэтапным введением раствора анестетика в подкожную жировую клетчатку, мышцы тазового дна и парапростатическую клетчатку.
 Итак, зачем же нужна МРТ простаты, если верификация диагноза в любом случае требует выполнения биопсии? Во-первых, отрицательная предиктивная ценность МРТ в отношении клинически
Итак, зачем же нужна МРТ простаты, если верификация диагноза в любом случае требует выполнения биопсии? Во-первых, отрицательная предиктивная ценность МРТ в отношении клинически
значимого рака простаты составляет около 90 % и своевременное ее выполнение позволяет избежать до 40 % биопсий, как показало многоцентровое проспективное исследование PROMIS. Положительный экономический эффект связан с устранением расходов на выполнение биопсии и борьбу с ее осложнениями. По данным разных авторов, отрицательный результат МРТ говорит о минимальном риске обнаружения клинически значимого рака простаты еще в течение 3–5 лет. Во-вторых, положительная предиктивная ценность при обнаружении паттерна PI-RADS 5 составляет 85 %, что может служить дополнительным аргументом для выполнения биопсии, если пациент и врач ощущают сомнения по поводу ее целесообразности. В-третьих, МРТ позволяет сразу произвести адекватное радиологическое стадирование, тогда как геморрагические артефакты после биопсии затрудняют интерпретацию результатов.
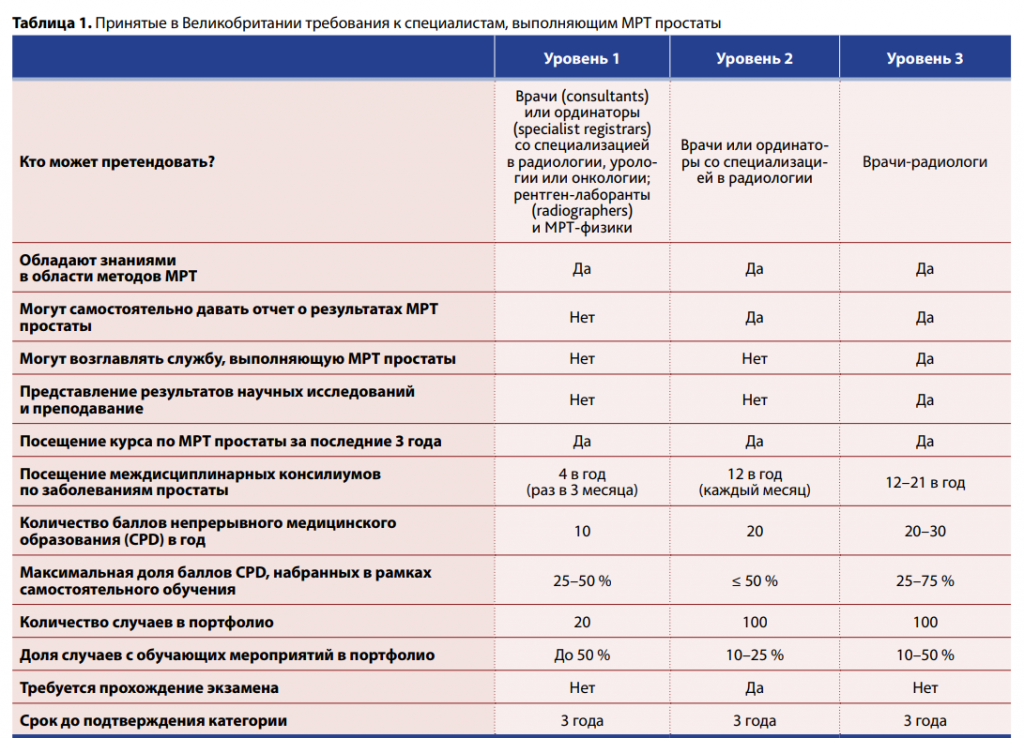
Как и любая другая современная технология, МРТ простаты имеет кривую обучения. По мере совершенствования навыков интерпретации снимков снижается частота определения очагов, относящихся к двусмысленной категории PI-RADS 3. Другими показателями качества считаются отрицательная предиктивная ценность (как указано ранее, она должна составлять не менее 90 % для PI-RADS 1) и частота верного определения целей для биопсии. Интересно, что в Великобритании специалистов, обученных интерпретации и рапортировании результатов МРТ простаты, делят на три класса (Barrett et al., 2021).
Краеугольным камнем интерпретации МРТ простаты является классификация PI-RADS. Первый ее вариант вышел еще в 2012 году и назывался ESUR Prostate MRI Guidelines, и уже задним числом был назван PI-RADS v. 1. В 2015 году вышла более точная PI-RADS v. 2, в которой существенно уменьшена значимость динамического контрастного усиления и совсем оставлена магнитно-резонансная спектроскопия. Небольшие изменения в протокол были внесены в 2019 году, в результате чего появилась PI-RADS v. 2.1.
Таким образом, после исключения спектроскопии из протокола PI-RADS мультипараметрическая МРТ простаты должна включать в себя три последовательности: T2-взвешенные изображения (опухоль обычно гипоинтенсивна), диффузионновзвешенные изображения (ограничение диффузии) и контрастное усиление (интенсивный ангиогенез). Самой ценной последовательностью можно считать получение диффузионно-взвешенных изображений (diffusion-weighted imaging, DWI). Режим DWI позволяет оценить интенсивность броуновского движения в заданном объеме ткани. Для этого генерируются два радиочастотных импульса, которые могут иметь разную мощность, длительность и разделяющий их интервал. Данные характеристики импульсов в режиме DWI упрощенно описывают значением b, которое измеряется в секундах на квадратный миллиметр (с/мм2). В обычной ткани броуновское движение молекул воды почти не ограничено. При раке же значительно увеличено количество клеток в заданном объеме ткани, повышено ядерноцитоплазматическое соотношение, и из-за этого маршрут свободного движения молекул сокращается, что становится заметно при применении режима DWI, особенно с большим значением b.
При контрастном усилении очаг считается положительным, если удовлетворяет трем условиям: имеет фокальный характер, накапливает контраст раньше окружающих тканей и главное — совпадает с подозрительным очагом на T2 или DWI. Таким образом, контрастирование играет лишь вспомогательную роль в интерпретации МРТ. По сути, от него может зависеть только присвоение категории PI-RADS 3 или 4 небольшому сомнительному очагу на периферии. Для периферической зоны наиболее важна DWI-последовательность, а для переходной—T2. Опытный радиолог часто может дать заключение, ориентируясь только на эти две последовательности (т.н. бипараметрическая МРТ).
Типичный очаг рака в периферической зоне простаты хорошо очерчен, гомогенен и гипоинтенсивен на T2. В переходной зоне неопластический очаг умеренно гипоинтенсивен, имеет нечеткие границы и структуру (симптом «стертого рисунка углем»). Круглые инкапсулированные очаги в переходной зоне с неоднородной интенсивностью («организованный хаос»), как правило, являются аденоматозными узлами и характеризуются как PI-RADS 1–2. Кристоф Кастнер обратил внимание на то, что сложная пятибалльная система PI-RADS по факту разделяет пациентов всего лишь на три категории. PI-RADS 1–2 не требует выполнения биопсии, а PI-RADS 4–5 при прочих равных условиях— требует. Третья категория, PI-RADS 3, остается головной болью для специалистов, поскольку однозначной тактики в отношении таких пациентов не существует.
Кристоф Кастнер обратил внимание на то, что сложная пятибалльная система PI-RADS по факту разделяет пациентов всего лишь на три категории. PI-RADS 1–2 не требует выполнения биопсии, а PI-RADS 4–5 при прочих равных условиях— требует. Третья категория, PI-RADS 3, остается головной болью для специалистов, поскольку однозначной тактики в отношении таких пациентов не существует.
Трудности в интерпретации результатов МРТ
Конечно, в интерпретации МРТ простаты много подводных камней. Некоторые нормальные анатомические структуры и доброкачественные изменения могут выглядеть как рак. Возможно нарушение техники выполнения МРТ или появление артефактов по иным причинам. Частой проблемой являются эктопические очаги доброкачественной гиперплазии. Как известно, аденома произрастает из переходной зоны предстательной железы, но в определенных ситуациях ее узлы оказываются в периферической зоне. Возможна протрузия аденоматозных узлов (в этой ситуации выручает просмотр изображений в разных плоскостях) или их полная экструзия на периферию. Градация PI-RADS для переходной и периферической зон отличается, поэтому интерпретировать такую картину бывает трудно.
Целый ряд проблем связан с визуализацией опухоли в нетипичных зонах. Дело в том, что алгоритм оценки МРТ хорошо отработан для периферической и транзиторной зон, а передняя фибромускулярная строма и центральная зона остаются сложными для интерпретации и могут скрывать в себе сюрпризы. Надо помнить, что типичная передняя строма представляет собой участок в виде полумесяца с низкой интенсивностью на всех последовательностях при мпМРТ. Центральная зона в большинстве случаев определяется на T2-взвешенных изображениях, а в 18 % случаев асимметрична, что связано с присутствием близлежащих аденоматозных узлов. Таким образом, эти находки, являясь элементами нормальной зональной анатомии простаты, не должны настораживать в плане подозрения на злокачественную опухоль. Интерпретация состояния семенных пузырьков также трудна из-за его большой вариативности. Их магнитно-резонансные характеристики зависят от срока воздержания от половой активности, наличия обструкции семявыбрасывающих протоков, последствий кровоизлияния и воспаления.
«Не все рак, что ограничивает диффузию»,— так Тристан Баррет перефразировал старую поговорку, говоря об абсцессах предстательной железы. Действительно, очаги гнойного воспаления характеризуются четкими границами и ограничением диффузии на МРТ, что может вызвать подозрение на рак. По краям абсцесса отмечается раннее накопление контраста, а при наличии грануляционной ткани оно проявляется и внутри, хотя в меньшей степени. Дифференцировать рак и абсцесс, помимо клинической картины, позволят T2-взвешенные изображения, на которых воспалительный очаг выглядит изоинтенсивно или гиперинтенсивно.
Внедрение мпМРТ простаты в рутинную клиническую практику
В сухом остатке мпМРТ обладает хорошей чувствительностью и отрицательной предиктивной ценностью, что улучшает выявление клинически значимого рака и уменьшает гипердиагностику клинически незначимых случаев. Низкая специфичность и слабая положительная предиктивная ценность тем не менее делают биопсию обязательным элементом диагностического процесса для верификации рака. МРТ — прекрасный инструмент для медицинской «сортировки», позволяющий отложить или избежать биопсии у четверти кандидатов. Для внедрения его в практику обязательны контроль качества и командный подход с вовлеченностью урологов, радиологов и патоморфологов. С целью оптимизации обучения на собственном материале, например, необходимы раздельная маркировка образцов, взятых при системной и таргетной биопсии, и последующее сопоставление данных МРТ и гистологии.
Интересные данные были показаны в Кембриджском исследовании, где оценивался катамнез пациентов после отрицательного результата МРТ. Из 311 пациентов, за которыми велось наблюдение на протяжении 5 лет, только 9,0 % повторно подверглись биопсии, а клинически значимый рак простаты за эти годы был обнаружен у 2,9 %. Среди 130 пациентов, которым, несмотря на отрицательный результат МРТ, выполнялась первичная биопсия (также с отрицательным результатом), клинически значимого рака при последующем наблюдении и повторных биопсиях вообще не выявлено.
Нельзя ограничиваться только данными лучевой диагностики. При неоднозначных результатах МРТ хорошо помогает показатель PSA-плотности, подсчитанный с учетом объема простаты по МРТ. PSAплотность менее 0,2 позволяет избежать выполнения биопсии. Высокая точность достигается при использовании формулы объема вытянутого сфероида.
В плане выявления рака «золотым стандартом» может считаться трансперинеальная fusion-биопсия с координатной сеткой, превосходящая остальные подходы по выявлению рака. Она обеспечивает хороший доступ к передним отделам простаты, а фиксированное положение ультразвукового датчика обеспечивает самое стабильное слияние изображений. Но и обычные трансперинеальные и трансректальные биопсии под местной анестезией имеют свою нишу, так как требуют меньше ресурсов, могут быть выполнены амбулаторно и тоже позволяют применять fusion-технологии, хотя и в иных вариантах.
Не угасают споры о сравнении аппаратной и когнитивной fusion-биопсии. Как-то я услышал из уст одного из мэтров российской урологии фразу «против робота в хирургии выступают только те, у кого его нет». Здесь ситуация аналогичная. Если есть доступ к аппаратной fusion-биопсии и ресурсы для ее выполнения, почему бы ей не пользоваться? Однако исследования показывают, что эффективность аппаратной и когнитивной биопсии сопоставима при хорошем опыте оператора и радиолога. В условиях обучения предпочтительно, конечно, истинное аппаратное слияние изображений. Оба варианта желательно сочетать с систематической биопсией.
Активное наблюдение и мпМРТ при раке простаты
 Активное наблюдение сегодня является признанной опцией при раке простаты низкого онкологического риска. К нему прибегают под презумпцией того, что даже при появлении первых признаков, требующих активного вмешательства, пациента попрежнему будет ожидать благоприятный прогноз. Предложено как минимум семь различных наборов критериев для активного наблюдения при раке простаты. Самыми смелыми в этом отношении являются специалисты из Sunnybrook Hospital (Торонто, Канада) и Royal Marsden Hospital (Лондон, Великобритания), допускающие активное наблюдение даже при сумме Глисона 3 + 4. Однако именно за счет этой группы пациентов в когорте Sunnybrook отмечается самая высокая 15-летняя смертность от рака простаты при активном наблюдении, достигающая 5,0 %. Для сравнения, в Johns Hopkins этот показатель составляет 0,5 %.
Активное наблюдение сегодня является признанной опцией при раке простаты низкого онкологического риска. К нему прибегают под презумпцией того, что даже при появлении первых признаков, требующих активного вмешательства, пациента попрежнему будет ожидать благоприятный прогноз. Предложено как минимум семь различных наборов критериев для активного наблюдения при раке простаты. Самыми смелыми в этом отношении являются специалисты из Sunnybrook Hospital (Торонто, Канада) и Royal Marsden Hospital (Лондон, Великобритания), допускающие активное наблюдение даже при сумме Глисона 3 + 4. Однако именно за счет этой группы пациентов в когорте Sunnybrook отмечается самая высокая 15-летняя смертность от рака простаты при активном наблюдении, достигающая 5,0 %. Для сравнения, в Johns Hopkins этот показатель составляет 0,5 %.
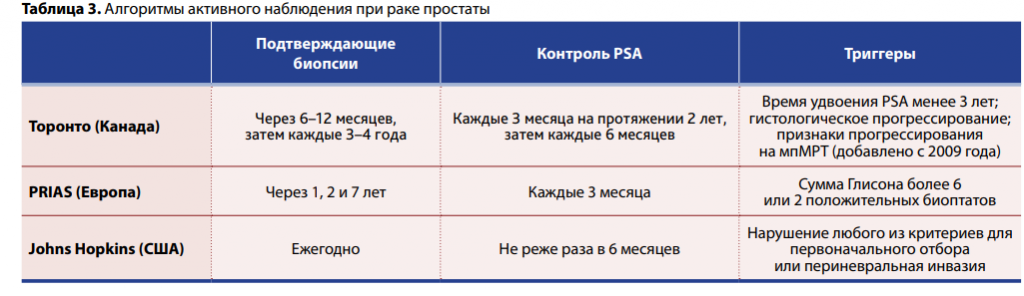
Алгоритмы активного наблюдения также неодинаковы, как и наборы триггеров для перехода к активному лечению. В большинстве случаев требуются повторные биопсии и частое определение уровня PSA.
Некоторые центры включают мпМРТ в схему активного наблюдения при раке простаты. Заключение мпМРТ с PI-RADS 1–2 снижает потребность в выполнении подтверждающих биопсий. По некоторым данным, последовательное сопоставление снимков, выполненных в разные годы, позволяет даже заподозрить изменение суммы Глисона. В публикации Moore et al. (2017) предложена пятибалльная шкала Ликерта, оценивающая вероятность прогрессирования на активном наблюдении по данным МРТ. Похожую функцию выполняет шкала PRECISE (Caglic et al., 2020). Тем не менее результаты сравнения мпМРТ и гистологических заключений после радикальной простатэктомии не столь оптимистичны. Микроскопическое экстрапростатическое распространение заподозрить по результатам мпМРТ нельзя.
Заключение
Показания к мпМРТ простаты постепенно расширяются. Сегодня она нужна не только для планирования биопсии и оперативного вмешательства, но и для определения показаний к биопсии, а также может применяться в рамках активного наблюдения. Навык интерпретации результатов этого исследования становится востребованным даже в практике амбулаторного уролога. В современном алгоритме ведения пациентов с подозрением на рак простаты fusion-биопсия незаменима, даже в своей наименее технологически продвинутой вариации — когнитивной. Однако она не настолько совершенна в плане диагностической ценности, чтобы полностью отказаться от систематической биопсии.
Читайте также
- Back flow во время ретроградной интраренальной хирургии
- Дефицит тестостерона у мужчин в вопросах и ответах
- Дерматологические аспекты баланопоститов. Что важно знать урологу
- Лечение мочекаменной болезни— сила в природе
- Современные методики хирургического лечения ДГПЖ
- «Казус Кукоцкого» в медицинской литературе, или ошибки терминологии

















