Статьи
Саркоидоз сердца: неизвестный и загадочный
Саркоидоз (болезнь Бенье–Бека–Шауманна) — редкое мультисистемное воспалительное заболевание неизвестной этиологии, характеризующееся образованием неказеозных гранулем с рубцеванием, фиброзом либо их спонтанным разрешением. Наиболее частая локализация процесса, поражающего любые анатомические области,— легкие, лимфатическая система и орган зрения. Кардиальная форма встречается редко и зачастую протекает незамеченной вплоть до развития серьезных осложнений. Лишь 5 % пациентов имеют клинически выраженное поражение сердца, тогда как в 20–25 % случаев симптомы отсутствуют и диагноз подтверждается лишь результатами аутопсии.
НАСКОЛЬКО ЭТО РАСПРОСТРАНЕНО?
Ранее считалось, что ⅔ больных с клиническими проявлениями кардиального саркоидоза (КС) имеют локализованное поражение этого органа без признаков внесердечной патологии. К настоящему времени установлено, что распространенность изолированного КС колеблется в пределах 3,2–9,4 %.
Системный саркоидоз чаще диагностируется у представителей скандинавских народов и афроамериканцев, среди азиатского населения заболевание встречается реже. Преимущественная возрастная категория пациентов — 25–60 лет (с незначительным преобладанием женщин); у людей моложе 15 и старше 70 лет болезнь наблюдается редко.
ОТЧЕГО ВОЗНИКАЕТ?
Несмотря на то что в последние десятилетия число публикаций о саркоидозе непрерывно увеличивается, причины и механизмы его развития остаются недостаточно изученными. Предполагается, что в патогенезе имеют значение как факторы наследственности и окружающей среды, так и дисрегуляция иммунного ответа. Среди инфекционных агентов, потенциально играющих роль в этиологии болезни, единственным на сегодняшний день выделенным из саркоидных поражений микроорганизмом является Propionibacterium acnes.
КАК ЭТО ВЫГЛЯДИТ?
Согласно литературным данным, выделяют 3 варианта течения КС:
• фульминантный (внезапная сердечная смерть, инфарктоподобный вариант, кардиогенный шок);
• быстропрогрессирующий (с нарастанием тяжести проявлений до критического уровня в течение максимум 1–2 лет);
• медленнопрогрессирующий (хронический с рецидивами и улучшениями).
Клиническая картина складывается также из 3 основных синдромов: болевого (кардиалгического), аритмического (включающего предсердные и желудочковые аритмии, нарушения АВ-проводимости, дисфункцию синусового узла и другие нарушения ритма и проводимости) и синдрома недостаточности кровообращения. Наиболее частые симптомы при КС — учащенное сердцебиение, предобморочное состояние и обмороки, одышка, ангинозная боль в грудной клетке, отеки; иногда первым проявлением заболевания может оказаться остановка сердца. Тем не менее, как уже отмечалось, в ~25 % случаев КС протекает бессимптомно.
Проявления КС (как и результаты инструментальных исследований) обусловлены, с одной стороны, активностью болезни, распространенностью и локализацией поражения, а с другой — преобладающей стадией гранулематозного процесса (отек — инфильтрация — фиброз с образованием рубцов). Гранулематозное воспаление преимущественно поражает левый желудочек (ЛЖ), межжелудочковую перегородку (МЖП) и папиллярные мышцы, редко — правый желудочек (ПЖ) и предсердия. Нередко в процесс вовлекаются эндокард и перикард. Так, АВ-блокада, блокады ножек пучка Гиса или дисфункция синусового узла могут быть как результатом воспаления либо наличия рубцовой ткани в области проводящей системы, так и следствием прямого поражения гранулемами кровоснабжающих ее артерий. Обширная воспалительная и фиброзная инфильтрация миокарда вызывает появление сердечной недостаточности (СН), которая, прогрессируя, в 25–75 % случаев становится причиной смерти страдающих КС. В свою очередь, в качестве причины кардиалгического и острого коронарного синдромов могут выступать нарушение резерва коронарного кровотока ввиду компрессии микрососудов миокарда или иногда — гранулематозный коронарный артериит. В редких случаях гранулемы располагаются на клапанах, приводя к возникновению клапанной недостаточности (чаще митральной).
Одной из характерных черт поражения сердца при саркоидозе считается формирование аневризм желудочков (10 %) вследствие гранулематозного повреждения либо фиброзных изменений на фоне длительного применения глюкокортикостероидов (ГКС).
ТРУДНЫЕ ПУТИ ДИАГНОСТИКИ…
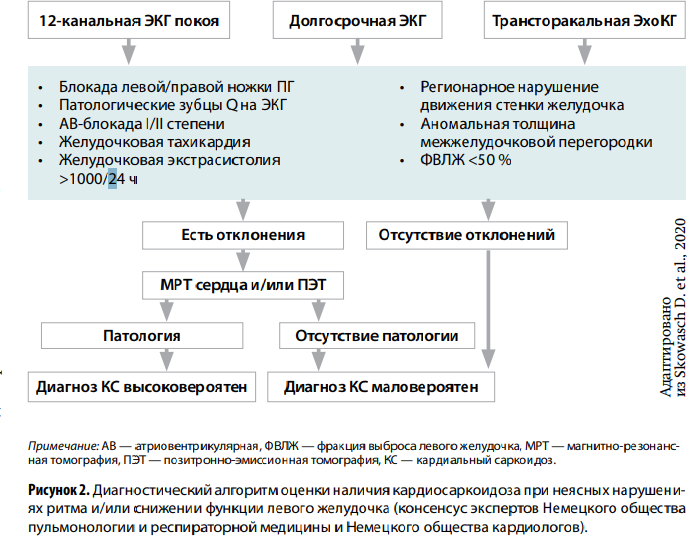
Постановка диагноза кардиосаркоидоза должна опираться на результаты инструментальных исследований, а при возможности— также и биопсии. На сегодняшний день не выявлено специфичных для КС лабораторных критериев. Вместе с тем, по данным доступной литературы, у 30–80 % больных с КС повышено содержание сывороточного ангиотензинпревращающего фермента (АПФ), вырабатываемого активированными макрофагами. Его уровень находится в корреляции с гранулематозной нагрузкой, однако специфичность и чувствительность этого показателя недостаточны. В качестве индикатора активности болезни можно рассматривать уровень растворимого рецептора интерлейкина 2, но он также характеризуется низкой специфичностью: повышенные значения маркера регистрируются наряду с саркоидозом при других гранулематозных процессах. В настоящее время продолжается поиск КС-специфичных биомаркеров, при этом одним из перспективных считается сывороточная хитотриосидаза (CHIT1). Концентрация ее также хорошо коррелирует с активностью и тяжестью заболевания, выраженностью мультиорганной диссеминации и обладает относительно более высокими чувствительностью/специфичностью. Кроме того, у страдающих саркоидозом о поражении сердца могут свидетельствовать повышение содержания тропонинов и/или мозгового натрийуретического пептида (BNP)/Nконцевого прогормона (предшественника) мозгового натрийуретического пептида NT-proBNP.
Чувствительность электрокардиографического (ЭКГ) метода в диагностике КС варьирует от 33 до 58 %, а специфичность— от 22 до 71 %. При ЭКГ-исследовании (включая суточное/многосуточное мониторирование) часто регистрируются АВ-блокады высокой степени, блокады ножек пучка Гиса, фрагментация комплекса QRS, желудочковые аритмии. Возможное свиде тельство в пользу КС — наличие необъяснимых патологических зубцов Q в ≥2 отведениях. Эпизоды желудочковой тахикардии считаются фактором риска неблагоприятного исхода.
Роль эхокардиографического (ЭхоКГ) исследования в верификации заболевания также ограничена в силу отсутствия патогномоничных для этой нозологической формы признаков. Изменения при ЭхоКГ регистрируются у 24–77 % пациентов.
Возможны следующие эхопризнаки:
• на ранних стадиях (при инфильтративном процессе) — патологическое утолщение (>13 мм) либо на поздних стадиях (при фиброзировании)—истончение (<7 мм) МЖП;
• дилатация и систолическая/диастолическая дисфункция ЛЖ, редко ПЖ;
• регионарная гипокинезия стенок ЛЖ, не соответствующая зонам кровоснабжения его миокарда;
• аневризма ЛЖ;
• дисфункция папиллярных мышц и недостаточность митрального и/или трикуспидального клапанов;
• локальные внутрисердечные образования — крупные гранулемы;
• выпот в перикардиальной полости;
• снижение глобальной продольной диссоциации;
• равномерное утолщение эндокарда предсердий.
Важно подчеркнуть, что к наиболее неблагоприятным прогностическим признакам относятся значительная дилатация ЛЖ и снижение его фракции выброса <40 %.
Высокоинформативные диагностические методы — магнитно-резонансная томография (МРТ) сердца с отсроченным контрастированием диэтилпентаацетатом гадолиния (Gd) и позитронно-эмиссионная томография с 18F-фтордезоксиглюкозой (18F-ФДГ-ПЭТ). Современные МР-технологии дают возможность точно оценить анатомию и функцию органа, позволяя—что более важно—выявить даже незначительные структурные изменения миокарда, свидетельствующие в пользу воспаления и/или фиброза. У пациентов с КС часто наблюдаются дилатация камер сердца, истончение МЖП, аневризмы. Острый воспалительный процесс в миокарде и отек ткани характеризуются повышением интенсивности сигнала в Т2‑взвешенном режиме и ранним накоплением гадолиния. Позднее его накопление в миокарде/эпикарде и регионарное нарушение подвижности стенок свидетельствуют о фиброзировании (рис. 1).
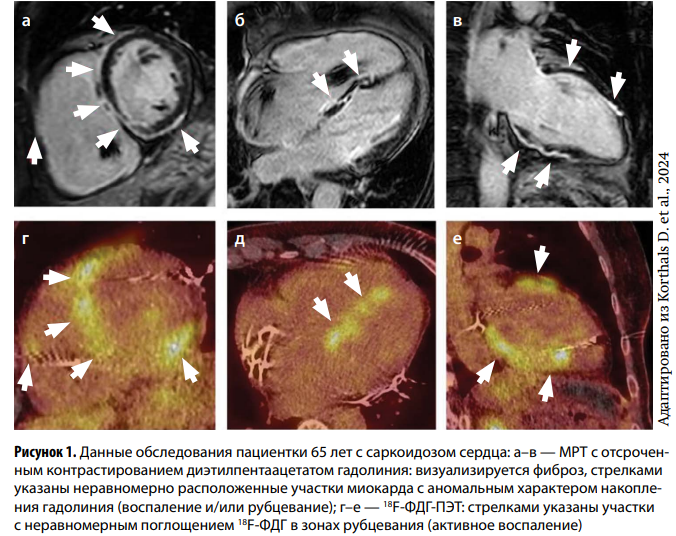
По данным метаанализа 13 исследований (1318 пациентов), у больных с СС, имевших позднее накопление гадолиния в миокарде при МРТ, вероятность желудочковых аритмий в 20 раз превышала таковую среди лиц без этого признака. Диагностическая чувствительность метода составляет 75–100 %, специфичность—76–100 %. Результаты МРТ могут, кроме того, использоваться при проведении целенаправленной эндомиокардиальной биопсии (ЭМБ).
18F-ФДГ-ПЭТ представляет собой функциональную методику с использованием в качестве заменителя глюкозы 18F-ФДГ, активно поглощаемой воспалительными клетками (макрофагами, Т-лимфоцитами). Накопление радиофармпрепарата (РФП) при КС может быть очаговым, диффузным или «пятнистым», с нарушениями перфузии или без них—в зависимости от присутствия воспаления или фиброзирования. Поскольку здоровый миокард также способен активно поглощать 18F-ФДГ, решающее значение при проведении ПЭТ имеет правильная подготовка пациента к исследованию. Чтобы исключить физиологическую аккумуляцию РФП в миокарде, за сутки до процедуры рекомендуется соблюдение строгой безуглеводной, богатой белками и жирами диеты. Чувствительность метода оценивается в 89 %, специфичность—в 78 %. В ряде исследований показано, что сочетание патологического накопления 18F-ФДГ с дефектом перфузии в покое ассоциируется с высоким риском неблагоприятных сердечно-сосудистых событий. Существенное преимущество метода—возможность визуализации воспалительных изменений не только в сердце, но и в других органах, что особенно важно при выявлении экстракардиальных саркоидных поражений. Как и МРТ, 18F-ФДГ-ПЭТ выступает важным инструментом в мониторинге эффективности терапии.
Таким образом, МРТ наряду с 18F-ФДГПЭТ являются неотъемлемой частью обследования пациентов с КС. Эти опции следует рассматривать и применять как взаимодополняющие. 18F-ФДГ-ПЭТ лучше выявляет активность воспалительной фазы, тогда как МРТ более отчетливо идентифицирует хроническую (фиброзную) стадию при позднем накоплении гадолиния в миокарде.
На рис. 2 представлен один из диагностических алгоритмов в отношении КС.
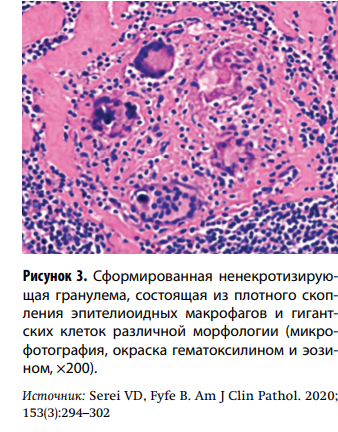 Патогистологическое исследование может дать морфологическое подтверждение диагноза КС. В случаях экстракардиального саркоидоза рекомендуется проводить биопсию лимфатических узлов или легочной ткани, обладающую более по сравнению с ЭМБ (25–36 %) чувствительностью. Если же имеется изолированное поражение сердца, то целесообразна ЭМБ после получения результатов МРТ и/или ПЭТ, что значительно увеличивает чувствительность метода (до 50 %). Типичная саркоидная гранулема выглядит как плотное скопление эпителиоидных макрофагов удлиненной формы с мелкогранулированной цитоплазмой и овоидным ядром (рис. 3).
Патогистологическое исследование может дать морфологическое подтверждение диагноза КС. В случаях экстракардиального саркоидоза рекомендуется проводить биопсию лимфатических узлов или легочной ткани, обладающую более по сравнению с ЭМБ (25–36 %) чувствительностью. Если же имеется изолированное поражение сердца, то целесообразна ЭМБ после получения результатов МРТ и/или ПЭТ, что значительно увеличивает чувствительность метода (до 50 %). Типичная саркоидная гранулема выглядит как плотное скопление эпителиоидных макрофагов удлиненной формы с мелкогранулированной цитоплазмой и овоидным ядром (рис. 3).
Тем не менее ряд причин ограничивают информативность морфологической диагностики. Как известно, образцы для биопсии обычно получают из ПЖ, который при КС поражается редко. Кроме того, не всегда удается обнаружить саркоидные гранулемы ввиду их неравномерного распределения. Иногда немалые трудности представляет дифференциальная диагностика, в частности с гигантоклеточным миокардитом.
Как можно видеть прижизненная верификация КС — весьма сложная задача, требующая многостороннего подхода. Принято выделять два основных диагностических пути: гистологический и клинический. Первый разработан экспертами Общества специалистов по нарушениям ритма сердца (HRS) и руководством Всемирной ассоциации по саркоидозу и другим гранулематозным заболеваниям легких (WASOG). Клинический путь базируется на материалах Министерства здравоохранения, труда и благосостояния Японии, пересмотренных двумя национальными медицинскими организациями этой страны: обществом кровообращения (JCS) и обществом по изучению саркоидоза и других гранулематозных болезней (JSSOG). Необходимо, однако, помнить, что все используемые в настоящее время диагностические критерии в той или иной степени несовершенны.
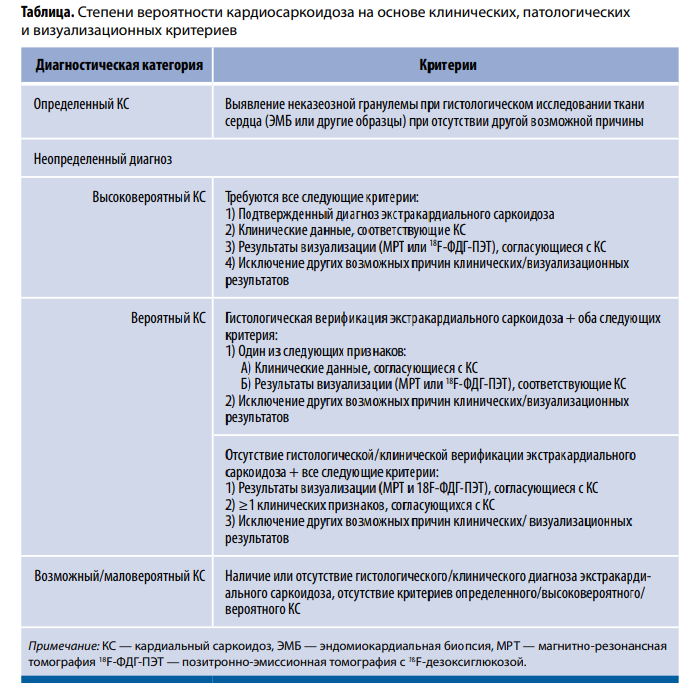
В таблице суммирована вероятность наличия КС на основании совокупности различных диагностических критериев.
…И ЛЕЧЕНИЯ
Лечение КС по сложности не уступает диагностике. Оно включает назначение иммуносупрессивной терапии, борьбу с СН, коррекцию аритмий. Применяют препараты различных классов: ГКС (преднизолон, дексаметазон), иммунодепрессанты (метотрексат, гидроксихлорохин), лефлуномид, микофенолат мофетил, адалимумаб, инфликсимаб, нинтеданиб. Стойкие нарушения ритма служат показанием к установке пейсмейкеров, имплантируемых кардиовертеров-дефибрилляторов (ИКД). Рефрактерная СН (в том числе не корригируемая посредством вспомогательных устройств ЛЖ (LVAD)) диктует необходимость решения вопроса о трансплантации сердца или комплекса сердце–легкие. Больные КС нуждаются в наблюдении мультидисциплинарной врачебной командой, включающей кардиологов, пульмонологов, фтизиатров с привлечением в случае необходимости специалистов по внелегочному туберкулезу и представителей других медицинских направлений.
***
Саркоидоз сердца до сих пор во многом остается «темной материей» кардиологии. Скрининг на КС должен проводиться всем пациентам с экстракардиальным поражением независимо от наличия клинических симптомов. Оптимизация стратификации риска, установление надежных диагностических критериев и выявление высокоспецифичных маркеров возможны в ходе крупных многоцентровых исследований.

















