Статьи
Стереотаксическая радиохирургия при онкозаболеваниях предстательной железы: современный инструмент для потенциально излечимой патологии
На протяжении двух последних десятилетий содержание лучевой терапии (ЛТ) как лечебного метода существенно изменилось. Значительно расширился спектр показаний к нему; стал возможным контроль лечения в реальном времени. Особое место принадлежит уникальной разновидности лучевой методики — стереотаксической радиохирургии (СРХ), занявшей отдельную нишу в лечении онкопатологии предстательной железы (ПЖ). Сочетание высокоточных дозиметрических расчетов, гибких совершенствующихся технологий, глубокого понимания радиобиологии и прогрессивно накапливающегося опыта позволяет называть специалистов по радиохирургии опухолей ПЖ радиационными онкохирургами — «хирургами без ножа».
Согласно статистическим данным, в РФ за последние 10 лет у мужчин на фоне снижения смертности от всех злокачественных новообразований отмечается ее рост, ассоциированный с рядом локализаций, включая поражение ПЖ—только в 2021 г. он составил 1,4 % [Каприн А.Д. и соавт., 2022]. В ряде же других государств, например США, обусловленная раком предстательной железы (РПЖ) смертность, наоборот, снижается, что связано прежде всего с внедрением скрининга на простатспецифический антиген (ПСА) и усовершенствованием лечения [Howlader N. и соавт., 2016], в том числе за счет прогресса в лучевой терапии (ЛТ) [Michalski J.M. и соавт., 2014].
В России и ряде других стран, где традиционно большое внимание уделяется хирургии как главной опции лечения неметастатического локализованного и местнораспространенного РПЖ, в клиническую практику все шире входят новые методики и технологии. Инвалидизирующие операции с длительной послеоперационной реабилитацией постепенно сменяются лапароскопическими робот-ассистированными вмешательствами с минимальным периодом восстановления. Длительные курсы двухмерной (2D) конвенциальной/конформной фракционной ЛТ также претерпели эволюцию, усовершенствовавшись до 5–7-дневных курсов стереотаксической радиохирургии (СРХ) (stereotactic body radiation therapy, SBRT). Онкологическая часть у вмешательств схожа; различия заключаются в функциональной составляющей — частоте и выраженности недержания мочи, эректильной дисфункции (ЭД) и иных нежелательных явлений (НЯ). Задача представленного материала — рассказать врачам об особенностях и перспективах такой терапевтической стратегии, какой является СРХ.
Преимущества стереотаксической радиохирургии
При РПЖ наряду с длительными (39– 42 сеанса) курсами конформной фракционной ЛТ применяются и более короткие курсы гипо- и ультрагипофракционного лечения. Последний вариант как раз и представляет собой СРХ, при которой лечебное воздействие реализуется за 5–7 процедур.
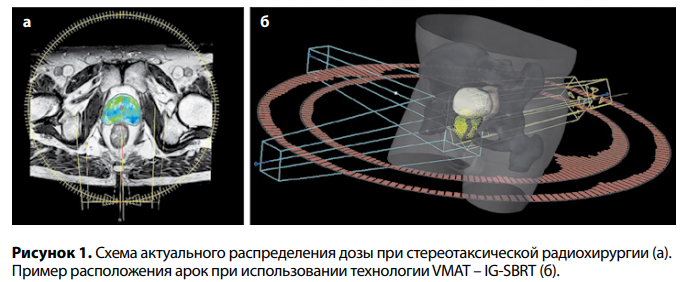
СРХ — это прецизионный дистанционный способ доставки высоких доз ионизирующего излучения к ограниченному объему опухоли (мишени) c минимальным повреждением окружающих тканей. Радиохирургическая процедура проводится по методике RapidArc, или VMAT (volumetric modulated arc therapy — ротационное объемно-модулированное облучение) под контролем рентгеновской визуализации положения мишени и органов риска на 6D радиотерапевтическом столе в режиме реального времени (imageguided stereotactic body radiation therapy, IG-SBRT) (рис. 1 а, б).
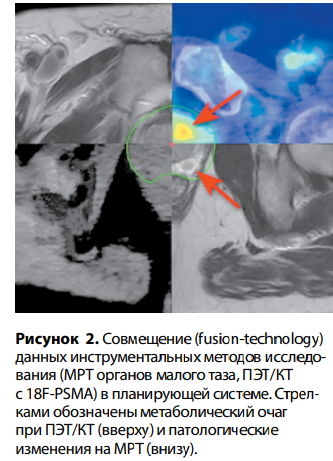 Использование совмещения изображений (fusion-technology) позволяет одномоментно визуализировать патологические изменения по данным магнитно-резонансной томографии (МРТ) и метаболический объем опухоли при позитронноэмиссионной томографии (ПЭТ) (18F-PSMA) с компьютерной томографией (КТ) высокого разрешения — ПЭТ-КТ в планирующей системе для радиохирургии (рис. 2).
Использование совмещения изображений (fusion-technology) позволяет одномоментно визуализировать патологические изменения по данным магнитно-резонансной томографии (МРТ) и метаболический объем опухоли при позитронноэмиссионной томографии (ПЭТ) (18F-PSMA) с компьютерной томографией (КТ) высокого разрешения — ПЭТ-КТ в планирующей системе для радиохирургии (рис. 2).
Цели и задачи
Главная цель СРХ — подведение к опухоли радикальной дозы облучения за минимальное количество сеансов. Коморбидное состояние, которое может служить противопоказанием для традиционной хирургии, не является ограничением к проведению СРХ. В каждом случае подбирается индивидуальный режим фракционирования, который зависит от стадии болезни и группы риска, фонового состояния больного, объема ПЖ и близости расположения здоровых органов. Такое лечение заканчивается безболезненно за 4–7 дней и может быть проведено амбулаторно, не вызывая снижения качества жизни и негативного влияния на повседневную активность. Пациент может находиться дома, в окружении семьи, продолжать работать. При этом полностью сохраняется целостность ПЖ и мочевыводящих путей на всем протяжении.
Контроль качества лечения непосредственно в режиме реального времени — один из приоритетов адаптивной ЛТ под визуальным контролем (image-guided radiation therapy, IGRT). Начало каждой радиохирургической процедуры сопровождается выполнением низкодозной КТ в коническом пучке (cone beam computed tomography, CBCT) для визуализации не только мишени и близлежащих органов, но и амплитуды движения данных структур. Даже субмиллиметровое смещение корректируется 6D лечебным столом и контролируется на протяжении всего терапевтического сеанса.
Прецизионной методике — современное оснащение и профессионализм
Для СРХ требуется соответствующее оборудование, которое тоже постоянно совершенствуется. В аппараты ЛТ современного поколения встроены ультратонкие мультилепестковые коллиматоры, с помощью которых создается высококонформное распределение дозы, максимально приближенное к форме (конфигурации) опухоли. Новые технологии позволяют практически полностью минимизировать побочные эффекты, предохранить окружающие мишень нормальные органы и ткани от лучевого воздействия за счет точности в подведении дозы и позиционировании пациента. Наряду с этим достигается снижение количества фракций и увеличение однократной дозы облучения. На сегодняшний день SBRT по методике VMAT представляет собой наиболее современный метод доставки ионизирующего излучения с лучшими показателями распределения предписанной дозы в мишени [Hodges J.C. и соавт., 2021].
Важной составляющей терапевтического результата является использование передовых физических моделей при дозиметрическом планировании с индивидуальным подбором радикальной дозы в зависимости от объема лечения. Наряду с этим процесс и результат рассматриваемого вмешательства, безусловно, зависят от опыта радиационного онколога (радиохирурга) и уровня технического обеспечения, т. е. оснащенности медицинского учреждения. Эти же факторы определяют и частоту возникновения осложнений.
Несмотря на кажущуюся простоту лечебной тактики, каждый клинический случай должен обсуждаться коллегиально — командой во главе с ведущим урологом-хирургом, радиационным онкологом, специализирующимся на радиохирургии ПЖ и знающим нюансы ее проведения, а также клиническим онкологом. Только так может быть выбран правильный прецизионный алгоритм действий для конкретного пациента.
До недавнего времени исследования показывали одинаковый уровень 5-летнего безрецидивного контроля опухоли как при оперативном лечении, так и в случае традиционной конвенциальной ЛТ, равный 81 % в группах низкого и промежуточного риска заболевания. Различие заключалось лишь в том, что в первом случае прогнозируемый риск осложнений в виде недержания мочи и ЭД составлял 13 %, а при ЛТ вероятность возникновения побочных реакций со стороны мочевого пузыря и прямой кишки была равна 5 %. При высоком же риске заболевания комбинация лучевой и гормональной терапии имела ряд преимуществ перед хирургической тактикой.
Революционный прорыв в технологических возможностях (включая визуализацию мишени) и физическом планировании лечения, реализованный группой радиоонкологов из ведущих мировых центров (Memorial Sloan Kettering Cancer Center, MD Anderson Cancer Center), имел одним из результатов значительное повышение показателя 5-летнего безрецидивного контроля заболевания при локализованном поражении до 95–98 % за последние 10 лет. При этом вероятность побочных эффектов (в т.ч. лучевого цистита) удалось снизить до 2 %. Следует отметить, что несмотря на незначительную вероятность НЯ, важным аспектом остается сохранение сексуальной функции. Лишь у 20 % пациентов она может снижаться от исходно хороших показателей на протяжении 2 лет после SBRT, никогда не достигая полного отсутствия либидо.
Кроме того, на сегодняшний день экспертной онкологической группой (NCCN Guidelines) разрешено применение SBRT даже при высоком и очень высоком риске заболевания. В этой связи ряд радиационных онкологов, включая автора этого материала, считают, что достигнутый высокий уровень эффективности актуальной радиохирургии в перспективе может позволить полностью отказаться от гормонотерапии даже при промежуточном и высоком риске.
Может возникнуть вопрос: возможно ли использовать радиохирургию при вовлечении в опухолевый процесс регионарных лимфатических узлов? Безусловно, да — и не только при регионарном, но и при отдаленном поражении как лимфоузлов, так и экстралимфатических очагов. При современных возможностях радиохирургии практически нет локализаций и областей, к которым нельзя было бы подвести пучок ионизирующего излучения.
Наконец, нередко встречаются указания на различного рода сложности при проведении оперативного вмешательства после ЛТ. Радиохирурги же располагают уникальной возможностьюспасения (salvage) пациентов методом СРХ после неудачной операции.
Перспективы
SBRT — динамически развивающееся направление. У радиационных онкологов сегодня уже нет сомнений, что метод радиохирургии в монорежиме абсолютно безопасен для пациентов с РПЖ низкого и промежуточного риска болезни. Это подтверждается достаточным количеством ретроспективных исследований [Tree A.C. и соавт., 2022; Wang K. и соавт., 2020; King C.R. и соавт., 2013].
Традиционный подход, заключающийся в подведении высоких доз ионизирующего излучения к ПЖ за короткий промежуток времени (брахитерапия), сегодня может быть полностью замещен высокотехнологичной SBRT, что показано в ретроспективном анализе на материале 803 пациентов [Evans J.R. и соавт., 2015]. В этой работе продемонстрировано превосходство SBRT над брахитерапией в эффективности при меньшей частоте НЯ.
Ряд специалистов, среди которых не только радиоонкологи, уже сейчас в полной мере осознают перспективы данного направления. Остается закономерный вопрос: нужно ли тратить время на доказательство очевидности того, что радиохирургия — это практически идеальный метод лечения онкопатологии ПЖ? Возможно, у некоторых коллег закономерно сохраняется доля скепсиса, связанного с необходимостью проведения проспективных исследований. Они, безусловно, нужны, но в большей степени для документирования и подтверждения эффективности методики. Продолжение их необходимо, чтобы, во-первых, полностью избавиться от сомнений среди онкологов и урологов-хирургов относительно результативности этого терапевтического направления; во-вторых, еще больше повысить качество лечения и убрать барьеры на пути использования SBRT; и наконец, в-третьих, осуществить ее повсеместное распространение и применение.
Наиболее перспективным в указанном направлении является исследование Prostate Advances in Comparative Evidence (PACE), в котором проводится сравнительный анализ эффективности СРХ, простатэктомии и классической фракционной ЛТ длительным курсом при РПЖ. Окончательные результаты протокола ожидаются в сентябре 2026 г., однако на основании уже имеющихся заключений можно утверждать, что рассматриваемый метод эффективен, безопасен и имеет низкую частоту побочных эффектов.
Собственный опыт
В силу ряда причин далеко не каждое медицинское учреждение располагает необходимыми условиями для выполнения тех или иных лучевых методик, включая радиохирургию. К сожалению, смысл и сущность ЛТ и тем более ее специализированного ответвления — радиохирургии недостаточно известны врачам других специальностей. Поэтому лучевое лечение РПЖ в целом и СРХ в частности применяется неоправданно редко — до сих пор проведение SBRT осуществляется в единичных крупных медицинских центрах и в рамках клинических испытаний.
Институт онкологии EMC — одно из немногих не только в России, но и в мире учреждений, которое активно вводит данный метод в клиническую практику и успешно излечивает многих пациентов. В ЕМС реализуются наиболее передовые методы визуализации опухолевой мишени и планирования СРХ ПЖ. Это стало возможным благодаря наличию современного высокоточного оборудования — линейного ускорителя Varian EDGE Radiosurgery system — и, конечно, специально обученного высококвалифицированного персонала.
Сегодня Институт онкологии EMC в сотрудничестве с Российской медицинской академией непрерывного профессионального образования (РМАНПО) является не только лечебным учреждением, но и учебной и научно-исследовательской базой. К настоящему времени в центре пролечено около 100 пациентов с локализованными стадиями РПЖ. Безрецидивная 5-летняя выживаемость достигает 96,6 %, при этом постлучевые осложнения 3–4 степени по критериям оценки тяжести НЯ (CTCAE) регистрируются у <2 % пациентов. Данные обновляются ежегодно; последнее обновление с представлением окончательных результатов ожидается в следующем, 2024 году на очередном съезде Американского общества клинической онкологии (ASCO) в Чикаго. Кроме того, в ближайшее время планируется публикация в одном из международных научных изданий, посвященная нашему 8-летнему опыту применения СРХ на базе EMC.
Список литературы находится в редакции

















