Статьи
Вчера – наука, сегодня – клиническая практика: HR+ HER2- мРМЖ
Фармацевтическая компания «Новартис» представила на петербуржском международном онкологическом форуме «Белые ночи» сателлитный симпозиум, посвященный терапии люминального HER2-негативного метастатического рака молочной железы (HR+ HER2- мРМЖ). Приглашенные из-за рубежа и российские эксперты обсудили результаты исследований рибоциклиба и алпелисиба, а также поделились собственным опытом применения этих препаратов.
ТРАНСФОРМАЦИЯ ЦЕЛЕЙ
Открыл симпозиум заведующий онкологическим дневным стационаром (химиотерапевтического и хирургического лечения) ФГБУ «НМИЦ онкологии им. Н.Н. Блохина», д. м. н., профессор Антон Владимирович Снеговой докладом на тему «Трансформация целей терапии метастатического РМЖ: увеличение общей выживаемости».
Метастатический РМЖ (мРМЖ) остается неизлечимым заболеванием, а его терапия направлена на увеличение продолжительности и улучшение качества жизни пациентов. Во многих клинических исследованиях используют суррогатные конечные точки оценки клинической эффективности новых терапевтических опций, такие как, например, выживаемость без прогрессирования (ВБП). При этом важно понимать, что суррогатные конечные точки не всегда коррелируют с показателем общей выживаемости (ОВ) и не могут служить ему заменой. Антон Владимирович отметил, что «золотым стандартом» измерения клинической пользы в аспекте увеличения продолжительности жизни остается статистически значимое улучшение ОВ, которая должна быть главным оцениваемым показателем в рандомизированных контролируемых исследованиях (РКИ) III фазы.
Ответ на вопрос, приводит ли добавление ингибиторов CDK 4 / 6 к гормонотерапии к увеличению ОВ, дал представленный на конгрессе ASCO-2020 метаанализ 8 РКИ1. В него вошли данные по 4338 пациенткам с HR+ HER2- мРМЖ из исследований по палбоциклибу (PALOMA-1,2,3), абемациклибу (MONARCH-2,3) и рибоциклибу (MONALEESA-2,7). Объединенный анализ подтвердил не только обнаруженное ранее увеличение ВБП (ОР = 0,55, 95 % ДИ, 0,50–0,59; p <0,00001) при применении комбинации ингибиторов CDK 4 / 6 и гормонотерапии, но и значимое преимущество в отношении ОВ (ОР = 0,75, 95 % ДИ, 0,68–0,84; p <0,00001).
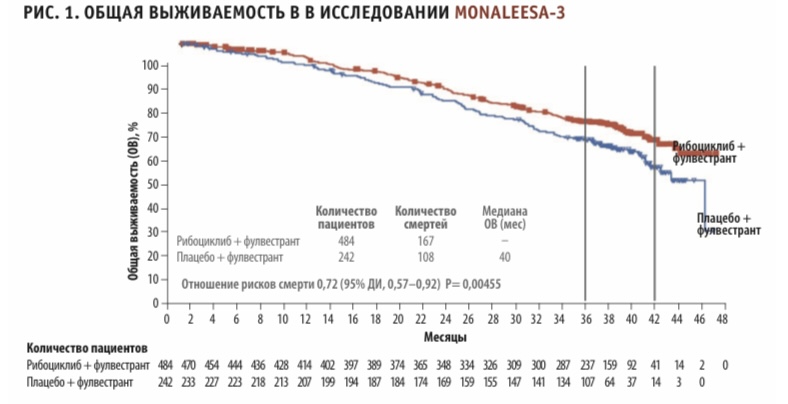
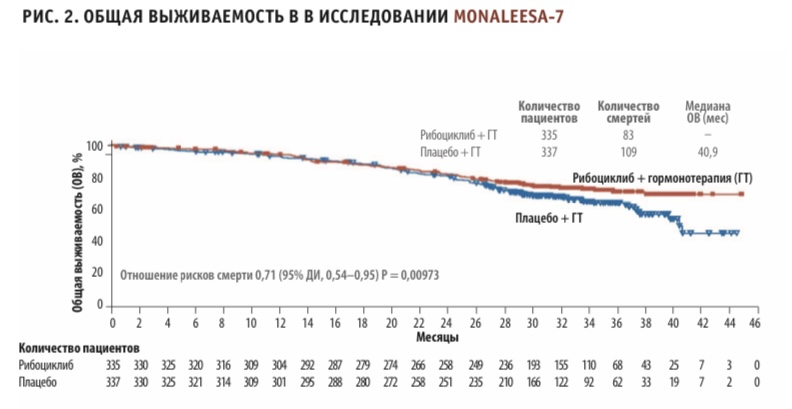
При этом непосредственно по результатам отдельных РКИ среди трех препаратов из данной группы только рибоциклиб уже дважды продемонстрировал статистически значимое увеличение ОВ в первой линии терапии HR+ HER2- мРМЖ в комбинации с ингибитором ароматазы и фулвестрантом, о чем говорят результаты исследований MONALEESA-3 и MONALEESA-72,3. На момент последнего анализа данных медиана общей выживаемости в группе рибоциклиба в исследовании MONALEESA-3 еще не была достигнута (то есть более 50 % пациентов были еще живы), в то время как в группе плацебо медиана общей выживаемости составила 40 месяцев. Снижение относительного риска смерти при применении рибоциклиба составило 28 % (ОР = 0,72, 95 % ДИ, 0,57–0,92; р = 0,00455). Результаты исследования MONALEESA-7 показали, что добавление рибоциклиба к эндокринной терапии (ЭТ) приводило к значительному увеличению ОВ в сравнении с одной лишь ЭТ. Через 42 месяца расчетные показатели ОВ составили 70 % в группе «рибоциклиб + нестероидный ингибитор ароматазы» и 43 % в группе плацебо.
Также Антон Владимирович представил результаты подгруппового анализа указанных выше исследований (М-3,7), продемонстрировавших, что и у пациенток с метастатическим поражением печени (фактор неблагоприятного прогноза) комбинированная терапия с применением рибоциклиба показала снижение относительного риска смерти: на 47 % в исследовании MONALEESA-7 и на 37 % — в исследовании MONALEESA-3. Данные этого подгруппового анализа были представлены в конце мая 2020 года на конгрессе ASCO.
ДИСТАНЦИОННЫЙ МОНИТОРИНГ
Приглашенный спикер — профессор Надя Харбек, руководитель центра молочной железы, отдела онкологической терапии и клинических исследований, заведующая кафедрой консервативной онкологии департамента акушерства и гинекологии Мюнхенского университета — сообщила, что свыше 70 % пациентов с HR+ HER2- мРМЖ в Германии получают ингибиторы CDK 4 / 6 в рамках первой линии терапии. К неоспоримым преимуществам такого подхода относятся выигрыш в показателях выживаемости по сравнению с моноэндокринотерапией, высокая частота и скорость развития объективного ответа, максимальная отсрочка назначения более токсичного химиотерапевтического лечения. Эффективность, удобство применения, а также управляемый профиль токсичности позволяют поддерживать качество жизни пациентов на высоком уровне.
В качестве стандартной практики мониторинга нежелательных явлений (НЯ) в Германии используются системы оценки пациентами проводимого лечения (PROMs). Эти опросники, в том числе электронные, направлены на выявление симптомов заболевания и НЯ на фоне лечения. Например, цифровой дневник Cankado можно вести со смартфона. Это облегчает коммуникацию между пациентом и медперсоналом и оценку приверженности больных к лечению, что особенно актуально в условиях пандемии COVID-19, требующих минимизации посещения пациентами лечебных учреждений. Доступна также прогрессивная опция дистанционной регистрации ЭКГ с использованием телекардиологической технологии AliveCor KardiaMobile в сочетании с дневником Cankado. Возможность удаленного мониторинга НЯ позволяет выявлять их в максимально ранние сроки и своевременно модифицировать лечение.
СЛУЧАЙ ИЗ ПРАКТИКИ
В ответ немецкой коллеге собственный опыт использования ингибиторов CDK 4 / 6 в первой линии терапии HR+ HER2- мРМЖ представила профессор кафедры онкологии и паллиативной медицины ФГБОУ ДПО РМАНПО, д. м. н. Ирина Владимировна Колядина.
В качестве показательного примера эффективности терапии рибоциклибом в комбинации с ингибитором ароматазы летрозолом у больных HR+ HER2- мРМЖ в постменопаузе был представлен клинический случай пациентки 62 лет с диагнозом «Рак левой молочной железы T2N3M0, люминальный В, HER2-негативный подтип». В 2015 г. проведено комплексное лечение по поводу локализованной болезни (неоадъювантная химиотерапия, радикальная мастэктомия, лучевая терапия и адъювантная гормонотерапия тамоксифеном). Однако спустя 3 года, в сентябре 2018-го, пациентка предъявила жалобы на боли в пояснице, левой надключичной области и кашель при физической нагрузке. Выявлено прогрессирование заболевания в виде метастатического поражения легких, плевры, надключичного лимфоузла слева, а также литических метастазов в грудных и поясничных позвонках. Первым этапом была выполнена вертебропластика для профилактики патологических переломов пораженных позвонков, после чего встал вопрос о выборе системной противоопухолевой терапии. Как уже было сказано, основные цели лечения при мРМЖ состоят в увеличении продолжительности и улучшении качества жизни пациенток. Кроме того, болевой синдром и значительная распространенность болезни у данной пациентки требовали быстрой реализации противоопухолевого ответа для купирования клинических симптомов. В наибольшей степени данным целям соответствует комбинированная гормонотерапия с ингибитором CDK 4 / 6, что и продемонстрировано в исследовании MONALEESA-2 для комбинации летрозола с рибоциклибом4,5,6.
В этом РКИ III фазы изучались эффективность и безопасность комбинации «летрозол + рибоциклиб» против «плацебо + рибоциклиб» в терапии постменопаузальных больных с HR+ HER2- мРМЖ. По результатам длительного наблюдения, медиана которого составила 26,4 месяца, добавление рибоциклиба к терапии летрозолом позволило значительно увеличить медиану ВБП: до 25,3 мес (95 % ДИ, 23,0–30,3) по сравнению с 16,0 мес (95 % ДИ, 13,4–18,2) в контрольной группе (ОР = 0,568, 95 % ДИ, 0,457–0,704; log-rank P = 9,63 × 10–8). Выигрыш от добавления рибоциклиба наблюдался во всех подгруппах пациенток, независимо от наличия мутации в генах PIK3CA или TP53, экспрессии Rb, Ki67 или белка p16, уровня CDKN2A, CCND1 или ESR1. Частота объективного ответа для всех пациентов составила 42,5 % в группе рибоциклиба с летрозолом против 28,7 % в группе плацебо с летрозолом и 54,5 % против 38,8 % соответственно среди пациентов с измеряемой болезнью. Обращает на себя внимание быстрое развитие противоопухолевого ответа: объективный ответ на терапию (уменьшение опухоли у 76 % пациенток) был зарегистрирован уже при первом контрольном исследовании через 8 недель от начала лечения. Кроме того, в группе комбинированной терапии в течение уже первых 8 недель лечения зафиксировано уменьшение болевого синдрома (БС): медиана его уменьшения по системе EORTC QLQ-C30 составила –40 % против –29 % в контрольной группе, а среднее изменение БС по системе EORTC QLQ-C30 у пациентов с измеряемыми очагами, достигших клинического эффекта, оказалось равно –7,0 против –1,3 соответственно.
Пациентка начала применение данной комбинации в рамках расширенного доступа. Клинически отмечалось купирование болей в костях, надключичной области и разрешение кашля. Частичный ответ в виде уменьшения размеров надключичного лимфоузла и очагов в легких был зафиксирован уже через 2 месяца терапии. Сейчас после 18 месяцев лечения у пациентки достигнут и сохраняется полный клинико-рентгенологический ответ (по очагам в костях наблюдается нарастание склеротического компонента), при этом прекрасной остается и переносимость терапии, что позволяет поддерживать высокое качество жизни.
ГЕНЕТИЧЕСКИЕ АСПЕКТЫ
Несмотря на высокую эффективность ЭТ в сочетании ингибиторами CDK 4 / 6, рано или поздно у больных развивается резистентность к проводимому лечению. У пациенток с признаками гормонорезистентности мишенью для терапии может стать фосфатидилинозитол-3-киназа (PI3K) — белок, который играет ключевую роль в патогенезе мРМЖ у больных с мутацией гена PIK3CA. О роли PI3K в патогенезе РМЖ и об особенностях течения заболевания у пациенток с мутацией гена PIK3CA рассказал сотрудник онкологического отделения госпиталя Тенон, профессор Парижского университета Джозеф Глигоров.
Мутация в гене PIK3CA приводит к гиперактивации PI3K, которая постоянно стимулирует раковые клетки к делению и обуславливает эстроген-независимый рост опухоли7. Данная драйверная в патогенезе РМЖ мутация обнаруживается в первичной опухоли уже на ранних стадиях заболевания и сохраняется в очагах метастазирования. Выявление мутации — фактор неблагоприятного прогноза, ассоциированный со снижением эффективности всех существующих видов терапии и с уменьшением продолжительности жизни пациентов8. Долгое время не удавалось разработать ингибитор PI3K, поскольку эта киназа играет важную роль в регуляции жизнеспособности всех клеток и ее блокада сопровождается высоким уровнем токсичности. Алпелисиб стал первым и единственным препаратом, способным блокировать PI3K и останавливать рост опухоли, обладая при этом приемлемым профилем переносимости9. Высокая частота мутации в гене PIK3CA, ее ассоциация с резистентностью к ЭТ, а также наличие селективного ингиби-ора PI3K, который может быть назначен при ее выявлении, обуславливают необходимость тестирования всех пациенток с HR+ РМЖ на наличие данной мутации.
К счастью, арсенал противоопухолевой терапии HR+ HER2- мРМЖ при наличии мутации в гене PIK3CA пополнился эффективной таргетной опцией — ингибитором PI3K. На конгрессе ASCO-2019 были представлены результаты исследования SOLAR-1, которое стало для алпелисиба регистрационным9. Заместитель директора по онкологии ГБУЗ «МКНЦ им. А.С. Логинова ДЗ Москвы» профессор Людмила Григорьевна Жукова рассказала о вдохновляющих результатах SOLAR-1. В нем изучалась эффективность комбинации специфического ингибитора альфа-субъединицы PI3K алпелисиба с фулвестрантом по сравнению с монотерапией фулвестрантом в лечении HR+ HER2- мРМЖ в зависимости от наличия мутации в гене PIK3CA, линии терапии и наличия признаков эндокринорезистентности. Конечной точкой в исследовании была ВБП в группе пациентов с мутацией в гене PIK3CA. В SOLAR-1 включали пациенток, получавших предшествующую ЭТ (в том числе ингибиторами CDK 4/6 у части больных), при этом большая часть пациенток демонстрировали признаки вторичной гормонорезистентности. Более чем у половины больных на момент включения в исследование имелись висцеральные метастазы. В исследовании участвовали 572 пациентки, разделенные на 2 группы в зависимости от наличия мутации в гене PIK3CA. Участницы из каждой группы были затем рандомизированно распределены на 2 рукава: терапии «фулвестрант + алпелисиб» и «фулвестрант + плацебо».
Первый же анализ ВБП продемонстрировал, что пациентки без мутации в гене PIK3CA не выигрывают от добавления алпелисиба к терапии фулвестрантом, поэтому данная подгруппа была исключена из последующих анализов. В популяции пациенток с доказанной мутацией в гене PIK3CA добавление алпелисиба к фулвестранту в первой линии терапии позволило снизить относительный риск прогрессирования болезни на 35 % и существенно увеличить медиану ВБП (5,7 мес против 11,0 мес, ОР = 0,65; 95 % ДИ, 0,50–0,85; p <0,001). Подгрупповой анализ показал, что выигрыш от комбинации получают пациентки с гормонорезистентностью, в то время как у больных с гормоночувствительной болезнью (с прогрессированием более чем через 12 месяцев после завершения адъювантной гормонотерапии) добавление алпелисиба к фулвестранту не привело к значимому увеличению ВБП (эта подгруппа также в дальнейшем не включалась в анализ). Таким образом была выделена «таргетная» когорта пациенток с подтвержденной мутацией в гене PIK3CA и признаками гормонорезистентности, где добавление алпелисиба к фулвестранту продемонстрировало достоверное практически двукратное увеличение медианы ВБП (с 5,7 до 11,0 мес) и снижение относительного риска прогрессирования на 35 %.
Преимущество комбинации алпелисиба с фулвестрантом по сравнению с терапией фулвестрантом было доказано как в первой (ОР = 0,71), так и во второй (ОР = 0,61) линии терапии у пациенток с мутацией в гене PIK3CA, что особенно важно для больных с признаками гормонорефрактерности. Отмечался быстрый эффект терапии: расхождение кривых зарегистрировано уже через 8 недель от начала лечения и сохраняется на протяжении как минимум 28 месяцев наблюдения. Уменьшение размера опухоли отмечалось у 3 из 4 пациенток, получавших алпелисиб + фулвестрант, а частота объективного ответа возрастала в два раза по сравнению с группой «плацебо + фулвестрант». Подгрупповой анализ продемонстрировал преимущество добавления алпелисиба к фулвестранту в том числе в подгруппе больных с фактором неблагоприятного прогноза в виде висцеральных метастазов. При этом комбинированная терапия обладала управляемым токсическим профилем: наиболее частыми НЯ были гипергликемия и сыпь, но лечение ввиду этих НЯ прерывалось лишь в 6,3 и 3,2 % случаев соответственно, а дозовая интенсивность в исследовании составила более 80 %.
Результаты SOLAR-1 показали, что мутация в гене PIK3CA имеет не только прогностическое, но и предиктивное значение. На сегодня алпелисиб является единственным зарегистрированным таргетным препаратом — ингибитором PI3K. Учитывая высокую распространенность и значимость мутации PIK3CA для патогенеза РМЖ и данные по эффективности и безопасности алпелисиба, полученные благодаря SOLAR-1, в «Клинические практические рекомендации по онкологии» (NCCN Clinical Practice Guidelines v. 3.2019) включено обязательное тестирование всех больных HR+ HER2- мРМЖ на мутацию в гене PIK3CA, а алпелисиб в комбинации с фулвестрантом обозначен как препарат первой линии терапии пациентов c мРМЖ, имеющих мутацию PIK3CA.
КЛИНИЧЕСКИЙ ПРИМЕР
Опытом применения алпелисиба в рамках программы расширенного доступа поделилась заведующая отделением ФГБУ «НМИЦ онкологии им. Н.Н. Блохина», д.м.н. Елена Владимировна Артамонова.
В программу расширенного доступа было включено 11 пациенток с подтвержденной мутацией в гене PIK3CA в ткани опухоли. При этом если характеристики болезни у основной части больных соответствовали таковым в исследовании SOLAR-1 (HR+ HER2- мРМЖ после предшествующей эндокринотерапии), то у двух пациенток они существенно отличались: у одной был подтвержден трижды-негативный фенотип метастатического очага исходно люминального РМЖ, а другая получала лечение по поводу распространенного рака анального канала с мутацией в гене PIK3CA. Все пациентки были интенсивно предлеченными — получившими до трех линий предшествующей терапии, при этом больше половины из них (66 %) ранее прошли терапию ингибиторами CDK 4 / 6. Большинство больных только начали лечение в рамках расширенного доступа, эффективность терапии оценена только у двух пациенток (еще у двух контрольное обследование отложили из-за пандемии): в одном случае зафиксирован частичный ответ, в другом — уменьшение опухолевых очагов в рамках стабилизации болезни.
У обеих пациенток отмечались специфические для алпелисиба НЯ: гипергликемия, сыпь, у одной больной также наблюдалась и диарея. Известно, что развитие гипергликемии и сыпи напрямую связано с механизмом действия препарата, поскольку PIK3 не только стимулирует деление клеток, но и участвует в регуляции уровня глюкозы в крови и дифференцировки клеток эпидермиса. Блокирование PIK3 может нарушать захват глюкозы клетками, способствуя развитию гипергликемии, которая может достигать 3 и 4-й степени интенсивности. Это нежелательное явление встречается очень часто и может приводить к отмене препарата. В исследовании SOLAR-1 гипергликемия в целом отмечалась у 64 % пациентов, а конкретно 3 и 4-я степени — у 33 и 4 % пациентов соответственно. При этом показано,что вероятность развития и выраженность гипергликемии напрямую коррелируют с исходным метаболическим статусом пациента: так, риски этого НЯ значимо выше у больных с предиабетом и диабетом, ввиду чего к назначению препарата данной категории больных следует подходить с осторожностью. Елена Владимировна представила клинический пример пациентки с выраженной гипергликемией 3-й степени (до 16,2 ммоль / л натощак) на фоне терапии алпелисибом, которую удалось скорректировать до 1-й степени тяжести, несмотря на категорический отказ пациентки от редукции дозы, посредством назначения инсулинотерапии и метформина. Этот случай подтверждает, что при своевременном выявлении гипергликемия чаще всего поддается коррекции и позволяет продолжать прием препарата (отмена алпелисиба из-за развития гипергликемии в исследовании SOLAR-1 понадобилась лишь 6 % пациентов). Кожная токсичность алпелисиба также оказалась управляемым НЯ: во всех случаях она была купирована приемом антигистаминных препаратов. Елена Владимировна предоставила данные о возможной профилактике ее развития профилактическим назначением антигистаминных средств. В исследовании SOLAR-1 было показано, что у пациентов, которым проводилась профилактика сыпи, это НЯ развивалось реже: любой степени тяжести — 27 % против 54 %, сыпь 3-й степени — 12 % против 20 % и сыпь, приведшая к полному прекращению лечения алпелисибом, — 3,5 % против 4,2 % пациентов. Понимание механизмов действия препарата, знание о возможных нежелательных явлениях на фоне терапии, умение вовремя заметить и распознать их позволят пациенту сразу обратиться к врачу и своевременно модифицировать лечение.
Появление в арсенале онкологов препарата Пикрэй (алпелисиб) открывает новые возможности лечения пациенток с мутацией гена
PIK3CA, являющейся фактором неблагоприятного течения метастатического РМЖ. Применение Пикрэя в комбинации с фулвестрантом обеспечивает двойную контррезистентность к эндокринной терапии:
– у пациенток с прогрессированием РМЖ на фоне адъювантной терапии или в течение 1 года после ее окончания;
– у пациенток с прогрессированием на фоне эндокринной терапии метастатической стадии (как в монорежиме, так и в комбинации с ингибитором CDK 4 / 6).
--------------------------------------------------------------
Список литературы:
1. Kunwor R. et al. Journal of Clinical Oncology 2020 38: 15 suppl, 1060-1060;
2. Slamon D. et al. N Engl J Med 2020; 382:514-524;
3. Im et al. N Engl J Med 2019;381:307-16;
4. Hortobagyi G. et al. Annals of Oncology. 2-18. 29: 1541–1547;
5. Janni W. et al. Breast Cancer Research and Treatment. 2018. 169:469–479;
6. Verma S. et al. Breast Cancer Research and Treatment. 2018. 170:535–545;
7. D’Souza A, Spicer D, Lu J. J. Hematol Oncol. 2018;11(1):80. 2018 Jun 11;
8. Mosele F. et al. Ann. Oncology. 2020; 31(3):377–386.
9. Andre F. et alN Engl
J Med 2019;380:1929-40.
Читайте также
- Итоги XI съезда онкологов и радиологов стран СНГ и Евразии
- COVID-19 как бритва Оккама: вернемся ли мы когда-нибудь к скринингу в прежнем объеме?
- Сбитый прицел в терапии НМРЛ
- Новые вызовы онкологической службе: COVID-19
- Время «Х»: когда следует прекращать иммунотерапию у пациентов с меланомой?
- ASCO-2020: пембролизумаб укрепляет позиции
- Дистанционное консультирование онкологических больных в период COVID-19 и после его окончания

















