Статьи
Внимание: кардиотоксичность!
Кардиотоксичность у онкологических пациентов — чрезвычайно актуальная междисциплинарная проблема. Контингент таких больных непрерывно увеличивается, а их лечение, в том числе инновационными препаратами (зачастую весьма агрессивными), сопряжено с увеличением исходно высокого риска различных кардиоваскулярных осложнений. Об особенностях ранней диагностики, коррекции и профилактики этого состояния рассказывает д.м.н., профессор Юрий Александрович ВАСЮК.
На сегодняшний день злокачественные новообразования (ЗНО) — вторая после сердечно-сосудистых заболеваний (ССЗ) причина смертности в развитых странах, показатели которой быстро растут. Если в 2015 г., по данным Всемирной организации здравоохранения (ВОЗ), от онкопатологии умерли 8,2 млн человек, то 3 года спустя это значение достигло уже 9,6 млн. В этих же государствах повышается и онкозаболеваемость, главным образом на фоне старения населения. При этом скачок здесь настолько резкий, что за последние 2 десятилетия ежегодная величина роста этого показателя превысила аналогичные значения прироста населения. Так, в 2018 г. глобальная заболеваемость ЗНО достигла 17 млн человек, из которых 9,8 млн нуждались в лечении, а в 2020 г. выявлено свыше 19 млн новых случаев онкологической патологии. В соответствии с прогнозами, в 2040 г. злокачественные опухоли будут вновь диагностированы у 26 млн человек, необходимость же в тех или иных лечебных мероприятиях возникнет у 15 млн из них. Таким образом, относительный рост востребованности специализированного медикаментозного вмешательства в ближайшее 20-летие составит 53 %. Подобное лечение, включающее химиотерапию (ХТ), а также лучевую (ЛТ), таргетную и иммуноонкологическую/ биологическую терапию, позволяет помимо продления жизни поддерживать ее качество и социальную адаптацию многие годы. Однако применение многих противоопухолевых лекарственных средств (ЛС) ограничено из-за их сердечно-сосудистых осложнений (ССО), известных как кардиотоксичность.
Когда в 1970-х гг. изучение ССО только начиналось, под этим термином понимали лишь ХТ-индуцированное снижение фракции выброса левого желудочка (ФВЛЖ) с появлением симптомов хронической сердечной недостаточности (ХСН). Сегодня данное понятие расширилось за счет многих других состояний и заболеваний, вызываемых уже не только ХТ, но и остальными видами противоопухолевого лечения. Сюда относятся ишемическая болезнь сердца (ИБС), артериальная (АГ) и легочная гипертензия, инсульты, перикардиты, поражения клапанного аппарата, аритмии, тромбозы/тромбоэмболии, атеросклеротические и неатеросклеротические поражения периферических артерий нижних конечностей. Иными словами, это почти полный перечень известных органических болезней сердечно-сосудистой системы.
ДВЕ СТОРОНЫ МЕДАЛИ
Безусловно, все проявления кардиотоксичности крайне неблагоприятно влияют на прогноз онкологических больных. Так, в 2019 г. заболеваемость ЗНО в РФ составила 640 тыс. человек; у 44 % из них выявлены II и III стадии процесса, требовавшие медикаментозной терапии. В свою очередь, ХТ получали большинство (70 %) нуждавшихся в ней; при этом ассоциированные с кардиотоксичностью ССО развивались почти у половины — в 48 % случаев. Этим побочным действием обладают все классы противоопухолевых препаратов и подавляющее большинство их представителей, причем внутри одной группы степень кардиотоксичности заметно различается. Например, таргетное ЛС — ингибитор тирозинкиназы (ИТК) сунитиниб вызывает ССО в 10–28 % случаев, в то время как идентичный по механизму действия лапатиниб — в 0,2–3,0 %. До 48 % получающих химиопрепарат доксорубицин страдают от кардиотоксичности, на фоне же назначения доцетаксела эта величина не превышает 8 %. В целом, к сожалению, нельзя утверждать, что препараты предыдущих групп/поколений были и остаются весьма токсичными, а новые генно-инженерные средства намного безопаснее.
Лекарственная терапия ЗНО становится все разнообразнее и эффективнее, но это лишь одна сторона медали. Есть, увы, и другая: все больше онкобольных неизбежно подвергаются токсическому воздействию противоопухолевых агентов. Не в последнюю очередь поэтому среди таких пациентов неуклонно возрастает смертность, непосредственно не связанная с развитием и прогрессией новообразования. Только с 2009 по 2017 г. этот показатель увеличился на 5 % — с 16,4 до 21,4 %. Согласно более позднему 7-летнему наблюдению за 1,8 тыс. пациентов с различными опухолями, ССО стали причиной смерти в 33 % случаев, тогда как непосредственно от онкозаболевания умерли 51 % больных.
Особая опасность кардиотоксичности, как и основная трудность борьбы с ней, связана с тем, что большинство противоопухолевых препаратов оказывают сразу несколько разнонаправленных токсических эффектов кардиотропного характера. В частности, фибрилляция предсердий — частое побочное действие для алкилирующих агентов, антрациклинов, ИТК. Но представители двух последних групп приводят также к удлинению интервала QTс; аналогичное осложнение наблюдается у ингибиторов гена BRAF/киназ CDK4/6. Развитие АГ способны вызвать ИТК, ингибиторы mTOR (мишени рапамицина млекопитающих) и антиметаболиты, например децитабин. В то же время при назначении флюоропиримидинов, соединений платины, таксанов, ингибиторов фактора VEGF, этопозида и блеомицина часто возникает ИБС, а другие кардиотоксические эффекты у этих препаратов встречаются заметно реже.
МОЗАИКА ПОРАЖЕНИЙ
Наиболее частые и серьезные кардиоваскулярные осложнения противоопухолевого лечения, приводящие к необратимым последствиям и росту смертности, — это дисфункция миокарда и сердечная недостаточность. Выделяют два классических типа наиболее опасной кардиотоксичности. Первый — это необратимая, связанная в основном с применением антрациклинов; второй — обратимая, но также жизнеугрожающая кардиотоксичность, например поражение сердца при использовании трастузумаба (препарат моноклональных антител). В ситуациях, относящихся к первому типу, происходят прогрессирующее ремоделирование миокарда и — как отдаленное последствие — повреждение клеток сердечной мышцы с развитием кардиомиопатии.
Однако такое деление достаточно условно; клинический результат во многом зависит от того, насколько рано выявлены изменения и начато лечение ССО. Весьма существенное препятствие на пути борьбы с кардиотоксичностью состоит еще и в том, что пациенты часто получают несколько противоопухолевых препаратов одновременно с ЛТ. В результате кардиотоксический эффект развивается при потенцирующем друг друга взаимодействии различных лечебных методик. Образуется сложнейшая мозаика поражений, и кардиолог вынужден бороться не с каждым из них, а прежде всего с наиболее жизнеугрожающим.
Итак, в преодолении кардиотоксичности существует множество проблем, а сами ССО настолько опасны, что, казалось бы, врач при их коррекции чаще всего должен терпеть неудачу. На самом же деле в наши дни такая коррекция оказывается все более успешной — прежде всего потому, что постоянно повышается действенность профилактики этих грозных осложнений.
УЧИМСЯ ПРЕДУПРЕЖДАТЬ
Согласно рекомендациям рабочей группы по кардиоонкологии Европейского общества кардиологов (ESC) и Международного общества кардиоонкологов (ICOS), профилактика кардиотоксичности включает два обязательных этапа. На первом из них до начала лечения ЗНО оценивается исходный риск сердечно-сосудистой токсичности и по этим результатам заполняется чек-лист для определения базового кардиоваскулярного риска у пациента. При этом необходимо учитывать как медицинские, так и связанные с образом жизни факторы риска (ФР) ССЗ, а также имеющиеся кардиологические заболевания и анамнез противоопухолевой терапии, если она уже проводилась ранее. Обязательно измеряется артериальное давление, выполняются эхокардиография и электрокардиография в 12 отведениях с расчетом интервала QT. Из лабораторных показателей наиболее специфичными в отношении раннего выявления дисфункции ЛЖ и сердечной недостаточности считаются уровни высокочувствительного тропонина I (HsTpI), мозгового натрийуретического пептида (BNP) и его предшественника — N-терминального промозгового натрийуретического пептида (NT-proBNP). Кроме того, выполняется биохимический анализ крови с изучением липидного спектра, определением концентраций глюкозы, гликированного гемоглобина (HbA1c), креатинина (подсчет его клиренса и/или скорости клубочковой фильтрации), калия, натрия, а также активности аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) и креатинфосфокиназы (КФК).
При минимальном ожидаемом риске кардиотоксичности планируемого лечения — например, если выявляется лишь подозрение на какое-либо ССЗ, — необходима консультация кардиолога. Средний уровень риска (неконтролируемые ФР ССЗ либо предсуществующее заболевание) требует активного контроля влияния таких факторов и мониторинга сердечно-сосудистой патологии. В случаях же наивысшего риска (ХСН с деформацией ЛЖ, когда ХТ-ассоциированная кардиоваскулярная токсичность может значительно ускорить прогрессирование сердечной недостаточности) терапия ЗНО может быть начата только после совместной разработки онкологом и кардиологом оптимальной профилактической стратегии с выбором наиболее безопасных противоопухолевых средств.
В ходе второго этапа независимо от того, какой уровень базового риска определен по чек-листу, для каждого больного заново рассчитывается индивидуальная степень риска кардиоваскулярной токсичности с учетом двух основных моментов: показателей общего состояния и характеристик назначенного онкологом препарата. Эксперты рабочей группы по кардиоонкологии ESC совместно с представителями ICOS в 2020 г. предложили стратификацию ФР кардиотоксичности для наиболее распространенных онкологических ЛС. Пример подобной стратификации для антрациклинов приведен в табл. 1.
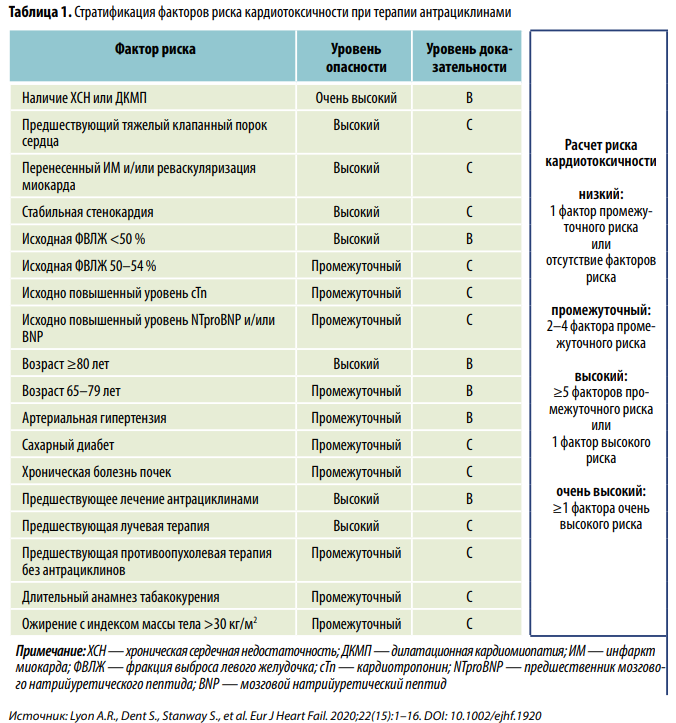
Риск кардиотоксичности <2 % считается низким, 2–9 % — промежуточным, 10–19 % — высоким и ≥20 % — очень высоким. В зависимости от того, к какой группе риска отнесен пациент, лекарственная профилактика проводится разными средствами (табл. 2).

Рассмотренная схема значительно упрощена и отражает лишь самые общие превентивные алгоритмы. Уже разработаны и применяются методы специализированной профилактики для страдающих на момент постановки онкологического диагноза, в частности, такими заболеваниями, как ХСН, АГ или ИБС, тромбоэмболия или перикардит. Динамическое наблюдение онкобольного кардиологом, как и профилактика кардиотоксичности, должны проводиться индивидуализированно — с разной интенсивностью в зависимости от определенной для каждого больного степени риска (табл. 3). В соответствии с общемировым опытом мониторинг в группах высокого и очень высокого риска следует осуществлять пожизненно.


КАК ПОСТАВИТЬ ДИАГНОЗ
Самое частое и опасное (как и наиболее изученное) проявление кардиотоксичности — это ХСН с основным симптомом в виде дисфункции миокарда. В 2014 г. экспертами Американского общества эхокардиографии (ASE) и Европейской ассоциации кардиоваскулярной визуализации (EACVI) принят консенсус по алгоритму диагностики кардиотоксичности. О ее присутствии говорят в случаях уменьшения ФВЛЖ на >10 % или до уровня <53 % от референсного значения для 2D-ЭхоКГ. Такое снижение следует подтвердить повторными измерениями через 2–3 нед после первого исследования, выявившего начальную редукцию ФВЛЖ. Деформацию миокарда можно измерить с помощью тканевой допплерографии или 2D-спекл-трекинг (2D-speckle-tracking) ЭхоКГ (спеклы — точки изображения, образуемые взаимодействием ультразвукового луча с волокнами миокарда. — Прим. ред.). Последняя методика предпочтительнее из-за отсутствия зависимости ее результатов от угла наклона луча. Оптимальный параметр раннего выявления субклинической дисфункции — глобальная продольная деформация (GLS). Ее уменьшение на ≥15 % от исходного показателя считается значимым, а на <8 % — напротив, незначимым. При недостаточной информативности ЭхоКГ назначают МРТ сердца и равновесную радиоизотопную вентрикулографию. Эти методы широко используются в европейских странах; в России же их применение желательно, но пока не рассматривается как обязательное. Внедрение в широкую практику современной лучевой/лабораторной диагностики ХТ-ассоциированной кардиотоксичности может выявить ранние потенциально обратимые сердечно-сосудистые расстройства, что существенно улучшает прогноз у таких пациентов. Не меньшие надежды связывают с клиническими испытаниями новых препаратов для предотвращения и лечения этого побочного действия. В целях успешной разработки единой стратегии контроля ССО, обусловленных противоопухолевой терапией, и выбора наиболее рациональной тактики ведения больных необходим комплексный подход при командном взаимодействии кардиолога, онколога/химиотерапевта, радиолога и специалиста по визуализирующим технологиям. Как показывает мировой опыт, в снижении смертности от таких осложнений важно и создание специализированных кардиоонкологических клиник и/или отделений в стационарах онкологического профиля. Тщательный мониторинг пациентов с риском кардиотоксичности во многих случаях позволяет замедлить или даже предотвратить ее развитие.
БАЗОВЫЕ ДОКУМЕНТЫ
Перечень наиболее часто встречающихся кардиотоксических осложнений на фоне терапии более чем 60 противоопухолевыми ЛС, а также алгоритмы первичной и вторичной профилактики, диагностики и лечения основных видов ССО (дисфункция ЛЖ, артериальная/легочная гипертензия, ИБС, аритмии, ЗНО-ассоциированные венозные и артериальные тромбозы, миокардиты, заболевания перикарда и некоторые другие ССЗ) содержатся в двух документах, разработанных на базе последних отечественных рекомендаций:
«Согласованное мнение российских экспертов по профилактике, диагностике и лечению сердечно-сосудистой токсичности противоопухолевой терапии» (руководители группы Васюк Ю.А., Гендлин Г.Е.). Российский кардиологический журнал. 2021;26(9):4703.
«Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии. Злокачественные опухоли». Виценя М.В. и соавт. Практические рекомендации RUSSCO #3s2, 2021(т. 11):41.
Подготовил Александр Раскин, к.м.н.
Материал представлен в рамках выступления на Российском национальном конгрессе кардиологов (Россия, г. Казань, сентябрь–октябрь 2022 г.)
















