Статьи
Синдром острого лизиса опухоли: роль в терапии ЗНО у детей
Хотя в последние 20 лет достигнут значительный прогресс в предотвращении синдрома острого лизиса опухоли благодаря появлению современных препаратов, сохраняет актуальность проблема его терапии, поскольку до 40 % детей с онкологическими заболеваниями как минимум однократно поступали в отделение реанимации и интенсивной терапии, а смертность в этой группе больных составляет 27,8 %.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Синдром острого лизиса опухоли (СОЛО) — наиболее частое неотложное состояние, с которым сталкиваются онкологи. Хотя он чаще всего развивается у пациентов с неходжкинской лимфомой (на поздних стадиях заболевания) или острым лейкозом, при котором его частота варьирует в пределах от 10 до 39 %, распространение СОЛО увеличивается и среди пациентов с солидными новообразования (с большой опухолевой массой). Высокий пролиферативный потенциал лимфом и особенности течения болезни существенно влияют на верификацию диагноза, в связи с чем у педиатрических пациентов заболевание выявляют лишь в диссеминированной (III–IV) стадии. При лейкозах частота случаев с гиперлейкоцитозом выше 100 × 109 /л составляет 13,5 %. Острый лимфобластный лейкоз (ОЛЛ) первоначально проявляется гиперлейкоцитозом (более 50 тыс. лейкоцитов на 1 мм3 ) в 20 % случаев. Именно эти дети особенно подвержены риску развития СОЛО (рис. 1).
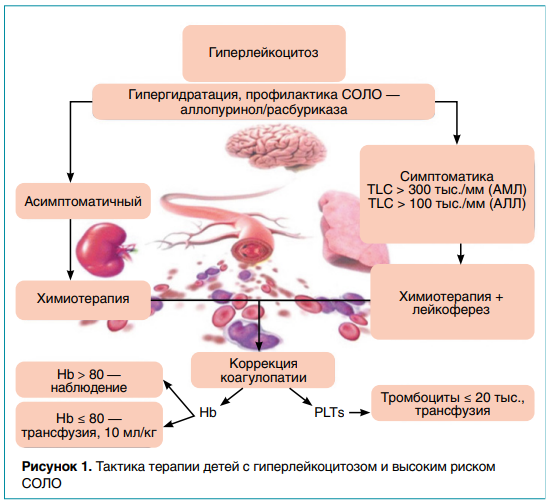
Чаще всего в клинической практике СОЛО встречается на этапе старта противоопухолевого лечения, когда в результате высокой чувствительности злокачественного новообразования (ЗНО) к цитостатическим препаратам происходит стремительный распад опухолевых клеток. Ряд авторов описывают клинические случаи развития СОЛО в результате применения дексаметазона. Кроме того, триггерами могут выступать и другие виды специфической противобластомной терапии (табл. 1).

Вероятность возникновения этого патологического состояния существует у пациентов, перенесших лучевую терапию, эмболизацию сосудов, радиочастотную абляцию и терапию моноклональными антителами, интерферонами. Спонтанный опухолевый лизис описан также при проведении лапароскопической биопсии образования брюшной полости у больных лимфомой Беркитта.
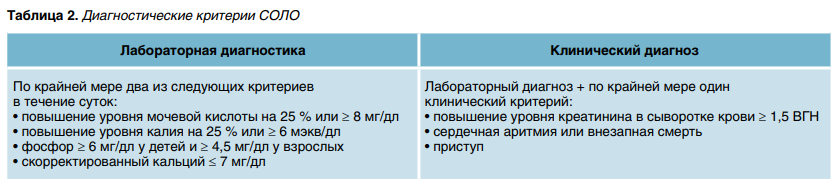
В целом лабораторные признаки СОЛО регистрируются у 4,4–53,6 % детей с лейкозами и лимфомами, тогда как выраженные клинические проявления наблюдают у 15,9 %. Диагностические критерии представлены в таблице 2.
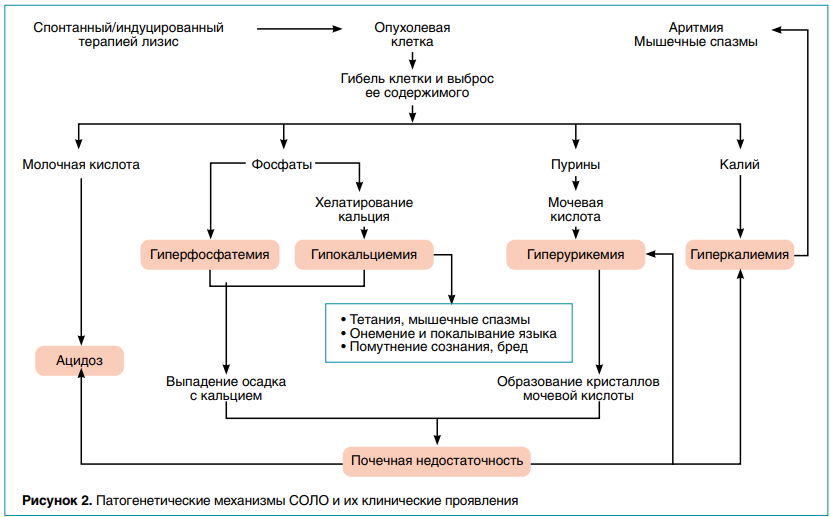
Выраженные метаболические расстройства возникают из-за разрушения клеточной мембраны опухолевых клеток и поступления в кровоток внутриклеточных электролитов (калия, фосфора) и продуктов обмена (гипоксантина, ксантина, мочевой кислоты, молочной кислоты) со скоростью, значительно превышающей их плазменный клиренс. На рисунке 2 представлена схема развития патологических изменений, основу которых составляет спонтанный и (или) индуцированный терапией лизис опухолевых клеток у детей с онкогематологическими заболеваниями.
КЛИНИЧЕСКАЯ КАРТИНА
Симптомы СОЛО варьируют в зависимости от уровня гиперкалиемии, гиперфосфатемии, концентрации продуктов распада опухоли и степени органной дисфункции:
- кратковременные тонические судороги, сонливость, тошнота, рвота, обусловленные гиперфосфатемией и вторичной гипокальциемией;
- мышечная слабость и парестезии, обусловленные гиперкалиемией;
- субклинические аритмии: на электрокардиограмме отмечаются нарушение сердечного ритма, увеличение амплитуды зубца Т, удлинение комплекса QRS;
- остановка сердечной деятельности вследствие фатальной аритмии при гиперкалиемии;
- острая почечная недостаточность (ОПН), связанная с гиперурикемией (мочекислая, или уратная, нефропатия) и (или) гиперфосфатемией (фосфатная нефропатия).
У 64 % пациентов СОЛО сопровождается острым почечным повреждением (ОПП), риск которого повышен у больных с предшествующим нарушением функции почек, опухолевым поражением почечной паренхимы, применением нефротоксичных препаратов (ванкомицин, аминогликозиды, рентгеноконтрастные препараты), а также при метаболическом ацидозе гидратации, то есть при патологических состояниях, которые не были скорректированы до начала химиотерапии:
- тяжелая дыхательная недостаточность, обусловленная уменьшением объема функциональной легочной ткани при опухолях переднего средостения или при развитии острого респираторного дистресс-синдрома (ОРДС).
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ
Основой профилактики и лечения СОЛО служит активная гидратация, которая помогает улучшить ренальную экскрецию и cкорректировать биохимические нарушения. Для этого применяют растворы натрия хлорида 0,9 % (без калия, фосфатов и кальция). Длительность гидратации не должна составлять менее 7 дней, необходимо начинать ее за 24–48 часов до химиотерапии и продолжать в течение 24–48 часов после завершения противоопухолевого лекарственного лечения.
Общий объем инфузии составляет 3000 мл/м2 /сут, у детей с массой тела до 10 кг — 200 мл/кг/сут (для достижения диуретического ритма—3 мл/кг/ч или 100 мл/м2 /ч). Больным, получающим большой объем инфузии, проводится контроль диуреза каждые 2–4 часа, при этом основной темп диуреза должен быть ≥ 100 мл/м2 /ч. При задержке жидкости более 400 мл/м2 за 4 часа назначается фуросемид. Мнение о том, что агрессивная внутривенная гидратация может уменьшить тяжесть ОПП или ускорить восстановление функции почек, не подтверждается достоверными клиническими данными. Кроме того, увеличение объема несет в себе риск перегрузки жидкостью с сопутствующими клиническими последствиями.
По мере опухолевого распада происходит повышение содержания мочевой кислоты в сыворотке крови. Гиперурикемия констатируется при уровне мочевой кислоты в крови более 476 мкмоль/л. Мочевая кислота кристаллизуется в почечных канальцах, вызывая острую обструктивную нефропатию и дисфункцию почек. Аллопуринол ингибирует фермент ксантиноксидазу и препятствует превращению ксантина в мочевую кислоту. Препарат назначают до начала цитостатической терапии (при возможности за 1–2 дня). Прием аллопуринола следует продолжать и после проведения химиотерапии (не менее 10–14 дней или до исчезновения признаков массивного лизиса в виде нормализации уровня мочевой кислоты и значимой редукции опухолевой массы). Режим дозирования аллопуринола: 300–400 мг/м2 /сут или 10 мг/кг каждые 8 часов (максимум 800 мг/сут). Аллопуринол выводится почками, что обусловливает необходимость снижения дозы при почечной дисфункции и значительно ограничивает число пациентов, у которых лечение эффективно.
При уровне мочевой кислоты более 500 мкмоль/л показано введение расбуриказы. Расбуриказа представляет собой рекомбинантную уратоксидазу, продуцируемую генетически модифицированными Saccharomyces cerevisiae. Препарат следует вводить за 4–24 часа до начала химиотерапии пациентам с высоким риском развития почечной недостаточности или с уже существующим СОЛО. Режим введения расбуриказы: 0,2 мг/кг + раствор хлорида натрия (0,9 % — 50,0 мл внутривенно в течение 30 мин). При сохранении повышенного уровня мочевой кислоты в сыворотке крови возможно повторное введение расбуриказы ежедневно на срок до 5 дней. После этого уровень мочевой кислоты снижается достаточно быстро, поэтому контроль ее показателей рекомендуется провести через 4 часа. Несмотря на высокую эффективность расбуриказы, описаны редкие осложнения (с частотой менее 1 %): анафилактические реакции, гемолитическая анемия и метгемоглобинемия у пациентов с дефицитом глюкозо‑6‑фосфатдегидрогеназы.
Не менее тяжелые патогенетические процессы происходят в организме больного СОЛО при повышении концентрации ионов калия. Если его уровень в сыворотке превышает 6,0 ммоль/л, вводится инсулин 0,1 ЕД/кг внутривенно с инфузией глюкозы 10–25 % в дозе 2 мл/кг (или натрия бикарбонат 1–2 мэкв/кг внутривенно).
При вторичной гиперфосфатемии (содержание фосфора в крови превышает 2,1 ммоль/л, или ≥ 4,5 мг/дл), помимо активной гидратации, показано пероральное применение гидроксида алюминия 50–150 мг/кг каждые 6 часов в течение 2 дней или гидрокарбоната кальция во время еды в дозах 50 мг/кг/день (2 г/день). При остро развившейся гиперфосфатемии проводится гемодиализ или вено-венозная гемодиафильтрация. Заместительная почечная терапия (ЗПТ) способствует быстрой элиминации фосфатов и мочевой кислоты. Абсолютные и относительные показания к проведению ЗПТ указаны в таблице 3.
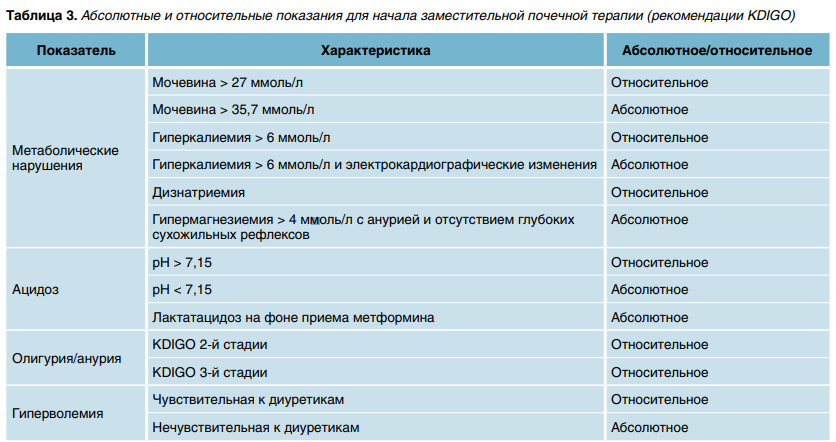
Для пациентов с тяжелым СОЛО непрерывная вено-венозная гемодиафильтрация является наиболее предпочтительным методом. Непрерывная (продленная) заместительная почечная терапия (непрерывная вено-венозная гемофильтрация у детей—paed CVVH и непрерывный низкопоточный гемодиализ у детей — paed CVVHD) может ускорить восстановление почек по сравнению с прерывистым (интермиттирующим) гемодиализом. Методом выбора ЗПТ у пациентов с нестабильной гемодинамикой являются продолжительные или продленные методы ЗПТ. Стоит отметить, что при отсроченной стратегии начала ЗПТ (когда она откладывалась до обязательных показаний или проводилась спустя 12 часов после развития III стадии ОПП) ее эффект был существенно хуже.
Несмотря на значительные достижения в области профилактики и лечения СОЛО, только широкое внедрение стратегии ведения, сочетающей адаптированную инфузионную терапию, уратоксидазу и тесное сотрудничество между отделениями интенсивной терапии, гематологии и отделением ЗПТ, помогает более результативно проводить лечение этого жизнеугрожающего осложнения у большинства пациентов.

















