Статьи
Генетическая геторогенность мКРРПЖ: какие могут быть точки воздействия?
Сегодня метастатический кастрационнорезистентный рак предстательной железы рассматривается как биологически гетерогенное заболевание, связанное с мутациями не только в общеизвестных генах гомологичной рекомбинации (BRCA1/2), но и, как выяснилось в последние годы, еще в 12 других генах. Это существенно увеличивает точки приложения таких современных таргетных противоопухолевых препаратов, как ингибиторы PARP, создавая возможности для лечения гораздо более широкого круга пациентов с данным диагнозом.
СПЕКТР АКТИВНОСТИ
Исследования показали, что приблизительно у 90 % пациентов с метастатическим кастрационно-резистентным раком предстательной железы (мКРРПЖ) определяются геномные отклонения в AR, PI3K, DDR, WNT и путях, связанных с клеточным циклом. Примерно у 20–30 % пациентов с мКРРПЖ встречаются мутации генов, участвующих в репарации путем гомологичной рекомбинации (HRR). Этот механизм в норме позволяет с высокой точностью восстанавливать поврежденную ДНК. При дефектах ключевых генов репарации такое восстановление проводится альтернативными путями, что повышает мутационную нагрузку на клетку.
Показано, что мутации генов путей репарации повреждений ДНК ассоциированы с более агрессивным течением и неблагоприятными исходами онкологического заболевания при многих видах злокачественных новообразований (ЗНО), в том числе при РПЖ. В последние годы внимание к этим мутациям при РПЖ усилилось, поскольку исследования показали, что их распространенность выше, чем считалось ранее, вследствие чего возникает понимание их возможной высокой прогностической значимости. Это было ожидаемо: ведь еще в 2018 году, на заре изучения ингибиторов ферментов поли-АДФ-рибозаполимеразы (poly-ADP-ribose-polymerase, сокращенно PARP), таких как олапариб, высказывалось предположение, что спектр активности данного препарата выходит далеко за пределы терапии опухолей, сопровождающихся известной мутацией гена BRCA1/2.
ТОЧКИ ПРИЛОЖЕНИЯ
Такие препараты, как олапариб, блокируют механизм репарации поврежденных участков ДНК посредством захвата ферментов PARP, связанных с однонитевыми разрывами ДНК. Это приводит к остановке репликационной вилки и возникновению двунитевых разрывов ДНК, что, в свою очередь, вызывает гибель опухолевых клеток. Исследования полноразмерного генома выявили более 70 ключевых локусов, связанных с увеличением риска развития РПЖ той или иной степени. Помимо давно известных, достаточно хорошо изученных и довольно часто определяемых мутаций генов BRCA1, BRCA2 и ATM представляет большой интерес и имеет хорошие перспективы исследование эффективности ингибиторов PARP при мутациях генов HRR.
ДОКАЗАТЕЛЬНАЯ БАЗА
Важным шагом в направлении расширения возможностей противоопухолевой терапии больных мКРРПЖ стали результаты исследования PROfound, опубликованные в 2020 году (рис.). Речь идет о проспективном многоцентровом рандомизированном открытом исследовании III фазы по оценке эффективности и безопасности лекарственного препарата олапариб в сравнении с продолжением терапии энзалутамидом или абиратероном у пациентов с мКРРПЖ, у которых отмечалось прогрессирование заболевания после предшествующего лечения новыми гормональными препаратами (абиратероном или энзалутамидом) и были выявлены мутации в генах BRCA1/2, ATM или в одном из 12 других генов, участвующих в репарации ДНК посредством HRR. В частности, это гены BRIP1, BARD1, CDK12, CHEK1, CHEK2, FANCL, PALB2, PPP2R2A, RAD51B, RAD51C, RAD51D и RAD54L.
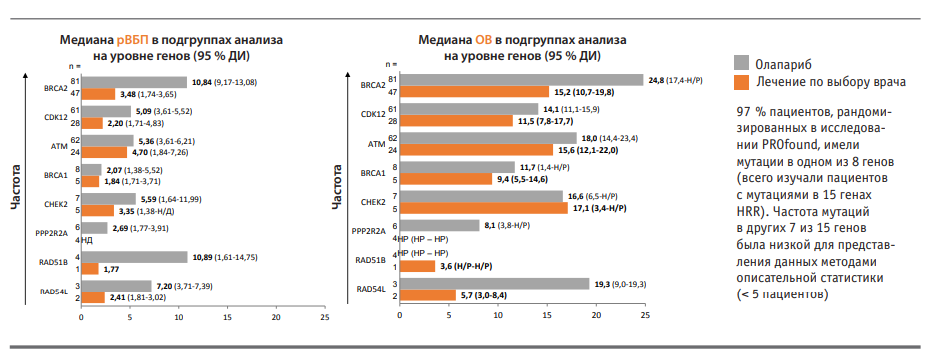
Анализ результатов в объединенной популяции пациентов с мутациями генов HRR — как с общеизвестными, так и с двенадцатью другими (всего 15 мутаций) — показал значимое преимущество олапариба в отношении выживаемости без прогрессирования (ВБП) на основе данных визуализации. ВБП составила 5,8 месяца в группе олапариба против 3,5 месяца в группе лечения новыми гормональными препаратами; разница достоверна (р <0,001). При дискретном анализе показателей в группах с общеизвестными и другими мутациями оказалось, что медиана общей выживаемости при наличии других мутаций на фоне приема олапариба составила 14 месяцев, а на фоне приема новых гормональных препаратов — всего 11,5 месяца.
Также большой интерес в контексте эффективности препарата представляют результаты исследования TOPARP, полученные в 2020 году. В ходе исследования TOPARP-A ответ на терапию олапарибом регистрировали не только при наличии мутаций в генах BRCA1/2 и ATM, но и у пациентов с сочетанной мутацией в генах BRCA1 и FANCA, а также с биаллельными аберрациями в генах PALB2 и HDAC2.
В протокол TOPARP-В тоже включали не только больных с общеизвестными мутациями BRCA1/2 и ATM. Среди участников исследования были пациенты с мутациями в генах CDK12, PALB2 и других. Дизайн исследования предполагал возможность раздельного подсчета показателей для подгрупп больных с различными мутациями. Анализ подгрупп по выявленному измененному гену показал, что частота ОО у пациентов с мутацией гена BRCA1/2 на фоне лечения олапарибом составила 83 % (выживаемость без прогрессирования — ВБП — 8,1 мес), с мутацией гена PALB2 — 57 % (ВБП — 5,3 мес), ATM — 37 % (ВБП — 6,1 мес), CDK12 — 25 % (ВБП — 2,9 мес) и для других (ATRX, CHEK1, CHEK2, FANCA, FANCF, FANCG, FANCI, FANCM, RAD50, WRN) — 20 % (ВБП — 2,8 мес). Наиболее высокие показатели ответа по критерию PSA50 выявлены в подгруппах пациентов с мутациями в генах BRCA1/2 (77 %) и PALB2 (67 %).
БЛИЖАЙШИЕ ПЕРСПЕКТИВЫ
Таким образом, имеющиеся данные свидетельствуют о высоком потенциале олапариба при мКРРПЖ для пациентов не только с мутациями в общеизвестных генах гомологичной рекомбинации, таких как BRCA1/2 и ATM, но и с мутационными изменениями в других генах. Это значительно расширяет вероятную целевую популяцию пациентов с мКРРПЖ, которым может назначаться данный препарат. Напомним, что РПЖ на текущий момент остается одним из самых частых ЗНО у мужчин с постоянно растущей распространенностью. Так, за 10 лет (с 2009 по 2019 г.) распространенность РПЖ в РФ возросла с 68,1 до 176,3 случаев на 100 тыс. населения.
Из всех известных форм РПЖ именно мКРРПЖ представляет наибольшую трудность в плане лечения, поэтому появление новых опций терапии, расширение показаний является одним из приоритетных направлений работы с такими пациентами.
Екатерина Демьяновская, к.м.н.
Читайте также
- «Химический мозг» лечится пробиотиками
- Повышают ли мобильные телефоны риск развития новообразований головного мозга?
- Эти многострадальные «офф-лейблы»
- Как отразились западные санкции на работе российских онкологов
- Точка роста: что нам дают клинические исследования в онкологии?
- Не пора ли снять ярлык «рак» с опухолей предстательной железы низкого риска?
- Ценность добавленной жизни

















