Статьи
Глютензависимые заболевания: классификация и основы патогенеза
Елена Равильевна Радченко
Гастроэнтеролог 1-го педиатрического отделения ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Александра Сергеевна Воробьева
Зав. педиатрическим отделением ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Жанна Владимировна Полякова
Педиатр ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Екатерина Юрьевна Новикова
Гастроэнтеролог гастроэнтерологического отделения ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Анастасия Дмитриевна ГОСТЮХИНА
Педиатр, аспирант кафедры педиатрии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва
Алия Ринатовна Миянова
Педиатр, ординатор кафедры педиатрии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва
Лала Саидовна Абдурахманова
Педиатр ГБУЗ «ДГКБ имени З.А. Башляевой ДЗМ», Москва
Структурные особенности, высокий аллергенный и иммунногенный потенциал глютена определяют широкий спектр патологических состояний, связанных с употреблением содержащих его злаков (целиакия, аллергия на пшеницу и не ассоциированная с целиакией непереносимость глютена). Единственный способ лечения здесь — безглютеновая диета, обеспечивающая контроль над симптомами и профилактику осложнений.
БЕЛКОВАЯ ФРАКЦИЯ
Глютен представляет собой важную белковую фракцию пшеницы, ржи и ячменя, составляя до 80 % белков их эндосперма.
Данная фракция имеет собственное название в структуре различных злаков (глиадины пшеницы, секалины ржи, хордеины ячменя), а в медицинской литературе эти белки объединены под общим именем «глютен» с учетом филогенетического и структурного сходства, а также одинакового воздействия на организм человека.
Глиадины пшеницы представляют собой отдельные полипептидные цепи с молекулярным весом от 33000 до 75000 дальтон, распределяющиеся при электрофорезе на четыре основные фракции — α-, β-, γ- и ω. Благодаря высокому содержанию пролина эти полипептиды устойчивы к воздействию желудочных, панкреатических и интестинальных протеиназ, что позволяет им сохранять высокий иммунногенный потенциал при прохождении через желудочно-кишечный тракт (ЖКТ). В структуре глиадина выделено не менее 50 эпитопов, стимулирующих активность Т-лимфоцитов слизистой оболочки (СО) ЖКТ, при этом основным инициатором иммунно-воспалительного ответа признан 33-мерный пептид LQLQPFPQPQLPY PQPQLPYPQPQLPYPQPQPH, выделенный в составе рекомбинантного α2-глиадина Shan Lu и соавторами в 2002 году.
Наряду с высокой устойчивостью глютена к энзиматическому воздействую его структура уникальна еще и тем, что он содержит определенные пептидные фрагменты, облегчающие его проникновение через эпителиальный барьер кишечника.
В регуляции проницаемости кишечника важную роль играет зонулин — белок из группы гаптоглобинов, вырабатывающийся в печени и тканях внутреннего эпителия. Это главный модулятор тесных белковых соединений в межклеточном пространстве. Отдельные эпитопы глютена активируют экспрессию зонулина, нарушая тем самым тесные связи между энтероцитами, что приводит к избыточному проникновению различных антигенов, включая сам глютен, во внутреннюю среду организма и, как следствие, к активации иммунной системы и продукции комплекса провоспалительных цитокинов.
Структурные фрагменты глиадина способны не только активировать механизмы T-клеточного иммунного ответа, но и провоцировать развитие IgE-опосредованных аллергических реакций. Именно это определяет высокий аллергенный потенциал пшеницы, включенной в большую восьмерку аллергенов. 60 % пациентов с аллергическими проявлениями при употреблении пшеницы вырабатывают специфические IgE к α- и β-глиадинам, а также низкомолекулярным субъединицам пшеничного белка, 55 % обследованных — к γ-глиадину, 48 % — к ω-глиадинам, 26 % — к высокомолекулярным субъединицам белка.
Указанные структурные особенности глютена, высокий аллергенный и иммунногенный потенциал глютенсодержащих злаков определяют широкий спектр глютен-ассоциированных состояний. В феврале 2011 года европейские эксперты одобрили классификацию глютен-ассоциированных заболеваний, основанную на патогенетическом механизме (рис.).
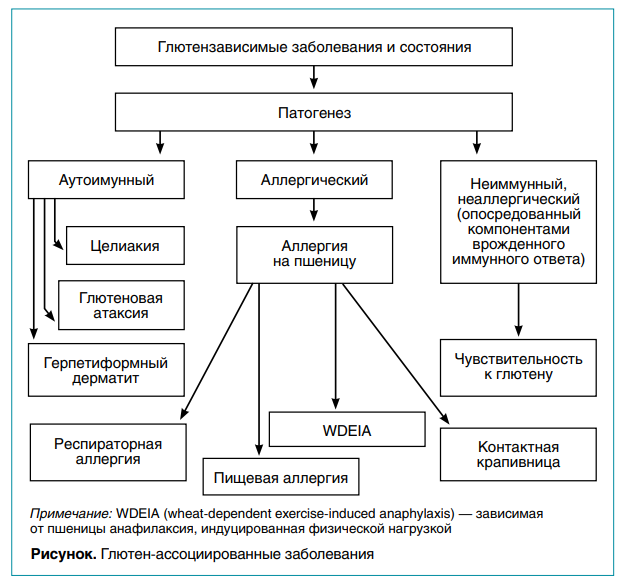
ЦЕЛИАКИЯ
Представляет собой иммунно-опосредованное системное заболевание в ответ на употребление глютена или соответствующих проламинов генетически предрасположенными пациентами. Характеризуется широкой комбинацией глютен-зависимых клинических проявлений, специфических антител (антител к тканевой трансглутаминазе—anti-tTG и эндомизию — EMA, а также к деамидированным пептидам глиадина — anti-DGP), наличием гаплотипов HLA-DQ2 или HLA-DQ8 и энтеропатии.
Скрининговые эпидемиологические исследования последних 35 лет с использованием высокочувствительных серологических методов свидетельствуют о том, что частота целиакии в Европе и Северной Америке достигает 1 % (1:100). Согласно систематическому обзору, опубликованному в 2018 году, средняя мировая частота выявления специфичных для целиакии антител к тканевой трансглутаминазе и эндомизию составляет 1,4 %, при этом у 0,7 % населения мира заболевание подтверждено гистологически. Употребление в пищу глютенсодержащих продуктов — необходимое, но недостаточное условие развития целиакии. В патогенезе этого генетически детерминированного заболевания важную роль играют гены главного комплекса гистосовместимости человека, в частности аллели DQ2 и DQ8. Антигены (молекулы), кодируемые HLA-DQ2/DQ8, экспрессируются на поверхности ангигенпрезентирующих клеток и представляют собой гетеродимеры — белки, состоящие из двух цепей (альфа и бета). Роль данных молекул в патогенезе целиакии обусловлена их участием в процессе презентации пептидов глиадина CD4+-лимфоцитам. Активированные CD4-клетки продуцируют провоспалительные цитокины (IFNγ, IL-10,-15, -21), повреждающие энтероциты, а также стимулируют В-лимфоциты к продукции антител к глиадину, тканевой трансглутаминазе и структурам слизистой оболочки тонкой кишки (эндомизию), которые попадают в системную циркуляцию и могут быть выявлены при проведении серологического исследования.
Провоспалительные цитокины с током крови распространяются далеко за пределы кишечника. Образующиеся иммунные комплексы могут быть выявлены как в слизистой оболочке тонкой кишки, так и в других органах и тканях, включая печень, головной мозг и периферические нервные волокна, лимфатические узлы, почки, кожу, что в совокупности определяет системность клинических проявлений целиакии. В клинической картине преобладают малосимптомные и скрытые формы заболевания, что существенно затрудняет процесс диагностики. Поздняя диагностика и недостаточный комплаенс при соблюдении безглютеновой диеты значительно увеличивают риск развития серьезных осложнений, таких как бесплодие, остеопороз, неврологические нарушения и онкологические заболевания (в особенности Т-клеточная лимфома тонкой кишки).
Комплексный подход к диагностике целиакии, предусмотренный российскими и международными протоколами, включает оценку высокочувствительных серологических маркеров заболевания (антител к тканевой трансглутаминазе и эндомизию), эндоскопию с забором биоптатов слизистой оболочки двенадцатиперстной кишки и детальное гистологическое исследование, а также проведение генетического анализа в группах риска по развитию заболевания с целью качественного динамического наблюдения за носителями HLA-DQ2/DQ8-аллелей.
ГЕРПЕТИФОРМНЫЙ ДЕРМАТИТ
Представляет собой хроническое заболевание кожи с ее сухостью и везикулопапулезными высыпаниями преимущественно на локтях и коленях, сопровождающимися выраженным зудом. Распространенность составляет примерно 1 случай на 10 тысяч человек, по данным эпидемиологических исследований, проведенных в Великобритании и США. Как при герпетиформном дерматите, так и при целиакии пациенты являются носителями аллелей HLA DQ2 (90 %) и DQ8 (5 %). Сегодня герпетиформный дерматит больше не рассматривают как заболевание, ассоциированное с целиакией, но его включили в спектр ее возможных внекишечных проявлений.
При гистологическом исследовании кожи больных определяются отложения депозитов IgA в сосочковом слое дермы. В биоптатах слизистой оболочки тонкой кишки часто выявляются признаки атрофической энтеропатии даже при отсутствии у пациентов каких-либо гастроинтестинальных проявлений. По данным серологического исследования, в сыворотке определяются специфические для целиакии аутоантитела, при этом антитела к тканевой трансглутаминазе преимущественно ориентированы на эпидермальную фракцию фермента (TG3). Безглютеновая диета приводит к исчезновению кожных проявлений и нормализации структуры слизистой оболочки кишечника.
ГЛЮТЕНОВАЯ АТАКСИЯ
Изначально рассматривалась как идиопатическая атаксия с положительными серологическими маркерами сенсибилизации к глютену. Как и при целиакии, данное заболевание характеризовалось аутоиммунным повреждением структур мозжечка с развитием атаксии. При наблюдении за 800 пациентами с прогрессирующей идиопатической атаксией на протяжении 15 лет у 148 (23 %) из 635 больных обнаруживались положительные антиглиадиновые антитела.
Патогенез данного состояния, вероятнее всего, связан с перекрестной реакцией антиглиадиновых антител с антигенными эпитопами клеток Пуркинье. Депозиты антител к тканевой трансглутаминазе выявляются вокруг сосудов головного мозга пациентов с максимальным отложением в мозжечке, структурах моста и продолговатого мозга. У данной категории больных антитела преимущественно направлены против шестой фракции тканевой трансглутаминазы, выявляемой в тканях центральной нервной системы.
Эффективность безглютеновой диеты при глютеновой атаксии зависит от длительности заболевания. Потеря клеток Пуркинье вследствие длительной аутоиммунной реакции, ассоциированной с употреблением глютена, необратима, но при своевременной диагностике элиминация глютенсодержащих продуктов из рациона обеспечивает благоприятный прогноз заболевания и купирование неврологических проявлений.
АЛЛЕРГИЯ НА ПШЕНИЦУ
Пшеница входит в большую восьмерку аллергенов, являясь одним из трех основных триггеров развития аллергических заболеваний у детей и взрослых наряду с белками коровьего молока и белком куриного яйца. Реакция на нее может иметь классические симптомы пищевой аллергии, выражаться в виде контактной крапивницы, астмы пекарей или проявляться в форме так называемой анафилаксии, зависимой от пшеницы и индуцированной физической нагрузкой. В патогенезе указанных состояний ведущую роль играют специфические IgE, вырабатывающиеся в ответ на употребление злака предрасположенными пациентами. Результаты европейских исследований подтвердили частоту аллергии на пшеницу на уровне 0,3–3,4 %, при этом частота сенсибилизации к данному аллергену может достигать 13,9 %.
АСТМА ПЕКАРЕЙ
Известна со времен Римской империи. Характеризуется развитием обструктивного синдрома или ринита в ответ на вдыхание компонентов муки. В польском исследовании характерные для данного состояния респираторные симптомы отмечались у 4,2 % сотрудников пекарен спустя год работы и у 8,6 % — через 2 года.
Диагноз устанавливается по результатам кожных скарификационных тестов, а также на основании повышения уровня специфических IgE-антител к белкам пшеницы, ржи, ячменя и α-амилазе. Одними из основных аллергенов среди белков пшеницы являются ингибиторы α-амилазы. В то же время исследования продемонстрировали взаимодействие IgE сыворотки пациентов с другими белковыми фракциями, включая зародышевый агглютинин, пероксидазу и неспецифичные белки — переносчики липидов.
АНАФИЛАКСИЯ
Анафилаксия, зависимая от пшеницы и индуцированная физической нагрузкой (WDEIA), может проявляться широким спектром симптомов — от крапивницы до тяжелых форм аллергических реакций, включая анафилаксию. В качестве основных триггеров развития данной формы непереносимости глютена идентифицированы семь эпитопов (QQIPQQQ, QQLPQQQ, QQFPQQQ, QQSPEQQ, QQSPQQQ, QQYPQQQ и PYPP) в структуре ω5 фракции глиадина.
Первичный этап диагностики аллергии на пшеницу включает аллергологическое исследование с определением специфических IgE-антител, а также выполнение кожных скарификационных проб. Прогностическая ценность положительных результатов в данном случае не превышает 75 %, особенно у взрослых пациентов из-за перекрестной реакции с другими пыльцевыми аллергенами. В определенных случаях решающим тестом для верификации аллергии на пшеницу становится провокационная пищевая проба. При этом присутствие в сыворотке специфических антител класса IgG к пшенице или глиадину не может рассматриваться в качестве специфического маркера заболевания.
К началу XXI века стало очевидным, что спектр глютен-ассоциированных заболеваний выходит за пределы целиакии и аллергии на пшеницу. В клинической практике часто встречаются пациенты, у которых отмечаются глютензависимые симптомы и проявления, исчезающие при исключении глютенсодержащих продуктов из рациона. При этом на этапе диагностического поиска характерных серологических и гистологических маркеров целиакии и аллергии выявить не удается. Данное обстоятельство стало основанием для включения в классификацию глютен-ассоциированных состояний непереносимости глютена, или неассоциированной с целиакией чувствительности к глютену (non celiac gluten sensitivity, NCGS).
NCGS — состояние, при котором у пациента имеются глютензависимые симптомы, при этом аутоиммунные и аллергические механизмы их развития исключены (нормальный уровень антител к тканевой трансглутаминазе и эндомизию у пациентов с нормальным уровнем общего IgA, нормальное ворсинчатое строение слизистой двенадцатиперстной кишки). Определенная доля пациентов может иметь в сыворотке повышенный уровень антиглиадиновых антител, однако окончательная верификация диагноза основывается на положительных результатах диетодиагностики и возвращении симптомов при проведении провокационной слепой пробы.
Симптомы чувствительности к глютену напоминают таковые при целиакии, но зачастую с более выраженными внекишечными проявлениями, включающими поведенческие нарушения, боли в костях, суставах и мышцах, потерю в весе и хроническую усталость. С 2004 по 2010 год из 5896 пациентов, проконсультированных в центре по изучению целиакии Университета штата Мэриленд (США), у 347 была диагностирована чувствительность к глютену (1:17; 6 %). Клинические проявления в данной группе включали боли в животе (68 %), экзему и высыпания на коже (40 %), головные боли (35 %), ощущение тумана в голове (34 %), усталость (33 %), диарею (33 %), депрессию (22 %), анемию (20 %), онемение в ногах, руках и пальцах (20 %) и боль в суставах (11 %). Безглютеновая диета в данной группе пациентов способствует полному исчезновению симптомов и стабилизации состояния.
Патогенез чувствительности к глютену, не ассоциированной с целиакией, продолжает изучаться. Употребление глютена такими пациентами может приводить к формированию патологической иммунной реакции в слизистой оболочке кишечника, отличной от специфического иммунного ответа при целиакии. ИсследованияD.Schuppan с соавт. указывают на важную роль в развитии системной иммунной реакции на фоне употребления глютена белков семейства ингибиторов амилазы и трипсина, являющихся составной частью белковой фракции пшеницы. Данные белки характеризуются устойчивостью к воздействию протеолитических ферментов и способны связываться с Toll-подобными рецепторами на поверхности моноцитов, макрофагов и дендритных клеток в слизистой оболочке кишечника, активируя продукцию провоспалительных цитокинов, попадающих в системную циркуляцию и определяющих комплекс клинических проявлений чувствительности к глютену.
ЭЛИМИНАЦИОННАЯ ДИЕТА
В основе элиминационной диетотерапии представленных выше заболеваний лежит полное исключение из рациона продуктов, содержащих глютен или его следы. Принципиально важным является отказ не только от еды, содержащей явный глютен (хлеб, хлебобулочные, кондитерские и макаронные изделия; пшеничная, манная, ячневая, перловая крупы; булгур, кус-кус, полба, спельта, тритикале, камут; полуфабрикаты мясных, рыбных и овощных блюд в панировке; пельмени, вареники и т.п.), но и содержащей скрытый глютен, который может использоваться в качестве пищевой добавки в процессе производства:
- вареные колбасы, сосиски, полуфабрикаты из измельченного мяса и рыбы;
- многие мясные, рыбные консервы, в особенности в томатном соусе;
- многие овощные и фруктовые консервы, в том числе томатные пасты, кетчупы, баклажанная и кабачковая икра;
- некоторые сорта мороженого, йогуртов, творожные сырки и пасты, мягкие и плавленые сыры;
- маргарины с глютен-содержащими стабилизаторами;
- некоторые виды уксусов и салатных соусов, майонезов;
- соевые соусы;
- многокомпонентные сухие приправы и пряности;
- концентрированные сухие супы, бульонные кубики, картофельное пюре быстрого приготовления;
- картофельные и кукурузные чипсы;
- замороженный картофель «фри»;
- некоторые виды чая, кофе и какаосмеси для быстрого приготовления (быстрорастворимые);
- кукурузные хлопья при использовании ячменного солода;
- имитации морепродуктов: крабовые палочки, крабовое мясо;
- карамель, соевые и шоколадные конфеты с начинкой, восточные сладости, повидло промышленного производства.
Нетоксичными злаками при глютензависимых заболеваниях являются рис, гречиха, кукуруза, пшено, амарант, киноа, монтина, чумиза, саго, сорго, тэфф при условии отсутствия загрязнения (контаминации) их глютеном в процессе сбора урожая, транспортировки, складирования и переработки. Безопасны мука и крахмалы из корнеплодов—картофеля, маниоки, тапиоки, батата, бобовых (бобов, фасоли, гороха, сои), различных орехов. Состав рациона больных зависит от возраста, тяжести состояния, периода заболевания и строится на основании общих принципов:
- углеводный компонент составляют за счет переносимых круп, картофеля, бобовых, овощей, фруктов, ягод;
- белковый и жировой — за счет мяса, яиц, рыбы, молочных продуктов, растительного и сливочного масел.
Рекомендуются безглютеновые продукты — заменители хлебобулочных, макаронных и кондитерских изделий. В продуктах, маркированных как «безглютеновые» или «не содержащие глютена», его примесь не должна превышать 20 ppm* (20 мг на 1 кг готового продукта).
Список литературы находится в редакции
Читайте также
- Редкие нарушения липидного обмена — ситостеролемия
- Пробиотики в терапии аллергической патологии у детей
- Современные технологии мониторинга углеводного обмена у детей с сахарным диабетом 1 типа
- Значение генетического исследования церебрального паралича
- Менингококковая инфекция: современные вызовы и решения
- Лечение инфекций мочевыводящих путей

















