Статьи
Лечение инфекций мочевыводящих путей
В обзоре последних когортных исследований с учетом половозрастной и этиологической структуры инфекций мочевыводящих путей у детей показана актуальность микробиологического мониторинга и взаимосвязь рецидивирующих инфекций у пациентов с сопутствующим нарушением микробиома кишечника. Оценивается роль исследования микробиома мочи и применения антимикробных пептидов в разработке персонализированного подхода к терапии и профилактике антибиотикорезистентности (АБР).
ТЕКУЩАЯ РАСПРОСТРАНЕННОСТЬ
По данным мировых и российских исследований, а также по результатам статистического анализа сведений из амбулаторнополиклинических и стационарных учреждений Департамента здравоохранения Москвы (ДЗМ), инфекции мочевыводящих путей (ИМП) в структуре нефрологических заболеваний у детей составляют 70–80 %. Для оптимизации работы, ранней диагностики и профилактики прогрессирования ИМП рабочей группой под руководством главного внештатного детского нефролога ДЗМ разработан алгоритм раннего выявления факторов риска с учетом возможности его реализации с первого обращения беременной в женскую консультацию (рис. 1).
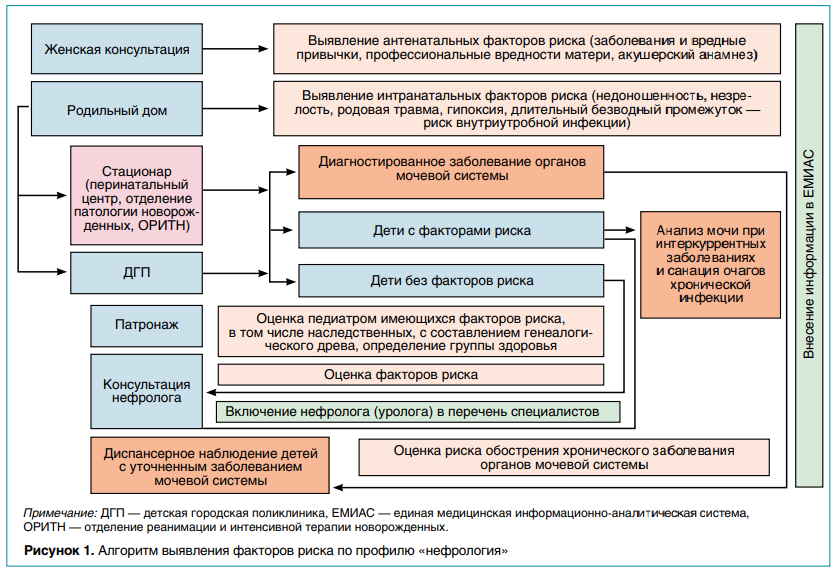
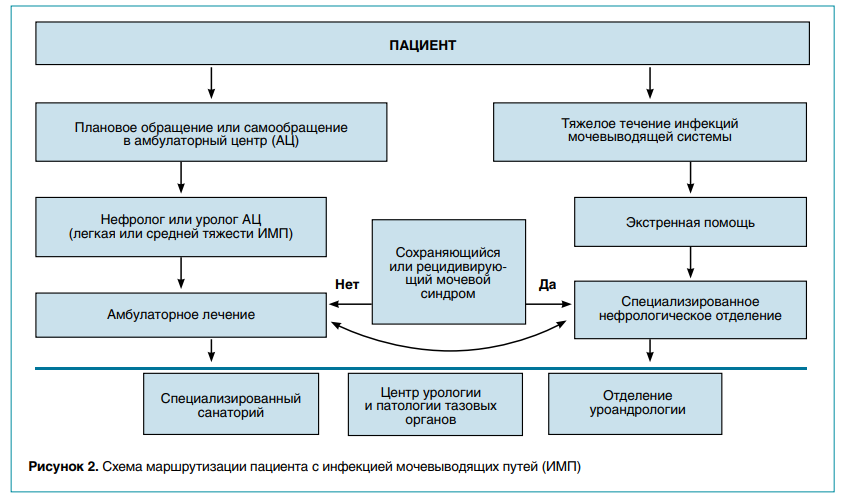
При рецидивирующем течении ИМП для профилактики прогрессирования определена схема маршрутизации пациентов (рис. 2). В связи с нарастанием антибиотикорезистентности становится актуальным вопрос об определении текущей распространенности возбудителей ИМП в детской популяции с диагностикой чувствительности к противомикробным препаратам в конкретном регионе. Несмотря на наличие разработанных клинических рекомендаций и методических пособий, врачи сталкиваются с проблемой антибиотикорезистентности.
На базе ДГКБ имени З.А. Башляевой проведено ретроспективное исследование, в которое были включены 1572 пациента от 1 месяца до 17 лет, находившихся на стационарном лечении в нефрологическом отделении с 01.01.2021 по 31.12.2021. Всем детям выполнено бактериологическое исследование средней порции мочи с определением возбудителя и его чувствительности к антибактериальным препаратам (АБП). Положительный результат получен в 491 случае, диагностически значимый титр возбудителя обнаружен в 197 (40 %) пробах из 491. Наиболее распространенными патогенными микроорганизмами оказались Escherichia coli (45 %), бактерии рода Staphylococcus (15 %) и Enterococcus (13 %).
Диагностически значимый титр (105 ) E. coli был выявлен у 88 пациентов, из них 28 % детей — в возрасте до 1 года, 12 % — от 1 года до 3 лет, 18 %—от 4 до 7 лет, 21 %— от 8 до 11 лет, 9 %—от 12 до 14 лет, 12 %— от 15 до 17 лет. У трети пациентов ИМП диагностирована впервые. У 43 % наблюдалось рецидивирующее течение. У 32 % ИМП была осложнена анатомической патологией (в большинстве случаев—пузырномочеточниковым рефлюксом различной степени выраженности).
Резистентность E. coli к амоксициллину/ клавулановой кислоте составила 16,0 %, к цефотаксиму — 33,3 %, к цефепиму — 26,7 %, к цефтриаксону —27,7 %. Чувствительность E. coli к препарату 2-й линии амикацину составила 95,3 %. Максимальная чувствительность бактерий в исследуемых образцах была зафиксирована к препаратам группы карбапенемов (меропенему, имипенему, эртапенему)—98,8–100,0 %.
Основой лечения ИМП является применение АБП и уросептиков. В большинстве случаев терапия назначалась эмпирическим путем: 55 % пациентов получали цефиксим, 38 %—фуразидин, 3 %—амоксициллин/клавулановую кислоту, еще 3 % — цефотаксим и 1 % — ципрофлоксацин. Эффективность терапии составила 98,6 %.
МИКРОБНЫЕ СООБЩЕСТВА
Сегодня уделяется большое внимание изучению микробных сообществ, населяющих желудочно-кишечный тракт (ЖКТ), причем все больше исследований подтверждает существование микробиома мочеполовой системы. По результатам культивирования микробов мочи, секвенирования бактериального генома и метагеномного анализа выявлены различия в микробиоме мочи у здоровых людей и пациентов с нефроурологическими заболеваниями. Это опровергает давнюю уверенность в том, что среда в мочевом пузыре стерильна.
Моча в мочевом пузыре содержит множество грамположительных организмов (лактобациллы, стрептококки и стафилококки). ЖКТ считается основным источником большинства бактериальных инфекций мочевыводящих путей. Кишечная палочка является доминирующим уропатогеном и образует резервуары внутри слизистой оболочки мочевого пузыря. Путем анализа последовательности всего генома изолятов E. coli из образцов мочи и кала мужчин и женщин 18–94 лет выявлены специфичные для каждой системы органов генетические адаптации.
Кроме того, штаммы E. coli, колонизирующие как мочевые пути, так и кишечник, обладают более высоким генетическим разнообразием. Ключевые наблюдения, сделанные авторами, позволяют предположить, что на эволюционное развитие патогенных штаммов влияют специфические для каждой ниши потребности в приспособлении к кишечнику или мочевыводящим путям, реализация которых осуществляется путем отбора случайных генетических мутаций или приобретения мобильных генетических элементов (MGEs)—последовательностей ДНК, которые могут перемещаться внутри генома.
Экспериментальные исследования показали, что кишечная микробиота имеет большое значение при остром повреждении почек, оказывая нефропротекторное или нейропатогенное действие. Клинически почечное повреждение индуцирует дисбиоз кишечника с нарушением жизнедеятельности видов E. coli, Bacteroidetes, Bifidobacterium, Salmonella, Lactobacillus, Clostridium, Ruminococcus, Rothia, Staphylococcus, Enterobacter, Faecalibacterium, Lachnospiraceae и др.
Дисбиоз кишечника также приводит к развитию воспаления в тканях и, как следствие, к повышенной кишечной проницаемости. Упомянутые выше факторы играют решающую роль в рецидивировании ИМП. В свою очередь, использование пробиотических препаратов и растительных уросептиков сокращает длительность применения антимикробных средств (АБР и уросептиков), что снижает вероятность формирования резистентности и отрицательного влияния на состав микробиоты. Известна антимикробная активность следующих веществ, содержащихся в траве розмарина: розмариновая, карнозиновая, кофейная кислоты; карнозол. В эксперименте было показано, что эфирное масло розмарина в 86,3 % случаев способно подавлять рост биопленок, выделенных у пациентов с ИМП в возрасте от 2 месяцев до 90 лет. Продемонстрировано также повышение чувствительности E. coli к цефтазидиму и цефтриаксону при сочетанном применении с экстрактом розмарина.
В мочевыделительной системе присутствует множество естественных компонентов иммунной системы, включая разнообразные классы антимикробных пептидов (АМП) и других белков с антимикробной активностью. АМП не только обладают противомикробным эффектом, но и сами по себе являются многофункциональными факторами иммунной защиты. Их универсальные механизмы действия на различные возбудители, свойство модулировать иммунный ответ, а также неспособность микроорганизмов формировать факторы резистентности по отношению к АМП создают перспективу использования препаратов в качестве альтернативы АБП, что требует дальнейшего изучения. Противоинфекционная защита иммунной системы непосредственно связана с присутствием нормальной микробиоты слизистых оболочек и кишечника.
Создание новых препаратов на основе естественных АМП имеет ряд недостатков, включая высокую стоимость синтеза и исследований их безопасности и эффективности, снижение активности АМП под действием солей, протеолитических ферментов, изменчивости рH, возможные аллергические реакции при их использовании, а также некоторые сопутствующие биологические эффекты, такие как ангиогенез. Тем не менее ряд препаратов на основе АМП сейчас проходят II и III фазы клинических исследований.
Резистентность к АБП продолжает оставаться актуальной и сложной проблемой, но развитие технологий секвенирования микробиома мочи, разработка альтернативных методов лечения дают возможность применить индивидуальный подход к терапии ИМП и профилактике рецидивов. Необходимо продолжать микробиологический мониторинг, что позволит скорректировать действующие клинические рекомендации и подходы к терапии с учетом индивидуальных особенностей пациента и региона проживания.
Список литературы находится в редакции
Читайте также
- Редкие нарушения липидного обмена — ситостеролемия
- Пробиотики в терапии аллергической патологии у детей
- Глютензависимые заболевания: классификация и основы патогенеза
- Современные технологии мониторинга углеводного обмена у детей с сахарным диабетом 1 типа
- Значение генетического исследования церебрального паралича
- Менингококковая инфекция: современные вызовы и решения

















