Статьи
Мастопатия и рак молочной железы. Есть ли связь?
В российской научной литературе и клинической практике так называемая «мастопатия» часто ассоциируется с повышенным риском возникновения злокачественных опухолей молочной железы. Пациенты с диагнозами «кистозно-фиброзная мастопатия», «фиброаденоматоз», а порой и «дисгормональная масталгия» наблюдаются онкологами, подвергаются интенсивному обследованию и дополнительным диагностическим манипуляциям. Насколько оправданы представления, довлеющие среди российских клиницистов? Из каких исследований проистекают заключения о взаимосвязи доброкачественных изменений молочной железы и злокачественных новообразований и какова на самом деле эта связь?
ИСТОРИЯ И КЛАССИФИКАЦИЯ
В 1985 году онкологический комитет Американской коллегии патологов сформировал консенсусное заключение по классификации доброкачественных новообразова-ний молочной железы с выделением непролиферативных доброкачественных новообразований, пролиферативных новообразований без атипии и атипичных гиперплазий.
В основе этой классификации, широко применяемой и по сей день, лежат не только морфологические различия, но и связь с рисками развития РМЖ. Эти риски были изучены в работе Dupont и Page. В этом ретроспективном когортном исследовании приняли участие 3303 женщины из 3 клиник. Всего было выполнено 10 366 биопсий, а период наблюдения составил 17 лет. Все случаи биопсии были разделены на три категории, которые впоследствии стали основой классификации: непролиферативные изменения, пролиферативные изменения без атипии, атипичная гиперплазия.
Все выполненные биопсии были расценены как доброкачественные изменения на тот момент, и пациенты были отправлены под наблюдение. Было очевидно, что речь не идет о раке на момент биопсии, однако было неизвестно, как обнаруженные изменения связаны с риском рака. За 17-летний период наблюдения у некоторых пациенток развился рак молочной железы. Эти случаи были распределены в соответствии с морфологической картиной исходного биопсийного материала. Так были определены риски в зависимости от морфологической картины биопсии первично доброкачественного образования молочной железы.
Итак, 70 % исходных образцов были представлены непролиферативными изменениями: кисты, апокриновая перестройка, кальцификаты, обычная гиперплазия.
При последующем наблюдении все эти изменения не были ассоциированы с каким-либо увеличением риска развития РМЖ относительно контрольной группы пациентов, не имевших какого-либо субстрата для биопсии. Еще 26 % образцов были представлены следующими морфологическими изменениями: обычная протоковая гиперплазия (наиболее распространенная картина при кистозно-фиброзной мастопатии), внутрипротоковый папилломатоз, склерозирующий аденоз.
Относительный риск развития РМЖ при отсутствии семейной истории по заболеванию, по данным авторов, увеличился в 1,6 раза по сравнению с контрольной группой пациентов, не имевших показаний для биопсии, и в 2,1 раза — при наличии семейного анамнеза по сравнению с пациентами без показаний для биопсии.Лишь 4 % биопсийных образцов были представлены изменениями, которые сегодня можно по-настоящему охарактеризовать как «предраковые»: атипичная протоковая гиперплазия, атипичная дольковая гиперплазия.
Среди пациенток с этими находками, по результатам биопсии, рак развивался в 4,4 раза чаще по сравнению с общепопуляционным уровнем. А при наличии семейной истории риск возрастал до 8,9 раза!
На основании проведенных в дальнейшем исследований, имевших схожий с основополагающим исследованием Dupont и Page дизайн, в частности исследований Nurses Health Study, BCDDP, Mayo Clinic и пр., отдел онкологии Коллегии американских патологов сформулировал перечень различных изменений ткани молочной железы, разделив их в зависимости от увеличения риска РМЖ.
К категории, не связанной с повышением риска РМЖ, отнесены следующие состояния: аденоз, дуктэктазия, неосложненная фиброаденома, фиброз, мастит, обычная протоковая гиперплазия без атипии, кисты, апокриновая метаплазия, плоскоклеточная метаплазия.
Все они являются морфологической иллюстрацией того, что в нашей и зарубежной практике обозначается терминами «фиброзно-кистозная мастопатия», «фиброаденоматоз», «мазоплазия» и пр. При этом то, насколько данное состояние вообще может именоваться заболеванием, является исключительно спорным вопросом. Насколько можно считать заболеванием состояние, которое имеет клиническое проявление у 50 % женщин и определяется у 90 % при морфологическом исследовании? Все эти состояния не ассоциированы с каким-либо риском для здоровья и, соответственно, не требуют проведения каких-либо лечебных мероприятий, если не ухудшают качество жизни пациентки.
Наиболее частыми клиническими проявлениями, служащими причиной для обращения к врачу, являются боль в молочной железе и наличие умеренно-болезненных уплотненных участков, определяемых при пальпации. Этиопатогенетические причины развития данного состояния остаются недостаточно изученными. Распространенным является представление о недостаточности эстрогенов во второй фазе менструального цикла и относительной гиперэстрогенемии.
Второй категорией, выделяемой CAP, являются новообразования, ассоциированные с некоторым увеличением риска инвазивного РМЖ (1,5–2 раза): «сложная фиброаденома», обычная протоковая гиперплазия, склерозирующий аденоз, единичная протоковая папиллома (цистаденопапиллома).
ПОДХОДЫ К ЛЕЧЕНИЮ, НАЦИОНАЛЬНЫЕ РЕКОМЕНДАЦИИ
В 2018 году Министерством здравоохранения РФ были составлены «Клинические рекомендации по лечению доброкачественных дисплазий молочной железы». Согласно этому документу, «в зависимости от клинических показаний при ДДМЖ рекомендуется исследовать концентрации ФСГ, ЛГ, ТТГ, свободного Т4, пролактина, эстрадиола, прогестерона, кортизола крови». Однако данное руководство не описывает, какие клинические показания служат критерием для назначения комплекса эндокринологических исследований и какие отклонения в случае обнаружения являются основанием для назначения «препаратов витекса священного» или лекарственных сборов, указанных в таблице № 6 руководства. Впрочем, коллектив авторов справедливо отмечает, что немедикаментозные подходы к коррекции субъективных симптомов фиброзно-кистозной мастопатии, такие как терапевтическая беседа и подбор белья, эффективны в 85 % случаев.
Приводимая в утвержденном Минздравом руководстве классификация сводится к классификации МКБ по нозологической форме N60. Также упоминается вышеописанная гистологическая классификация Dupont и Page. Далее приводятся факторы риска рака молочной железы и справедливо упоминается, что пролиферативные формы доброкачественной дисплазии («особенно с атипией») ассоциированы с повышением риска РМЖ.
Надо отметить, что частое употребление алкоголя, регулярные нарушения сна, ожирение и гиподинамия связаны с не меньшими, а то и большими относительными рисками. Фиброаденомы и внутрипротоковые папилломы часто преподносятся хирургами как заведомо склонные к малигнизации новообразования. Их «дефинитивное» хирургическое лечение затем часто погружает пациентов на долгие годы в череду постоянных обследований и повторных операций.
В руководстве Минздрава 2018 года большое внимание уделяется диагностике, скринингу и алгоритмам обследования пациента на предмет РМЖ. Это может сформировать впечатление о том, что доброкачественная дисплазия или ФКМ ходят рука об руку с РМЖ и являются как минимум предвестниками, если не предикторами злокачественного заболевания. Однако, как уже было указано, как непролиферативные, так и пролиферативные доброкачественные изменения являются крайне распространенным явлением. Частота их выявления начинает расти после 20 лет, достигая пиковых значений к возрасту после 30–40 лет, в то время как риски злокачественных новообразований достигают пиковых значений после 50 лет и продолжают расти в менопаузе. В возрастной категории 20–30 лет индивидуальный риск развития РМЖ в течение 10 лет составляет 0,06 % в год, или 1 случай на 1674 женщины за 10 лет. При наличии доброкачественных пролиферативных изменений происходит его увеличение: от 0,09 до 0,12 % в год. Это все же очень и очень низкий риск. Таким образом, относительное увеличение риска не транслируется в клинически значимый рост числа заболевших. В возрасте 30–40 лет индивидуальный риск составляет 0,44 % в год в течение 10 лет. При наличии доброкачественных пролиферативных изменений он возрастает до 0,8 % в год за 10 лет.
НАСТОЯЩЕЕ «ПРЕДРАКОВОЕ» СОСТОЯНИЕ
• атипичная протоковая гиперплазия,
• атипичная дольковая гиперплазия.
Атипичная протоковая гиперплазия представляет собой состояние, действительно значимо ассоциированное с рисками развития РМЖ. В таблице 1 обобщены результаты исследований случаев атипичной протоковой гиперплазии. В большинстве этих исследований в качестве способа получения материала для морфологического исследования выступала вакуум-аспирационная биопсия. При пересмотре гистологического материала в центральной лаборатории в 15–25 % случаев устанавливался диагноз «РМЖ»! Частые ошибки локальных лабораторий свидетельствуют о близости морфологических картин атипичной протоковой гиперплазии, DCIS и инвазивного рака. Это дает основание многим авторам полагать, что все три состояния в действительности являются фазами развития злокачественного процесса. Ядерный полиморфизм, правильное расположение клеток, формирование арочных эпителиальных структур — общие характеристики, затрудняющие дифференциальную диагностику ADH от DCIS. Page, Tevassoli и Norris были предложены специальные морфологические критерии отличия DCIS от ADH, однако высокая частота пересмотра при привлечении центральной лаборатории позволяет судить о том, насколько сложно правильно дифференцировать эти процессы.
На основании высокой частоты так называемого «апгрейда» от предракового состояния до постановки диагноза «инвазивный рак» NCCN рекомендует выполнять полноценное хирургическое вмешательство, даже если диагноз атипичной протоковой гиперплазии был установлен в результате исследования материала вакуум-аспирационной биопсии.
По данным L. C. Hartman и соавт., молодой возраст является дополнительным фактором риска. При выявлении атипичной протоковой гиперплазии в молодом возрасте риск последующего развития РМЖ в 2 раза выше, нежели у женщин, у которых атипичная протоковая гиперплазия была выявлена после 55 лет.
В связи с высоким риском наличия de facto РМЖ, а также малигнизации пациентам с атипичной протоковой гиперплазией показано хирургическое вмешательство с целью удаления новообразования. По данным R. S. Menen и соавт., атипичная протоковая гиперплазия определяется в 2–4 % биопсий, выполняемых по поводу пальпируемого новообразования, и в 12–17 % случаев — при биопсии по поводу рентгенографически определенного скопления микрокальцинатов.
В 2018 году одним из ключевых событий на конференции SABCS стали результаты исследования TAM-01. Целью исследования было сравнение эффективности и безопасности использования стандартных (20 мг/сут) и низких (5 мг/сут) доз тамоксифена для профилактики развития инвазивного РМЖ у пациенток, подвергшихся хирургическому лечению по поводу новообразований высокого риска: атипичной протоковой гиперплазии, протоковой карциномы in situ и дольковой карциномы in situ. Тамоксифен в дозе 5 мг в сутки оказался эффективным и безопасным средством снижения риска РМЖ. Однако критерии включения этого важного исследования одновременно хорошо отражают тот факт, что, согласно современным представлениям, атипичная протоковая гиперплазия, наряду с дольковой и протоковой карциномой in situ, как раз является тем самым «предраковым» состоянием, которого так опасаются врачи и пациенты.
Само используемое сегодня определение «доброкачественные дисплазии» строится через отрицание. Мы пытаемся определить предмет через то, чем он не является. Платон определил человека как «двуногое без перьев». Тогда его современник Диоген, собрав учеников, ощипал перед ними петуха и сообщил: «Вот вам человек по Платону». В своей неточности Платон ушел бы гораздо дальше, попытайся он определить человека как нечто, не являющееся, например, петухом. Мы определяем доброкачественные процессы как то, что не является злокачественным процессом. В результате формируется гетерогенная категория, включающая как совершенно безобидные и клинически незначимые изменения, так и состояния, ассоциированные с высокой частотой развития РМЖ. В связи с этим представляется целесообразным использовать модифицированную классификацию Dupont-Page, воспроизведенную в работах Hartmann (NEJM, 2005), McEvoy и King.
Подобное разделение «доброкачественных дисплазий» позволило бы сконцентрировать внимание врачей-клиницистов на наблюдении за пациентами высокого риска и исключить пациентов низкого риска из сферы внимания. При внедрении данной классификации в клиническую практику и при реализации стандартных диагностических алгоритмов в случае определения доброкачественного процесса следует распространять на пациента практики наблюдения за здоровыми индивидами в данной возрастной группе с учетом модифицируемых и немодифицируемых факторов риска. В случае выявления «предракового состояния» следует распространять соответствующие практики лечения (как при злокачественном процессе).
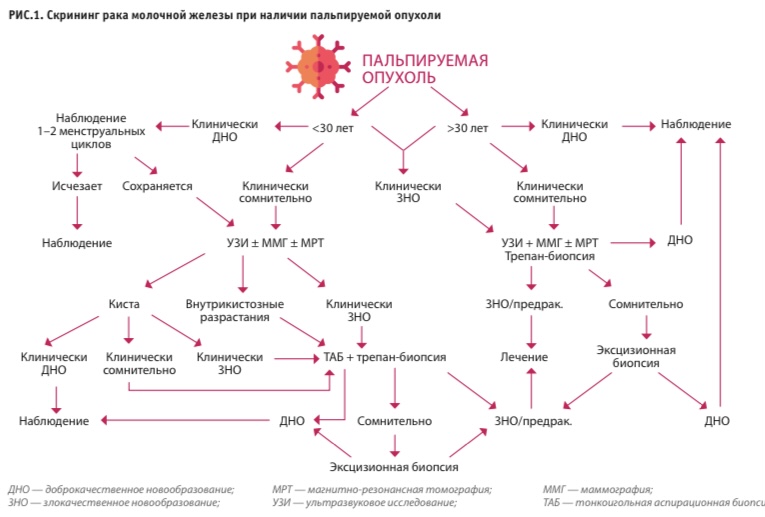
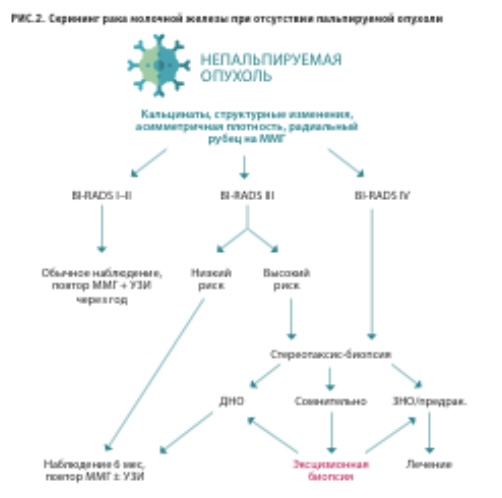
Таким образом, условно доброкачественные процессы, ассоциированные с высоким риском развития РМЖ, существуют. Однако они представляют собой лишь малую толику (4 %) в общей структуре неонкологических заболеваний молочной железы. Кроме того, для выявления этих состояний и обоснованной беседы о рисках с пациентом необходимо получение морфологической картины. Основания для проведения биопсии приведены в алгоритме скрининга рака молочной железы.