Статьи
Пробиотики в терапии аллергической патологии у детей
К.м.н., доцент кафедры педиатрии имени академика Г.Н. Сперанского ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва
Людмила Викторовна Гончарова
Врач педиатрического отделения ГБУЗ «ДГКБ имени З.А. Башляевой» ДЗМ, Москва
Елена Равильевна Радченко
Педиатр, гастроэнтеролог, сотрудник педиатрического отделения отделением ГБУЗ «ДГКБ имени З.А. Башляевой» ДЗМ, Москва
По данным Всемирной организации здравоохранения, аллергическая патология в 33 странах мира составляет 22 %, то есть встречается практически у каждого пятого. За последние 30 лет ее частота возросла до 30 % у взрослых и до 20–30 % у детей, причем у 10 % из них отсутствует аллергический семейный анамнез.
В ПОИСКАХ ПРИЧИНЫ
Переключение иммунного ответа с Th1- на Th2-вариант— это результат сложного взаимодействия генома человека и окружающей среды. Современные методы исследований генома, HLA и специфических генов показали, что у пациентов с бронхиальной астмой (БА), атопическим дерматитом (АтД), пищевой аллергией (ПА) есть множество особенностей, отсутствующих в здоровой популяции. Дополнительное влияние факторов внешней среды (в том числе токсическое), неблагоприятная экология, неконтролируемое использование антисептиков, злоупотребление антибиотиками приводят к стойкому нарушению равновесия микробиоты и изменению иммунного ответа. С конца прошлого века активно обсуждается «гигиеническая гипотеза» развития атопии, согласно которой воспитание ребенка в стерильной среде без воздействия инфекционных агентов, паразитов и симбиотических микроорганизмов ограничивает развитие иммунной системы и в конечном итоге приводит к росту аллергических и аутоиммунных заболеваний.
Ранние бактериологические исследования микробиоты желудочно-кишечного тракта (ЖКТ) у пациентов с аллергическими заболеваниями (АЗ) показали прямую корреляционную связь дисбиоза с атопической патологией. Это следует из метаанализа 18 клинических рандомизированных исследований, проведенных с 1999 по 2006 год и включавших детей с различными аллергическими состояниями — АтД, БА, ПА, аллергический ринит (АР).
Систематический обзор 21 исследования микробиоты генно-инженерными методами у детей с атопическими заболеваниями, выполненного с 2007 по 2013 год, показал, что группа атопии отличается не только доминирующими штаммами, но и значительно меньшим видовым разнообразием.
В исследовании CHILD 2013 года, проведенном при участии 166 здоровых младенцев в Канаде методом секвенирования 16S рРНК Illumina микробиоты кишечника, было обнаружено нарушение соотношения Enterobacteriaceae / Bacteroidaceae. В группе атопии представители семейства Enterobacteriaceae значительно превышали Bacteroidaceae, что оказалось значимым к возрасту 1 года: пищевая сенсибилизация к одному продукту выявлялась у 7,2 % младенцев уже в первые 3 месяца жизни. По полученным статистическим данным, сохранение нарушенного соотношения Enterobacteriaceae / Bacteroidaceae и низкое видовое разнообразие связаны с двукратным увеличением риска атопии в отдаленной перспективе.
Авторы обнаружили связь атопии со способом родоразрешения и вскармливания. У рожденных обычным путем, находящихся на грудном вскармливании и не получавших антибактериальную терапию (АБТ), вышеперечисленные риски были ниже. У рожденных вагинально кишечная микробиота была разнообразнее, что связано со снижением риска пищевой сенсибилизации на 55 % к 1 году. Изменения в составе микробиоты и ее метаболической активности влияют не только на риск сенсибилизации и реализации атопических заболеваний, но и на возникновение патологии других органов и систем.
ИЗМЕНЕНИЯ МИКРОБИОТЫ
Сложное взаимовлияние дисбиоза кишечника и развития атопических заболеваний напрямую связано с нарушением муцинового пристеночного слоя, повышенной кишечной проницаемостью и изменением соотношений короткоцепочечных жирных кислот (КЦЖК). Это приводит к изменению иммунного ответа с участием Т-хелперных клеток 2-го типа и низкоактивному воспалению. Активация интерлейкинов (IL-4, -5, -9, -13) играет важную роль в развитии аллергических реакций. Японские исследования пациентов с АР (2018) обнаружили прямую связь между Т-хелперами 2-го типа и сенсибилизацией. Однако использовать иммунные молекулы в терапии или профилактике атопии пока не удается.
Все большее число исследований показывает, что атопичная микробиота служит пусковым механизмом аллергических заболеваний у детей с атопией, изменяя иммунный ответ, сохраняющийся в старшем возрасте.
Изменения в микробиоте у детей с ПА демонстрируют сниженный уровень представителей типов Bacteroidetes, Citrobacter, Clostridium, Dialister, Dorea, Haemophilus, Lactococcus и Oscillospira и повышенное количество представителей Firmicutes Bacteroidaceae, Clostridiaceae, Lachnospiraceae, Leuconostocaceae, Ruminococcaceae и Streptococcaceae с изменением метаболической активности. Снижение уровня бактерий родов Akkermansia, Bacteroides, Bifidobacterium, Faecalibacterium, Lactobacillus и повышение — Gemella и Rhodotorula описано у детей с АтД.
У детей с БА в составе микробиоты кишечника содержится меньше бактерий родов Alistipes, Bacteroides, Bifidobacterium, Collinsella, Dialister, Dorea, Faecalibacterium, Flavonifractor, Roseburia, Veillonella и больше — Escherichia, Gemmiger и Streptococcus. Изменения рода Ruminococcus нестабильны.
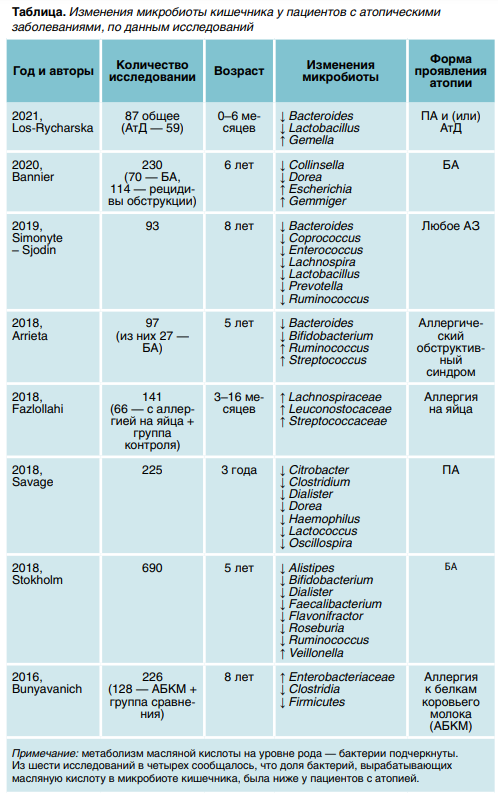
Наиболее часто встречающиеся изменения представителей микробного сообщества кишечника представлены в таблице. Высокий уровень масляной кислоты в просвете кишки значительно уменьшает сенсибилизацию к аллергенам. Низкая концентрация приводит к подавлению дифференцировки наивных Т-клеток в регуляторные Т-клетки (Treg) и является стартом развития аллергических состояний. Выдвинута гипотеза о том, что достаточное количество бактерий с высокой метаболической активностью, которые элементов (MGEs)—последовательностей ДНК, которые могут перемещаться внутри генома.
Экспериментальные исследования показали, что кишечная микробиота имеет большое значение при остром повреждении почек, оказывая нефропротекторное или нейропатогенное действие. Клинически почечное повреждение индуцирует дисбиоз кишечника с нарушением жизнедеятельности видов E. coli, Bacteroidetes, Bifidobacterium, Salmonella, Lactobacillus, Clostridium, Ruminococcus, Rothia, Staphylococcus, Enterobacter, Faecalibacterium, Lachnospiraceae и др.
Дисбиоз кишечника также приводит к развитию воспаления в тканях и, как следствие, к повышенной кишечной проницаемости. Упомянутые выше факторы играют решающую роль в рецидивировании ИМП. В свою очередь, использование пробиотических препаратов и растительных уросептиков сокращает длительность применения антимикробных средств (АБР и уросептиков), что снижает вероятность формирования резистентности и отрицательного влияния на состав микробиоты. Известна антимикробная активность следующих веществ, содержащихся в траве розмарина: розмариновая, карнозиновая, кофейная кислоты; карнозол. В эксперименте было показано, что эфирное масло розмарина в 86,3 % случаев способно подавлять рост биопленок, выделенных у пациентов с ИМП в возрасте от 2 месяцев до 90 лет. Продемонстрировано также повышение чувствительности E. coli к цефтазидиму и цефтриаксону при сочетанном применении с экстрактом розмарина.
В мочевыделительной системе присутствует множество естественных компонентов иммунной системы, включая разнообразные классы антимикробных пептидов (АМП) и других белков с антимикробной активностью. АМП не только обладают противомикробным эффектом, но и сами по себе являются многофункциональными факторами иммунной защиты. Их универсальные механизмы действия на различные возбудители, свойство модулировать иммунный ответ, а также неспособность микроорганизмов формировать факторы резистентности по отношению к АМП создают перспективу использования препаратов в качестве альтернативы АБП, что требует дальнейшего изучения. Противоинфекционная защита иммунной системы непосредственно связана с присутствием нормальной микробиоты слизистых оболочек и кишечника.
Создание новых препаратов на основе естественных АМП имеет ряд недостатков, включая высокую стоимость синтеза и исследований их безопасности и эффективности, снижение активности АМП под действием солей, протеолитических ферментов, изменчивости рH, возможные аллергические реакции при их использовании, а также некоторые сопутствующие биологические эффекты, такие как ангиогенез. Тем не менее ряд препаратов на основе АМП сейчас проходят II и III фазы клинических исследований.
Резистентность к АБП продолжает оставаться актуальной и сложной проблемой, но развитие технологий секвенирования микробиома мочи, разработка альтернативных методов лечения дают возможность применить индивидуальный подход к терапии ИМП и профилактике рецидивов. Необходимо продолжать микробиологический мониторинг, что позволит скорректировать действующие клинические рекомендации и подходы к терапии с учетом индивидуальных особенностей пациента и региона проживания.
Список литературы находится в редакции
Читайте также
- Редкие нарушения липидного обмена — ситостеролемия
- Глютензависимые заболевания: классификация и основы патогенеза
- Современные технологии мониторинга углеводного обмена у детей с сахарным диабетом 1 типа
- Значение генетического исследования церебрального паралича
- Менингококковая инфекция: современные вызовы и решения
- Лечение инфекций мочевыводящих путей

















