Статьи
Суперантитела беременности: защита
Основной причиной неонатальной смертности остается инфекция. Хотя антитела в целом ограждают от нее, они обеспечивают ограниченную защиту от патогенов внутри клеток, на которые в первую очередь нацелены Т-лимфоциты. Разделение функций между компонентами адаптивного иммунитета может отчасти объяснять, почему новорожденные, зависящие от трансплацентарного переноса материнских антител, особенно восприимчивы к внутриклеточным инфекциям.
ЗАСЕВШИЕ В КЛЕТКЕ
Внутриклеточную нишу используют многие патогены, вызывающие перинатальную инфекцию, включая грамположительную бактерию Listeria monocytogenes. Она быстро проникает в цитоплазму клетки с помощью порообразующего токсина листериолизина О, после чего распространяется из цитоплазмы одной клетки в другую через специальный белок ActA, который связывается с комплексом Arp2/3 и увеличивает его способность инициировать полимеризацию актина.
Ранее считалось, что компоненты адаптивного иммунитета играют непересекающиеся роли в антимикробной защите хозяина: антитела нацелены на патогены во внеклеточной среде, а Т-клетки отвечают за устранение внутриклеточных возбудителей инфекций. Фундаментальный иммунологический принцип, согласно которому гуморальный и клеточно-опосредованный адаптивный иммунитет выполняет разные функции, в значительной степени основан на экспериментах по инфицированию Listeria monocytogenes. Они продемонстрировали, что реконвалесцентная сыворотка от мышей с разрешившейся инфекцией не может обеспечить защиту интактным мышам-реципиентам, в то время как защита легко передается с помощью донорских спленоцитов, содержащих Т-клетки.
В то же время исследования пассивного переноса адаптивного иммунитета исключительно с использованием взрослых животных, вероятно, имеют ограниченное отношение к уникальной восприимчивости новорожденных к инфекции. При рассмотрении диады «мать — плод» как объединенной иммунологической единицы в едином биологическом контексте, в котором иммунные компоненты естественным образом передаются между индивидуумами, обнаруживается неожиданная защитная роль Listeria monocytogenesспецифических антител. Расширенный объем опосредованной антителами защиты, вероятно, особенно важен в неонатальном периоде с формирующимся Т-клеточно-опосредованным иммунитетом. Так, исследователи из медицинского центра Детской больницы Цинциннати (США) опубликовали результаты научной работы в журнале Nature, в которой четко показали, как состояние беременности обеспечивает реализацию защитных функций антител от внутриклеточной инфекции.
Исследование продемонстрировало, что индуцированные беременностью посттрансляционные модификации антител позволяют материнским антителам защищать младенцев от листериозной внутриклеточной инфекции. На основании этого открытия могут быть разработаны новые лекарства для терапии различных заболеваний и усовершенствованы вакцины для предотвращения инфекций, имитирующие суперантитела, вырабатывающиеся у женщин во время беременности. В течение многих лет считалось, что антитела не могут попасть внутрь клеток. Однако полученные данные свидетельствуют о том, что беременность изменяет структуру некоторых сахаров, прикрепленных к антителам, что позволяет им проникать внутрь клеток и защищать ребенка от более широкого спектра патогенов.
СУПЕРВОЗМОЖНОСТИ АНТИТЕЛ
Используя такие методы, как масс-спектрометрия, исследовательская группа сначала сравнила ключевые биохимические различия антител между беременными и небеременными мышами, таким образом определив, какие конкретные модификации гликозилированных цепей антител имеют место во время беременности и как и когда эти изменения происходят (рис. 1). Ключевым отличием Listeria monocytogenes-праймированных иммуноглобулинов G (IgG) является способность становиться защитными после деацетилирования N-гликановой сиаловой кислоты.
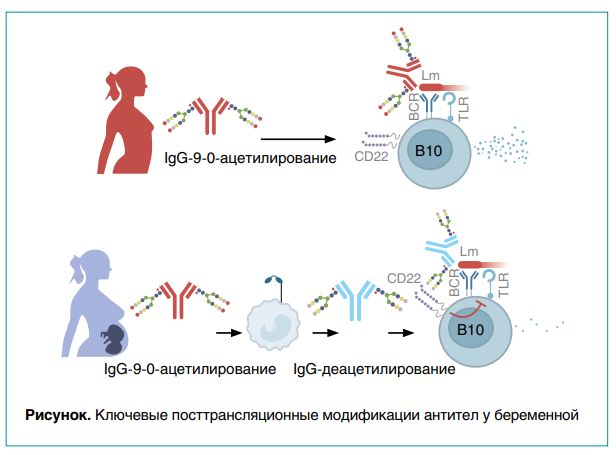
Защита происходит несмотря на низкий уровень вертикального переноса поликлональных материнских антител. Поэтому она действует посредством механизмов, отличных от тех, которые ранее были показаны для нейтрализации клонов моноклональных антител против порообразующего токсина листериолизина O, которые защищают только при очень высоком титре.
Действительно, ферментативно деацетилированный IgG во время беременности и ex vivo защищает от Listeria monocytogenes за счет взаимодействия сиаловой кислоты Fab-области с Siglec CD22, который негативно регулирует трансмембранную передачу сигналов В-клетками через BCR и TLR путем привлечения внутриклеточных фосфатаз SHP-1 и SHIP. Ранее было показано, что IgM и IgG, содержащие сиалированные N-гликаны, связываются с CD22 на В-клетках. Таким образом, взаимодействие с сиалилированными антителами, вероятно, зависит от кластеризации рецепторов для увеличения авидности. Важно отметить, что связывание CD22 с сиалированными лигандами равномерно подавляется ацетилированием. Это согласуется с результатами исследований, демонстрирующими, что анти-Listeria monocytogenes IgG от небеременных самок и гликоинженерный vIgG, экспрессирующий 9-O-ацетилированную сиаловую кислоту, не обладают защитным действием.
Показано, что CD22 избирательно ингибирует продукцию IL-10 В-клетками, которые, как известно, способствуют восприимчивости к Listeria monocytogenes. Клетки B10 представляют собой регуляторную подгруппу клеток B-1a и активируются посредством взаимодействий BCR или TLR31. Результаты подавления активации деацетилированным IgG согласуются с ингибированием CD22 этих активирующих рецепторов. Listeria monocytogenesспецифический IgG может связывать активирующие рецепторы B10 и CD22 через двухвалентный IgG, одновременно связывая Listeria monocytogenes и CD22 через деацетилированную Fab-сиаловую кислоту. Следовательно, ключевая адаптация, используемая Listeria monocytogenes для уклонения от антител, заключается в активации клеток B10, поскольку IL-10 подавляет бактерицидную активность макрофагов и других антигенпрезентирующих клеток.
Эти результаты фундаментально расширяют механизмы защиты, опосредованной антителами, включая внутриклеточные патогены, которые, как ранее считалось, в первую очередь зависят от внеклеточной нейтрализации или связывания Fc-рецепторов. Таким образом, в исследовании определено, что ацетилированная форма сиаловой кислоты переходит в деацетилированную. Это очень тонкое молекулярное изменение позволяет иммуноглобулину G—наиболее распространенному в организме типу антител — брать на себя расширенную защитную роль, стимулируя иммунитет через рецепторы, которые реагируют именно на деацетилированные сахара. Это изменение является тем переключателем, который позволяет материнским антителам защищать младенцев от возбудителей инфекций внутри клеток, см. рисунок.
Дальнейшие исследования показали, что это изменение было вызвано ацетилэстеразой сиаловой кислоты (SIAE), которая естественным образом экспрессируется во время беременности. Кроме того, авторы успешно восстановили утраченную иммунную защиту, снабдив искусственно созданными антителами детенышей от здоровых беременных мышей, которые были генетически модифицированы и лишены способности удалять ацетилирование из антител для усиления защиты.
НОВЫЕ ВОПРОСЫ
Ацетилирование сиаловой кислоты также снижает активность нейраминидаз, что может не только точно регулировать время жизни антител, но и оптимизировать эмбриогенез, поскольку форсированная экспрессия ферментов, деацетилирующих сиаловую кислоту, у мышей связана с тканеспецифическими дефектами развития. Экспансия материнских В-клеток с фетальной специфичностью активно подавляется с помощью CD22 во время беременности у мышей, а повышенная плацентарная экспрессия SIAE при осложнениях беременности у человека, таких как преэклампсия, в совокупности предполагает, что модуляция ацетилирования сиаловой кислоты может способствовать иммунологической толерантности в системе «мать — плод». Ацетилированная сиаловая кислота также является мишенью для нескольких вирусных белков прикрепления, и, следовательно, активация SIAE во время беременности может снизить восприимчивость к инфекциям. Важные области для будущих исследований включают оценку того, как SIAE и рецепторы сиаловой кислоты контролируют развитие, и наоборот — как экспрессия этих молекул регулируется в процессе развития.
Сегодня Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) одобрило более 200 препаратов моноклональных антител для лечения различных заболеваний, включая онкологические и аутоиммунные, рассеянный склероз и рефрактерные вирусные и бактериальные инфекции, в том числе COVID-19. Кроме того, многие другие моноклональные антитела проходят клинические испытания, некоторые из них не показали сильного терапевтического эффекта.
Молекулярные изменения в антителах, которые естественным образом происходят во время беременности, можно широко использовать для модификации того, как антитела стимулируют иммунную систему, чтобы точно настроить ее эффекты. Это может привести к оптимизации лечения инфекций, вызванных другими внутриклеточными патогенами, включая вирус иммунодефицита человека (ВИЧ) и респираторносинцитиальный вирус (РСВ). Кроме того, эти результаты подчеркивают важность вакцинации женщин детородного возраста, поскольку они смогут передавать антитела своим детям через грудное молоко, что делает их пассивно невосприимчивыми к инфекции.
В целом исследование ломает прежние представления и доказывает, что материнские антитела также могут защищать новорожденных от внутриклеточных инфекций, прокладывая путь к революционным новым методам лечения, которые помогут специфически управлять инфекциями у беременных и новорожденных. В то же время эти результаты будут иметь далеко идущие последствия для терапии антителами и в других областях медицины.

















