Статьи
«Диабет полтора» — вы с ним еще не знакомы?
С 2022 года под руководством академика РАН Марины Владимировны Шестаковой, директора Института диабета «НМИЦ эндокринологии» Минздрава России, ведутся приоритетные исследо‑ вания с использованием метода секвенирования РНК одиночных клеток по поиску молекулярных маркеров, специфичных для латентного аутоиммунного сахарного диабета взрослых (LADA). О дан‑ ной работе и международных рекомендациях по ведению пациентов рассказал один из ее участ‑ ников—аспирант ГНЦ «НМИЦ эндокринологии» Минздрава России Иван Иванович Голодников.
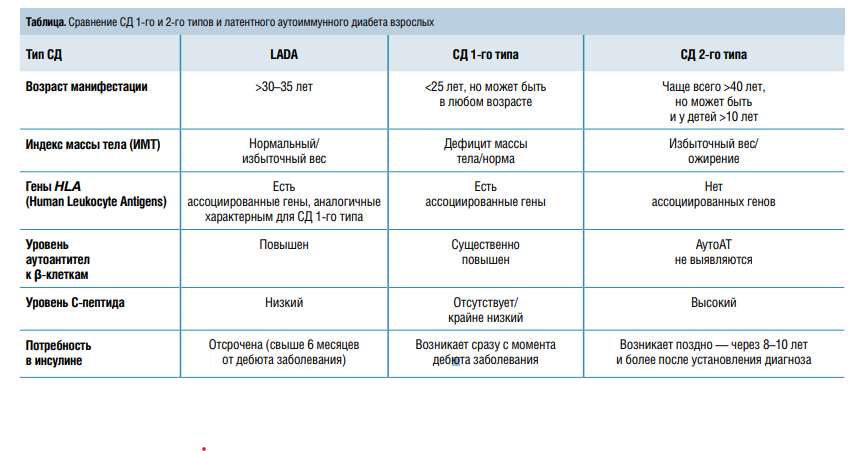
— LADA имеет ряд особенностей, которые по отдельности характерны только для классических вариантов сахарного диабета (СД) 1-го и 2-го типа. У данных пациентов выявляются аутоантитела (АТ) к β-клеткам, аналогичные таковым при СД 1-го типа, но, как правило, в меньшем титре. Преимущественно это АТ к глутаматдекарбоксилазе (GAD). Но в то же время у больных с LADA есть признаки метаболического синдрома (МС) — избыточная масса тела и артериальная гипертония (АГ), что более характерно для СД 2-го типа.
Кроме того, в дебюте LADA наблюдается относительно сохранный уровень С-пептида— маркера секреции инсулина поджелудочной железой. По содержанию С-пептида можно понять, насколько хорошо β-клетки вырабатывают этот гормон и будут ли эффективны таблетированные препараты.
Клиническая же картина LADA на момент установления диагноза сходна с таковой при СД 2-го типа. Однако со временем происходит развитие инсулинозависимости с преобладанием у больного основных характеристик СД 1-го типа, причем в сочетании с инсулинорезистентностью (ИР) и компонентами МС. Вот почему данный тип диабета получил у специалистов неофициальное название «диабет полтора».
— Какую часть всех пациентов с СД составляют страдающие LADA?
— Это 10–12 % всех больных с СД 2-го типа или около 5 %—с СД 1-го типа, что делает актуальным изучение этиологии и патогенеза данного заболевания.
В 2022 г. Международное общество по диабету у детей и подростков официально утвердило выделение четырех этапов развития СД 1-го типа. Однако в том же году W. Yin и коллеги дополнили эти четыре этапа еще двумя. Всего получилось шесть ступеней развития LADA:
1. Унаследованные генетические особенности организма.
2. Триггерное событие, запускающее старт болезни.
3. Множественные АТ к островковым клеткам поджелудочной железы при все еще нормальном уровне глюкозы в крови и бессимптомном течении.
4. Множественные островковые АТ, нарушенная толерантность к глюкозе, диагностические критерии СД еще не достигнуты.
5. Уровень глюкозы в крови соответствует диагностическим критериям СД.
6. Длительно текущий СД.
К сожалению, в развитых странах, причем и в практике московской эндокринологической службы тоже, встреча врача и пациента обычно случается лишь на пятом этапе нарушенного метаболизма глюкозы, когда потеряно уже более 70 % β-клеток. Однако на этапе нарушенного метаболизма глюкозы функция β-клеток еще относительно сохранна, благодаря чему определяется низконормальный уровень С-пептида. Эффективна и таблетированная сахароснижающая терапия. Но, в отличие от СД 1-го типа с его стремительным развитием, для LADA характерен период, позволяющий обходиться без инсулина как минимум 6 месяцев.
— Как диагностируется LADA?
— Как в мире, так и в России отсутствуют конкретные диагностические критерии, одобренные Российской ассоциацией эндокринологов, Американской диабетической ассоциацией (ADA) и Европейской ассоциацией по изучению диабета (EASD). Причем наибольшее распространение получили три основных диагностических критерия LADA, предложенные международным Обществом по иммунологии диабета:
• возраст старше 35 лет;
• положительные антитела к β-клеткам;
• отсутствие потребности в инсулинотерапии в течение как минимум первых 6 месяцев после установления диагноза СД.
Однако данная методика диагностики имеет недостаток — необходимость проведения дорогого тестирования на АТ к β-клеткам. То есть для дифференциальной диагностики между LADA и СД 2-го типа необходимы существенные затраты—массовое определение АТ к β-клеткам у всех пациентов с СД 2-го типа. Реализовать такое в рамках бюджетного финансирования не получится. Однако решение проблемы возможно благодаря современным молекулярно-генетическим технологиям. Так, например, под руководством академика РАН, профессора Марины Владимировны Шестаковой на базе «НМИЦ эндокринологии» Минздрава России с 2022 года активно ведутся приоритетные исследования с использованием метода секвенирования РНК одиночных клеток (scRNAseq).
В данном проекте я отвечаю за набор пациентов и выделение мононуклеров периферической крови для проведения секвенирования на последующих этапах. Метод позволяет исследовать экспрессию генов на уровне отдельных клеток, что открывает новые перспективы для выявления молекулярных маркеров, специфичных для LADA. Такие маркеры могут использоваться для более точной и доступной диагностики. Это вопрос не совсем близкого, но уже обозримого будущего. Правда, помимо выявления маркеров необходимо разработать и генетическую панель для их идентификации. И вот тогда LADA можно будет диагностировать без тестирования на АТ к β-клеткам.
Использование scRNAseq позволит выявлять новые молекулярные мишени и гены, которые укажут на LADA с высокой точностью. А значит, не только сделает более доступной диагностику, но и откроет путь к разработке новых подходов к лечению и профилактике данного заболевания. В результате улучшится качество жизни пациентов и снизится экономическая нагрузка на систему здравоохранения.
Другим перспективным методом стратификации риска LADA у пациентов с СД 2-го типа является разработка алгоритма или калькулятора, который бы позволил отличать больных с высоким риском LADA и необходимостью тестирования на АТ к β-клеткам. Наибольшие успехи в данном направлении сделаны в Китае. В 2021 году Z.Wang и коллеги разработали прогностическую модель определения вероятности LADA у пациентов с впервые выявленным СД 2-го типа. Полученная китайскими коллегами формула позволяет предсказывать LADA с чувствительностью 79 % и специфичностью 68 %. Однако применение этой модели несколько ограничивает необходимость проведения перорального глюкозотолерантного теста, что, например, нецелесообразно у пациентов в отделении интенсивной терапии при впервые выявленном диабете. Необходимы новые исследования по разработке прогностических моделей с упрощенными параметрами.
— Как отличить LADA от СД 1‑го типа?
— Для LADA, как и для СД 1-го типа, характерно наличие АТ к GAD, тирозинфосфатазе (IA-2), островковым клеткам (ICA), инсулину (IAA), транспортеру цинка (ZnT8) в сочетании или по отдельности. АТ к GAD — наиболее чувствительные маркеры как СД 1-го типа у взрослых, так и LADA. А вот уровень АТ к IAA, IA-2 и ZnT8, выявляемых у более молодых пациентов с СД 1-го типа, повышен только у небольшой части больных LADA.
Авторы исследования Action LADA продемонстрировали, что при скрининге на АТ к GAD последние обнаруживаются у 69 % пациентов, а к остальным антигенам — не более чем в 10 % случаев. К тому же для СД 1-го типа и LADA характерны общие изменения ткани поджелудочной железы на микроскопическом уровне. Так, в одном из исследований при участии 25 пациентов с аутоиммунным СД (16 из них с СД 1-го типа, 9 — с LADA) и 13 пациентов из группы контроля (6—с СД 2-го типа, 7 — с раком поджелудочной железы) была проведена сцинтиграфия для оценки наличия инсулита, то есть воспаления ткани островков Лангерганса. Оно было выявлено только у пациентов с аутоиммунными разновидностями диабета—при СД 1-го типа и LADA. При этом у страдающих раком поджелудочной железы или СД 2-го типа островковые клетки не были воспалены. Таким образом, инсулит выступает в роли одного из общих признаков СД 1-го типа и LADA.
— Как проводится дифференциальная диагностика LADA и СД 2‑го типа?
— Дело в том, что ИР лежит в основе не только СД 2-го типа, но и частично LADA, который также ассоциирован с избыточным весом, ожирением, низкой массой тела при рождении, злоупотреблением сладкой пищей. Сниженный же риск этого заболевания ассоциирован с высокой физической активностью и умеренным употреблением сладкого. Но в случае LADA эти ассоциации оказываются заметно слабее, чем при СД 2-го типа, что логично. Ведь ИР имеет меньшее значение для развития LADA, чем прогрессирование аутоиммунного процесса и дефицит инсулина. У пациентов с LADA компоненты МС (АГ, дислипидемия, увеличенная окружность талии и бедер) встречаются реже, чем при СД 2-го типа, но чаще, чем при СД 1-го типа. Для больных СД 2-го типа не характерно наличие АТ к β-клеткам (табл.).
— Каковы генетические особенности LADA?
— Генетические факторы играют важную роль в его развитии. Последние исследования восприимчивости к LADA, выполненные для полногеномного поиска ассоциаций (позволяющего определить связь между вариантами генов и фенотипом), в основном базируются на системе человеческого лейкоцитарного антигена (HLA) и нескольких генах, ответственных за адаптивный и врожденный иммунитет.
Наибольшее значение имеют гены системы HLA (главного комплекса гистосовместимости — MHC). Они кодируют поверхностные клеточные белки, ответственные за регуляцию иммунного ответа. Комплекс гистосовместимости представлен тремя классами генов — I, II и III. Наибольший вклад в развитие аутоиммунных заболеваний вносит MHC II, роль которого состоит в представлении антигенов Т-лимфоцитам. Это приводит к увеличению количества Т-хелперов (CD4+T-клеток), стимулирующих В-лимфоциты к выработке АТ к специфическому антигену.
Для LADA и СД 1-го типа уже выявлен ряд общих предрасполагающих генов. Это группа HLA: HLA-DRB1, HLA-DQA1 и HLA-DQB1. Но также уже известны гены, активность которых характерна только для LADA либо СД 1-го типа. Становятся более понятными варианты генотипов, ассоциированных с риском развития LADA или СД 1-го типа у китайцев, европейцев и других этнических групп. В целом перечисленные выше гены главного комплекса гистосовместимости играют важную роль в риске развития LADA. Их дальнейшее изучение может обеспечить лучшее понимание патогенеза этой болезни. А обнаружение новых ассоциированных полиморфизмов МНС у человека улучшит диагностику и лечение заболевания.
— Есть ли у LADA иммунологические особенности?
— Основной проблемой иммунологии как науки является проблема распознавания. Нарушение механизма распознавания «свой — чужой» является фундаментом развития аутоиммунного процесса. Считается, что оно связано с адаптивным иммунитетом, функциями Т- и В-клеток, а также комплексом «антиген—антитело». Однако, по последним данным, в развитии аутоиммунных заболеваний важную роль играет врожденный иммунитет и даже представители кишечной микробиоты, взаимодействующие друг с другом. Причем LADA не является исключением.
Итак, если мы говорим об адаптивном иммунитете, то основой развития LADA сегодня считается изменение фенотипа, функций и механизмов регуляции активности Т-лимфоцитов с поверхностными маркерами CD4+ и CD8+, а также В-лимфоцитов с маркерами CD20+ и СD19+. Развитие аутоиммунной реакции, а соответственно, и прогрессирование LADA происходят следующим образом. После взаимодействия с аутоантигенами β-клеток Т-лимфоциты мигрируют в лимфатические узлы. Причем этот процесс происходит с участием MHC–II. В лимфоцитах осуществляется клональная селекция и образование из наивных активированных Т-лимфоцитов клеток с набором специфических АТ.
У пациентов с LADA число аутореактивных CD8+Т-клеток, непосредственно повреждающих клетки поджелудочной железы, снижено по сравнению с таковым у больных СД 1-го типа. Предполагается, что это и есть одна из причин разного темпа деструкции β-клеток и скорости потери их функциональной активности. В ткани поджелудочной железы пациентов с LADA также обнаружены уже названные выше CD4+Т-клетки, они же Т-хелперы. Одна из их функций заключается в продукции интерлейкинов-2 и -10, а также других факторов воспаления. Активация CD4+Т-клеток ведет к рекрутированию провоспалительных макрофагов М1 и усилению эффекта CD8+Т-клеток. Примечательно, что количество CD4+Т-клеток у пациентов с LADA ниже, чем при СД 1-го типа, но выше, чем у здоровых людей.
— Как лечится LADA?
— В 2020 г. обе организации — ADA и EASD — опубликовали международный «Консенсус по ведению LADA у взрослых». В основу этого документа была положена градация выбора стартовой терапии по уровню С-пептида, определяющего функцию β-клеток:
• менее 0,3 нмоль/л — инсулинотерапия (базальный инсулин и/или болюс);
• более 0,7 нмоль/л — ведение согласно действующим алгоритмам по СД 2-го типа;
• ≥0,3 и ≤0,7 нмоль/л — серая зона, рекомендуется назначать метформин и каждые 6 месяцев переоценивать уровень С-пептида, избегая препаратов группы сульфонилмочевины.
Данная схема терапии учитывает сходство фенотипа пациентов с LADA и СД 2-го типа — например, возможное наличие компонентов МС, сходного уровня сердечнососудистых рисков, хронической болезни почек и сердечной недостаточности.
Подробнее ознакомиться с алгоритмами сахароснижающей терапии у пациентов с LADA, страдающих кардиологической и нефрологической патологией, можно в публикации Рафаэлы Буйтти и ее коллег «Лечение латентного аутоиммунного диабета у взрослых: согласованное заявление Международной экспертной группы» (Buzzetti R, Tuomi T, Mauricio D, et al. Management of latent autoimmune diabetes in adults: A consensus statement from an international expert panel. Diabetes. 2020;69(10):2037–2047. https://doi.org/10.2337/dbi20–0017).
Надеюсь, что наши знания о молекулярногенетических особенностях этой болезни помогут ввести в комплексную терапию LADA новые препараты, в том числе моноклональные антитела (МкА). Это перспективное направление в лечении аутоиммунных заболеваний, включая LADA и СД 1-го типа, ведь подобные лекарства нацелены на ключевые компоненты иммунной системы, ответственные за разрушение β-клеток. Некоторые из МкА уже прошли клинические испытания с обнадеживающими результатами у пациентов с LADA. Я бы начал с теплизумаба — моноклонального АТ, направленного против CD3-рецепторов на Т-лимфоцитах. CD3— важная молекулярная структура, участвующая в активации Т-клеток. Теплизумаб блокирует эту активацию, что приводит к подавлению аутоиммунного ответа против β-клеток. Теплизумаб продемонстрировал способность задерживать прогрессирование болезни и необходимость инсулинотерапии у пациентов с высоким риском развития инсулинозависимости (подробнее об этом можно узнать из интервью профессора М.Б. Анциферова для нашей газеты «Можно ли говорить о революцинном прорыве в диабетологии?» № 1/2023, стр. 1, https://www.medvedomosti.media/articles/mozhno-li-govorit-o-revolyutsionnomproryve-v-diabetologii/?sphrase_id=396121). Однако подобных исследований для LADA не проводилось.
Интересен и МкА абатацепт — иммуномодулятор, направленный на нарушение непрерывного цикла активации T-клеток, что приводит к предотвращению их активности. Абатацепт показал положительные результаты в ранних клинических исследованиях при лечении пациентов с LADA — в частности, замедление прогрессирования аутоиммунного процесса. Хотя препарат в основном используется для лечения ревматоидного артрита, его эффективность при LADA продолжает изучаться.
Еще один препарат в этом ряду — ритуксимаб, МкА против CD20 (В-лимфоцитарного антигена, белка-корецептора на поверхности В-лимфоцитов), которое селективно уничтожает В-лимфоциты, играющие важную роль в продукции аутоАТ, что делает их мишенью при аутоиммунных заболеваниях, включая LADA. Ритуксимаб уже показал свою эффективность при лечении СД 1-го типа в некоторых исследованиях. Однако его применение при LADA до сих пор не изучено. Еще одно МкА — голимумаб, ингибитор фактора некроза опухоли альфа (TNF-α), который играет ключевую роль в воспалительных и аутоиммунных процессах. Голимумаб показал эффективность в снижении воспалительных процессов и замедлении разрушения β-клеток у пациентов с аутоиммунным СД. Препарат был исследован для применения при СД 1-го типа и теоретически может быть эффективным при LADA.
К инновационным средствам относятся антагонисты интерлейкина-21 (IL-21). Данный цитокин играет важную роль в активации как Т-, так и В-клеток. Это делает его важной мишенью при лечении аутоиммунных заболеваний, например LADA. МкА, блокирующие IL-21, показали перспективные результаты в клинических исследованиях при СД 1-го типа. Предполагается, что использование антагонистов IL-21 у пациентов с LADA тоже замедлит разрушение β-клеток, сохраняя их функциональность. Препарат под названием NNC0114–0006, ингибирующий IL-21, находится на стадии клинических испытаний. Он уже продемонстрировал безопасность и эффективность в замедлении СД 1-го типа, однако пока еще не введен в клиническую практику.
— Как бы вы оценили успешность борьбы с LADA московской эндокринологической службы?
— Cудя по данным литературы, клинические проблемы, возникающие при лечении LADA у московских эндокринологов, те же, что и у их коллег из западных стран. Да и распространенность LADA как в России в целом, так и в Москве сходна с таковой в других промышленно развитых странах с хорошей медициной.
А это значит, что диагностическая зоркость как показатель профессионализма наших и зарубежных эндокринологов в распознавании этого крайне сложного в диагностике заболевания сопоставима. Вот почему я предположил бы, что и качество терапии там и тут примерно одинаково.
— Какая проблема в борьбе с LADA наи‑ более актуальна и как с ней справиться?
— Самая большая проблема — поставить диагноз LADA. Я бы посоветовал коллегам всегда настороженно относиться к любому нетипичному течению СД и заблаговременно предупреждать пациентов о необходимости более тщательного самоконтроля глюкозы и регулярных визитов к эндокринологу.
Читайте также
- Флеш-мониторинг глюкозы в диагностике инсулиномы
- Витамин D как инструмент регуляции метаболических процессов
- Современные тенденции в самоконтроле гликемии при управлении сахарным диабетом
- Пищевые эксцессы, ожирение и сахарный диабет
- Путеводитель по миру дженериков
- Междисциплинарный подход к лечению пациентов с сахарным диабетом

















