Статьи
Диабетическая полинейропатия: мифы и реальность
 Для диабетической периферической нейропатии (ДПН) характерны нарушения функции периферических нервов у больных СД после исключения других причин. Говоря о частоте данного осложнения, мы сталкиваемся с первым мифом о ДПН, а именно — что она встречается у 80–90 % пациентов с СД. Но это далеко не так: распространенность ДПН варьирует от 28 % до 60 % в зависимости от исследуемой выборки и методов диагностики.
Для диабетической периферической нейропатии (ДПН) характерны нарушения функции периферических нервов у больных СД после исключения других причин. Говоря о частоте данного осложнения, мы сталкиваемся с первым мифом о ДПН, а именно — что она встречается у 80–90 % пациентов с СД. Но это далеко не так: распространенность ДПН варьирует от 28 % до 60 % в зависимости от исследуемой выборки и методов диагностики.
ФАКТОРЫ РИСКА
Довольно долго считалось, что основные факторы риска ДПН — гипергликемия в сочетании с длительностью СД. Действительно, вероятность развития ДПН повышается на 10–15 % с увеличением уровня гликемии натощак на 1 ммоль/л или HbA1c на 1 %. При этом распространенность ДПН возрастает с 14 % при длительности СД 1 типа не более 5 лет до 44 % — при его длительности свыше 30 лет. Однако появившиеся данные о том, что признаки нейропатии выявляются у людей без диагностированного СД (у 13 % пациентов с нарушением толерантности к глюкозе и у 11,3 % — при гипергликемии натощак), стали причиной поиска дополнительных факторов риска развития ДПН. И они были найдены. К ним (наряду с гипергликемией и большим стажем СД) относятся: висцеральное (центральное) ожирение, артериальная гипертония, дислипидемии. Знание факторов риска осложнения позволяет четко сформулировать меры его профилактики.
КЛЮЧЕВАЯ РОЛЬ
ДПН — это сложная и многофакторная патология. Ключевая роль в ее развитии принадлежит хронической гипергликемии, запускающей каскад биохимических реакций, которые ведут к дегенерации и демиелинизации нервного волокна.
Теории патогенеза ДПН подразделяются на две основные категории: метаболическую и сосудистую.
К метаболическому звену относят активацию полиолового пути обмена глюкозы, оксидативный стресс, неферментное гликирование компонентов клеточных мембран, дефицит миоинозитола, нарушение образования факторов роста нерва.
Сосудистый компонент обусловлен снижением образования оксида азота (обладает вазодилататорными свойствами), а также эндоневральной гипоксией из-за уменьшения гибкости эритроцитов, повышения вязкости крови и эндоневрального давления, образования микротромбов с развитием эндоневрального отека. При этом нарушения метаболизма и кровотока в нервном волокне тесно взаимосвязаны на разных этапах патогенеза.
ПРИЧИНЫ БОЛИ
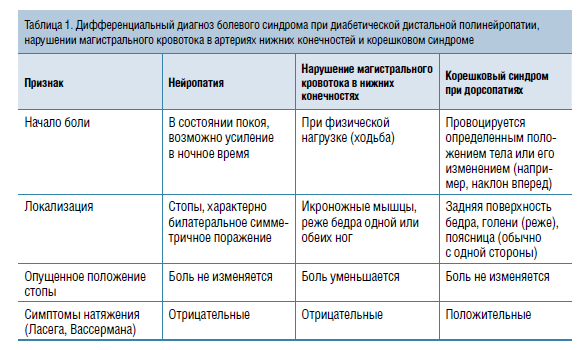
Клинические проявления ДПН во многом зависят от стадии процесса. На ранних этапах симптоматика достаточно яркая. Беспокоят боли, жжение, покалывания, парестезии и т. д. И вот тут приходится сталкиваться с еще одним часто встречающимся заблуждением: любые боли в ногах у пациента с СД — проявление ДПН. Это далеко не так. Список заболеваний, с которыми необходимо дифференцировать болевой синдром при ДПН, довольно внушителен: дорсопатии позвоночника, нарушение магистрального кровотока в артериях ног, продольно-поперечное плоскостопие, варикозное расширение вен нижних конечностей. В табл. 1 отражены отличительные признаки болевого синдрома при ДПН, нарушениях магистрального кровотока и корешковом синдроме при дорсопатиях позвоночника.
Помимо заболеваний с разными проявлениями болевого синдрома существуют нозологии с аналогичной симптоматикой. Например, метаболические нейропатии (алкогольная, вследствие дефицита витамина В) также проявляются дистальными симметричными болями. А значит, у пациента с СД помимо ДПН могут быть и другие причины болевого синдрома. Об этом нужно помнить и тщательно собирать анамнез, чтобы определить источник проблемы и назначить правильное лечение.
АЛГОРИТМ ДИАГНОСТИКИ
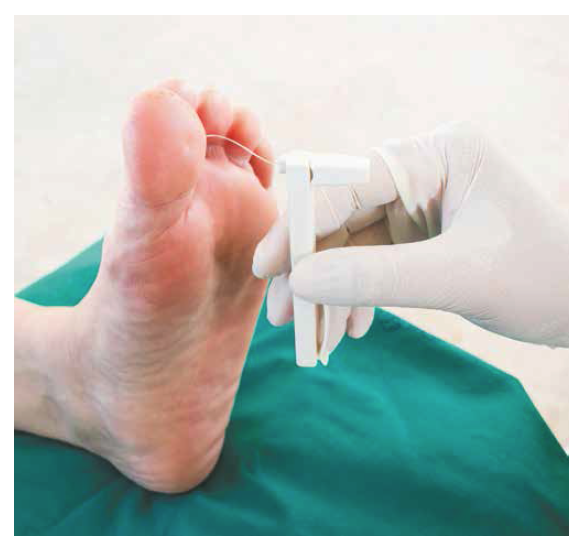
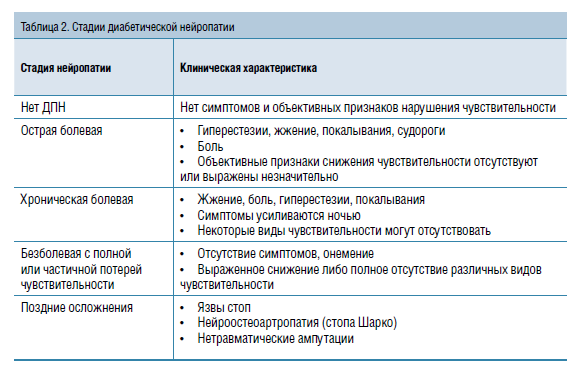
Диагностика ДПН состоит из оценки жалоб, тщательного сбора анамнеза и объективного осмотра с оценкой состояния периферической (тактильной, болевой, температурной и вибрационной) чувствительности при помощи достаточно простых тестов. И здесь мы сталкиваемся с очередным заблуждением. Дело в том, что нередко у пациентов с характерными для ДПН жалобами изменений периферической чувствительности не обнаруживается и диагноз «ДПН», соответственно, им не ставится. Это неправильно, потому что клиническая картина нейропатии, включая жалобы и данные объективного осмотра, зависит от стадии развития осложнения. На ранней превалирует ярко выраженная симптоматика при минимальных или полностью отсутствующих объективных нарушениях чувствительности. Особое беспокойство должны вызывать пациенты с длительным стажем заболевания, не предъявляющие никаких жалоб. Именно у этой категории при осмотре выявляются выраженные нарушения вплоть до потери всех видов чувствительности до уровня колен (табл. 2).
Главная цель оценки различных видов чувствительности — выявить пациентов из группы риска по развитию синдрома диабетической стопы (СДС). Поэтому у каждого пациента с СД вне зависимости от того, предъявляет он жалобы или нет, необходимо производить оценку состояния периферической чувствительности.
ГЛАВНАЯ ЗАДАЧА
Лечебно-профилактические мероприятия при ДПН нужно начать как можно раньше. Два крупнейших проспективных исследования (DCCT Research Group, 1993; UK Prospective Diabetic Study Group, 1998) продемонстрировали, что поддержание контроля углеводного обмена снижает риск микрососудистых осложнений и нейропатии при СД как первого, так и второго типа. Вот почему главным методом лечения и профилактики ДПН в общемировой практике считается обеспечение контроля углеводного обмена, а также воздействие на дополнительные факторы риска развития ДПН.
Лечение ДПН включает средства патогенетической и симптоматической направленности. Цель симптоматической терапии — купировать боль. В качестве стандартной терапии назначают трициклические антидепрессанты (амитриптилин), противосудорожные (габапентин, карбамазепин), анальгетики (трамадол), местные средства (капсикам, капсаицин).
Патогенетическая терапия базируется на воздействии на основные компоненты развития ДПН. В частности, ингибиторы альдозоредуктазы замедляют полиоловый путь обмена глюкозы, снижая тем самым повреждающий эффект побочных продуктов этого вида обмена на течение ДПН. Антиоксиданты, такие как тиоктовая кислота (ТА), воздействуют на содержание свободных радикалов и оксидативный стресс. Факторы роста нерва предотвращают дефицит нейротрофов и аксонального транспорта. Аминогуанидин подавляет гликирование белков нервных окончаний и сосудистой стенки.
Сейчас большинство исследований по оценке эффективности того или иного вида патогенетической терапии на течение ДПН либо остановлены из-за развития побочных эффектов, либо не завершены. Исключение составляют работы по эффективности препаратов тиоктовой (α-липоевой) кислоты (ТК). На долю ее препаратов приходится, пожалуй, наибольшее количество мифов.
БОРЬБА С ОКИСЛИТЕЛЬНЫМ СТРЕССОМ
Окислительный стресс (ОС) возникает в результате ослабления антиоксидантной защиты и повышенной продукции свободных радикалов, активность которых при диабетической нейропатии повышена. К повреждающим воздействиям свободных радикалов относится подавление синтеза оксида азота (NO), что приводит к снижению кровотока в нервном волокне. Кроме того, в результате ОС возникают дефицит нейропептидов и эндотелиальная дисфункция мелких сосудов, снабжающих кровью нервное волокно.
В экспериментальных работах на животных продемонстрировано, что применение тиоктовой кислоты — потенциального липофильного антиоксиданта — предотвращает развитие нейроваскулярных нарушений. Также обнаружилось, что препараты α-липоевой кислоты улучшают утилизацию углеводов, ингибируют глюконеогенез и кетогенез; нормализуют энергетический метаболизм и аксональный транспорт; связывают свободные радикалы и оксиданты, уменьшая тем самым воздействие ОС.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Широкую известность препараты ТК впервые получили после исследования ALADIN (Alpha-Lipoic Acid in Diabetic Neuropathy), которое показало, что прием 600 мг препарата в сутки в виде внутривенных вливаний приводит к достоверному снижению различных симптомов ДПН, включая боль, парестезии, онемение и т. д., по сравнению с плацебо.
В исследовании ALADIN II оценивались эффективность и безопасность продолжительного (в течение 2 лет) использования ТК при пероральном приеме. Четкого ответа на вопрос об эффективности длительного приема препарата получить не удалось, но была доказана безопасность его использования как в дозе 600 мг, так и 1200 мг в сутки. В исследовании ALADIN III сравнивали различные режимы приема ТК: 600 мг внутривенно в течение 3 недель и 1800 мг (600 мг 3 р/сутки) в течение 6 месяцев — по сравнению с плацебо. Продемонстрированы достоверное снижение нейропатических симптомов при внутривенном введении 600 мг ТК в течение 3 недель и тенденция к улучшению при приеме 1800 мг перорально в течение полугода. Однако данные, полученные в пероральном режиме, не имели достоверных отличий от группы плацебо из-за большого числа центров (n = 70), участвовавших в исследовании, и выраженной вариабельности между ними в оценке симптомов нейропатии.
Авторы исследования пришли к выводу, что при длительном пероральном приеме ТК необходимо оценивать не воздействие на симптомы ДПН, а возможность влияния препарата на замедление и прогрессирование нейропатии.
Единственное исследование по оценке эффекта ТК на течение автономной кардиальной нейропатии DEKAN продемонстрировало, что прием 800 мг препарата в сутки перорально в течение 4 месяцев приводит к достоверному улучшению автономной кардиальной нейропатии у больных СД 2 типа по сравнению с плацебо. В исследовании ORPIL доказано, что к достоверному снижению симптомов нейропатии приводят не только внутривенные вливания 600 мг препарата, но и прием 1800 мг перорально в течение 3 недель.
Таким образом, препарат имеет достаточную доказательную базу и может применяться для лечения ДПН. И здесь мы сталкиваемся с одним из самых распространенных мифов о назначении тиоктовой кислоты. Учитывая антиоксидантный механизм действия препарата, его назначают практически всем (!) пациентам с СД в режиме 600 ЕД внутривенно капельно в течение 2 недель независимо от того, есть у больного клинические проявления ДПН или нет. Делать этого не нужно, так как все исследования эффективности и безопасности конкретного режима проводились только у больных с клинически выраженными симптомами ДПН. Пациентов без жалоб на боли, парестезии, жжение и т. д. в исследования не включали.
Еще один миф, сопряженный с предыдущим, касается назначения препарата с целью профилактики или замедления развития осложнений. За такой рекомендацией в случае ДПН должны стоять доказательства, подтверждающие, что прием препарата в конкретной дозировке к этому приводит. Ни одно из исследований не ставило перед собой такую задачу, поэтому назначение ТК с профилактической целью сейчас не имеет под собой никаких оснований.
И, наконец, третий миф касается назначения препарата для лечения язвенных дефектов при СДС. Данная рекомендация не только не имеет никаких подтверждений, но и опасна. Вместо соблюдения режима разгрузки, необходимого при СДС, пациенты ходят в поликлинику на внутривенные капельные вливания препарата, который никогда не оценивался с точки зрения ускорения заживления язвенных дефектов. Таким образом, препараты тиоктовой кислоты не назначаются больным СД без болевой симптоматики вследствие ДПН, с профилактической целью и для лечения язвенных дефектов при СДС. Препарат рекомендуется пациентам с клиническими проявлениями ДПН в виде боли, жжения, парестезий и т. д.
НАЗНАЧЕНИЯ ПО СИТУАЦИИ
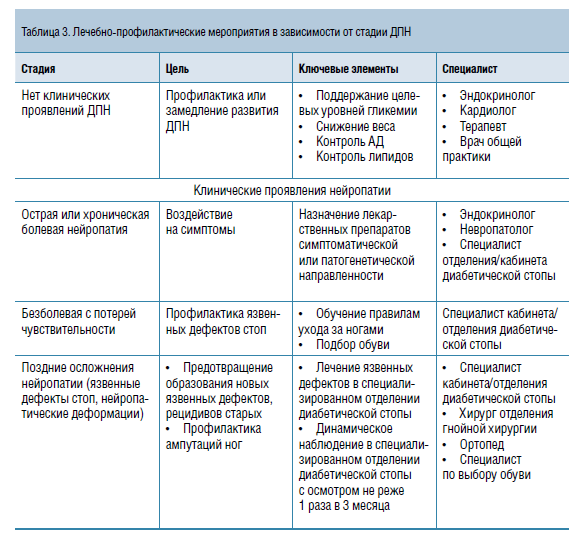
Лечение ДПН должно быть дифференцированным. До появления клинических симптомов и признаков данного осложнения необходимо воздействовать на факторы риска (контроль углеводного обмена, АД, липидов крови, снижение веса). При болевой симптоматике назначают препараты симптоматической или патогенетической направленности вне зависимости от состояния периферической чувствительности. На поздних стадиях основной упор — на профилактику язвенных дефектов и ампутаций (таблица 3).
Читайте также
- Пандемия на эпидемию: сочетание инфекционной и неинфекционной
- Мистер Х эндокринного мира: досье на мелатонин
- Роль сахароснижающих препаратов в предупреждении сосудистых осложнений при сахарном диабете 2 типа
- «Куда, куда вы удалились, весны моей златые дни...»
- Репродуктивное здоровье и старение больных сахарным диабетом
- История одного дома