Статьи
Кардиотоксичность противоопухолевой терапии: факторы риска и меры профилактики
В настоящее время кардиотоксичность рассматривается в качестве наиболее опасного побочного эффекта противоопухолевого лечения, поскольку осложнения, которые она вызывает, могут значительно повысить смертность больных. Возникает ситуация, когда при успешном лечении основного заболевания появляется вероятность развития кардиомиопатии токсического характера, что нередко оказывается причиной не только снижения качества жизни пациента, но и уменьшения ее продолжительности.
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О КАРДИОТОКСИЧНОСТИ
Термин «кардиотоксичность» у онкологических больных включает в себя различные нежелательные явления со стороны сердечно-сосудистой системы на фоне и после проведенного противоопухолевого лечения. Эта проблема в последние годы представляет повышенный интерес как для онкологов, так и для кардиологов. Европейским обществом кардиологов (ESC) в 2016 г. опубликовано позиционное письмо, посвященное теме кардиоваскулярных осложнений у онкологических больных. В 2020 г. изданы практические рекомендации Европейского общества медицинской онкологии (ESMO) по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии. В этих документах суммирована и оценена доказательная база по изучаемому вопросу с целью помощи практикующим врачам в выборе наилучшей стратегии лечения данного состояния в каждом индивидуальном случае.
Отдельные вопросы по предупреждению кардиотоксичности рассматриваются в рекомендациях Российского кардиологического общества (РКО) по профилактике неинфекционных заболеваний, хронической сердечной недостаточности и артериальной гипертензии. Несмотря на то что кардиоваскулярные осложнения возникают как следствие противоопухолевой терапии, врачи-онкологи должны опираться на за- ключения своих коллег-кардиологов. В случаях остро возникших неотложных состояний пациентам прерывают специфическое лечение и переводят их в стационары кардиологического профиля. Помимо этого кардиологи неизбежно сталкиваются с пациентами, которые в прошлом перенесли онкологическое заболевание и не всегда считают необходимым сообщить об этом врачу.
ФАКТОРЫ РИСКА
В отечественной и зарубежной литературе последних лет большое внимание уделяется факторам риска кардиоваскулярных осложнений у онкологических больных. Во многих случаях эти факторы определяют персонализированный подход, а именно объем возможного лечения по поводу онкологического заболевания у конкретного пациента. В нашей стране стратификация риска проводимой противоопухолевой терапии не разработана. За рубежом широко цитируется целесообразность использования в практическом здравоохранении шкалы балльной оценки риска, предложенной J. Herrmann и соавт. (2014 г.), которая отличается простотой, доступностью и может применяться в любом лечебном учреждении (табл. 1). Наиболее высокий риск наблюдается у больных, набравших более 6 баллов.

СЕРДЕЧНО-СОСУДИСТЫЕ ОСЛОЖНЕНИЯ
Эксперты ESC разделяют все сердечно-сосудистые осложнения противораковой терапии на 9 основных категорий (рис.).
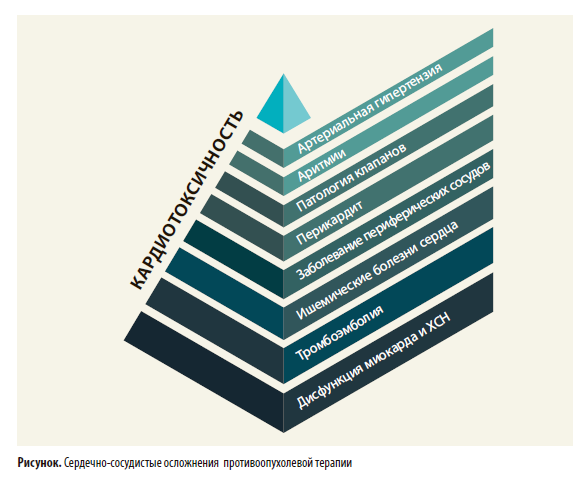
Важно отметить, что некоторые противоопухолевые препараты вызывают побочные эффекты сразу после воздействия, вследствие чего могут негативно повлиять на проведение противораковой терапии, тогда как кардиотоксичность от применения других может проявиться только годы спустя. С увеличением продолжительности жизни пациентов и сроков наблюдения за ними увеличилась выявляемость поздних осложнений химиолучевой терапии. В связи с отсутствием рекомендаций РКО врачам-кардиологам целесообразно придерживаться рекомендаций Российского общества клинической онкологии по поддерживающей и сопроводительной терапии (RUSSCO), в соответствии с которыми до начала противоопухолевой терапии необходимы следующие обследования:
- сбор жалоб с целью выявления симптомов, типичных для сердечной недостаточности (одышка, утомляемость, плохая переносимость нагрузок, отеки нижних конечностей, ортопноэ, сердечная астма), анамнеза (сведения о наличии ИБС, АГ и других сердечно-сосудистых заболеваний и их факторов риска, семейный анамнез);
- физикальное обследование с измерением офисного АД;
- эхокардиография (ЭхоКГ) для оценки фракции выброса (ФВ) левого желудочка (ЛЖ), общей продольной деформации миокарда (GLS) ЛЖ (при доступности метода) и других показателей структурно-функционального состояния сердца;
- магнитно-резонансная томография сердца (МРТ), равновесная изотопная вентрикулография — по показаниям (при недостаточной информативности ЭхоКГ);
- электрокардиография (ЭКГ) в 12 отведениях с расчетом корригированного интервала QT (QTc);
- биохимический анализ крови с определением липидного спектра, глюкозы, креатинина с расчетом клиренса креатинина и / или скорости клубочковой фильтрации (СКФ), калия, натрия, аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), креатинкиназы;
- определение сердечных биомаркеров: тропонина I или Т (предпочтительно высокочувствительного), натрийуретических пептидов (BNP, NT-proBNP), особенно у больных с высоким риском развития дисфункции ЛЖ / сердечной недостаточности.
Кардиотоксичность определяется при уменьшении ФВ ЛЖ более чем на 10 % или до уровня ниже 50 %. Это снижение должно быть подтверждено повторными измерениями через 2–3 нед после первого исследования, выявившего начальное снижение ФВ ЛЖ. Для раннего выявления субклинической дисфункции оптимальным параметром является глобальная продольная деформация. Снижение GLS более 15 % от исходного значения принято считать значимым, а менее 8 % — не значимым. Динамическое наблюдение таким больным следует проводить в соответствии с уровнем риска кардиотоксичности (табл. 2). Эти показатели в настоящее время широко используются в европейских странах. В России применение их желательно, но не является обязательным, несмотря на высокую значимость.
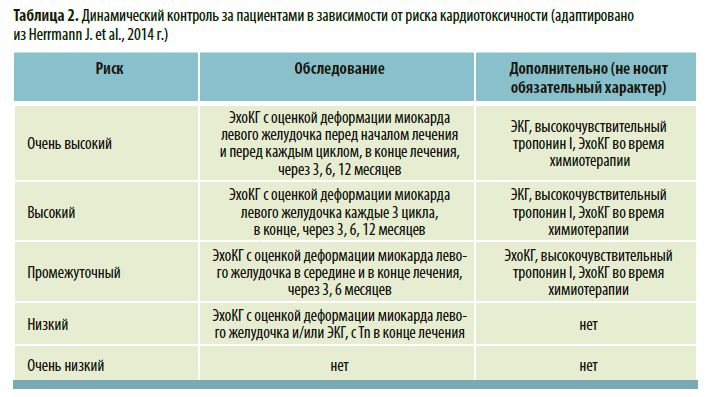
Кроме того, используются лабораторные показатели: предшественник мозгового натрийуретического пептида (NT-proBNP), мозговой натрийуретический пептид (BNP) и высокочувствительный тропонин I (HsTpI).
Согласно имеющимся рекомендациям, профилактические мероприятия и лечение следует проводить как можно раньше. К препаратам с клинически доказанным эффектом относят ингибиторы ангиотензинпревращающего фермента (АПФ), антагонисты рецепторов ангиотензина II, антагонисты минералокортикоидов, статины, дексразоксан (для предупреждения доксорубициновой кардиотоксичности), антитромбоцитарные препараты, антикоагулянты, β-адреноблокаторы. Признана целесообразной комбинация ингибитора АПФ (эналаприл) и ββ-адреноблокатора (карведилол).
Необходимо помнить и о других воз- можных осложнениях противоопухолевой терапии, среди которых одним из наиболее частых является ишемия миокарда. Механизмы, за счет которых данные препараты вызывают это заболевание, различны и варьируют от прямого вазоспастического ответа на повреждение эндотелия, острого артериального тромбоза до отдаленных изменений метаболизма жиров и последующего преждевременного развития атеросклероза.
Артериальная гипертензия также является частым сопутствующим заболеванием у онкологических больных. Помимо возрастных особенностей это обусловлено и прессорным эффектом двух групп широко используемых противоопухолевых препаратов: ингибиторов фактора роста эндотелия сосудов (VEGF) и ингибиторов протеасом. Первая группа препаратов ингибирует образование оксида азота в стенке сосудов, а вторая способствует уменьшению вазодилатации в ответ на действие ацетилхолина, что ведет к вазоконстрикции и вазоспазму.
Нарушения ритма, связанные с лечением онкологических заболеваний, представляют собой сложную проблему, в патогенезе которой участвует множество факторов. Пациенты могут иметь различные виды аритмий сердца, включая синусовую тахикардию, брадиаритмии или тахиаритмии, нарушения проводимости. Удлинение корригированного интервала QT (QTc) может сопровождаться развитием жизнеугрожаемой аритмии — желудочковой тахикардии типа пируэт. В связи с этим длительность интервала QT и факторы риска, его удлиняющие, должны контролироваться до начала лечения, в процессе и после него. Согласно имеющимся рекомендациям, если выявляется удлинение QTc >500 мс или QTc >60 мс от исходного, следует задуматься о прекращении лечения или использовании альтернативных схем терапии.
Опухолевые клетки влияют на систему гемостаза с помощью различных механизмов, включая прокоагулянтные, антифибринолитические и проагрегантные эффекты, выделение провоспалительных и проангиогенных цитокинов, взаимодействие с клетками сосудов и клетками крови через молекулы адгезии. Венозные тромбозы и тромбоэмболии у онкологических больных довольно распространены, достигая 20 % случаев среди стационарных пациентов, и часто не раcпознаются. В то же время у больных раком отмечается и повышенный риск кровотечений, что создает дополнительные сложности в ведении таких пациентов.
Лучевое поражение клапанов встречается в 10 % случаев. Отсутствие вовлечения кончиков створок митрального клапана и комиссур позволяет дифференцировать его от ревматического поражения.
Тяжелые атеросклеротические и неатеросклеротические поражения периферических артерий нижних конечностей могут возникать как в первые месяцы терапии, так и через несколько лет после нее. Последствиями химиолучевой терапии c применением L-аспарагиназы, цисплатина, метотрексата, 5-фторурацила и паклитаксела могут быть синдром Рейно и ишемический инсульт. Согласно имеющимся рекомендациям, пациенты, облучавшиеся по поводу рака головы / шеи или лимфомы, должны проходить цереброваскулярный скрининг. Значительный стеноз (например, сонных артерий) может потребовать стентирования или оперативного лечения. Легочная гипертензия является редким, но серьезным осложнением при применении некоторых противоопухолевых средств, назначаемых при хроническом миелобластном лейкозе и пересадке стволовых клеток.
Легочная гипертензия, вызванная дазатинибом, часто обратима после его отмены, хотя обычно без полного восстановления нормальной гемодинамики правых отделов сердца.
Острый перикардит может возникать при использовании антрациклинов, циклофосфамида, цитарабина и блеомицина. При проведении лучевой терапии он развивается нечасто и обычно связан с перикардиальными медиастинальными опухолями.
ЗАКЛЮЧЕНИЕ
Несмотря на то что в нашей стране отсутствует специальность «Кардиоонкология», проблеме кардиотоксичности необходимо уделять большое внимание как онкологам, так и кардиологам. Раннее выявление кардиоваскулярных осложнений позволяет избежать стойкого повреждения со стороны сердечно-сосудистой системы в дальнейшем.
Читайте также
- Гибридная хирургия: от операции отчаяния к операции выбора
- Клиническое исследование ARISTOTLE отмечает десятилетний юбилей
- Европейский конгресс кардиологов: самое важное и интересное
- Антиагрегантная и антикоагулянтная терапия при различных клинических состояниях
- Постпрандиальная гликемия и сердечно-сосудистый риск

















