Статьи
Место пэгвисоманта в современных алгоритмах лечения акромегалии
Акромегалия — тяжелое хроническое нейроэндокринное заболевание. Главные проблемы его лечения связа- ны с запоздалой диагностикой и существованием множественных клинико-патологических вариантов аденом, секретирующих гормон роста (ГР), которые отличаются степенью агрессивности течения и разной чувствительностью к терапии. В большинстве случаев стойкий контроль акромегалии достигается благодаря эндоскопической хирургии аденом гипофиза и аналогам соматостатина 1-го поколения (АС1) — ланреотиду и октреотиду. Если этого не происходит, подключают АС 2-й генерации — пасиреотид* или пэгвисомант (Сомаверт).
АГРЕССИВНЫЙ ВАРИАНТ
Наибольшую сложность для курации представляют агрессивные варианты соматотропином — слабо гранулированных и смешанных опухолей. У них обнаруживаются три характерные особенности.
- Высокая секреторная и пролиферативная активность.
- Инвазивный рост с развитием интракраниальной компрессии.
- Склонность к рецидивированию.
- Частичная или полная резистентность к АС1 в связи с низкой экспрессией 2-го подтипа соматостатиновых рецепторов, что требует коррекции схемы фармакотерапии с подключением АС 2-й генерации (пасиреотида* или пэгвисоманта).
АНТАГОНИСТ ГР‑РЕЦЕПТОРОВ
Пэгвисомант (Сомаверт) представляет собой генно-инженерный аналог эндоген- ного ГР человека с 9 мутациями. Произведенные аминокислотные замены способствуют разнонаправленному изменению связывания с различными субъединицами рецептора ГР (повышению аффинности с одной субъединицей и блокированию связывания с другой), препятствуя таким образом процессу димеризации рецептора и внутриклеточной трансдукции сигнала. В итоге путем конкурентного ингибирования препарат блокирует биологическое действие ГР в периферических тканях и органах, способствуя, несмотря на сохраняющееся повышенное содержание ГР в крови, стойкому снижению уровня ИРФ‑1 и профилактике осложнений.
В условиях реальной клинической практики обсервационные исследования — ACROSTUDY и GPOS (German Pegvisomant Observation Study) подтвердили, что препарат обеспечивает нормализацию ИРФ‑1 у 60–90 % больных и регресс многих клинических симптомов. Наблюдалось улучшение показателей углеводного обмена, снижение инсулинорезистентности, повышение кардиальной функции, увеличение толерантности к физической нагрузке, снижение кардиоваскулярного риска.
РЕЖИМ ДОЗИРОВАНИЯ
Первая нагрузочная доза Сомаверта составляет 40 мг в виде подкожной инъекции. В последующем Сомаверт вводится ежедневно по 10, 15, 20 мг подкожно в область плеча, верхней части бедра, живота или ягодиц. Максимальная доза — 30 мг/сут. Пиковая концентрация наблюдается через 33–77 часов. Период полужизни равняется 6 дням.
Как правило, для стойкого контроля уровня ИРФ‑1 необходимы ежедневные инъекции. Эффективность препарата и необходимость титрации оцениваются по уровню ИРФ‑1. Конечная доза зависит от возраста пациентов, активности заболевания и ИМТ.
У больных симптоматическим сахарным диабетом отмечается более высокая потребность в пэгвисоманте, что обусловлено влиянием гиперинсулинемии на повышение экспрессии рецепторов ГР в печеночной ткани. Стартовая доза и скорость титрации тем выше, чем моложе пациент, чем выше активность основного заболевания, ИМТ и выраженность гипергликемии. Во избежание соматотропной недостаточности уровень ИРФ‑1 должен быть в пределах возрастной нормы. Также необходим текущий контроль печеночных ферментов.
ОСОБЕННОСТИ ПРИМЕНЕНИЯ
Пэгвисомант рекомендуется больным с агрессивным течением акромегалии после нерадикальной аденомэктомии, неэффективной лучевой терапии и резистентности к АС 1-й и 2-й генераций. Своевременное добавление пэгвисоманта в схему терапии позволяет избежать повторного оперативного вмешательства, радиохирургического лечения или назначения избыточно высоких доз АС.
Описан положительный эффект комбинированного применения пэгвисоманта с каберголином при смешанных аденомах (соматопролактиномах). Совместное использование пэгвисоманта с аналогами соматостатина (или агонистами дофамина) позволяет повысить эффективность препаратов и уменьшить их терапевтическую дозу.
В условиях реальной клинической практики монотерапия пэгвисомантом способствовала нормализации уровня ИРФ‑1 в 75 % случаев, что обусловлено недостаточной титрацией дозы. Следует отметить, что при монотерапии сохраняется риск продолженного роста опухоли и развития масс‑эффекта, поэтому в процессе лечения требуется динамический МР‑контроль за размерами опухоли.
В обсервационном исследовании ACROSTUDY оценивалась эффективность различных режимов лечения:
- Сочетание пэгвисоманта с АС продленного действия.
- Сочетание с каберголином.
- Монотерапия.
После 4 лет лечения нормализация уровня ИРФ‑1 по группам наблюдалась в 62 %, 63 % и 65 % случаев соответственно. Побочные эффекты были похожими. Последующие исследования показали большую эффективность комбинированной терапии.
3 ЛИНИИ ЛЕЧЕНИЯ
Место пэгвисоманта (Сомаверта) в комплексной терапии акромегалии закреплено в 2018 году Европейским консенсусным соглашением по диагностике и лечению данного заболевания. Рекомендуемая схема терапии предполагает 3 линии.
- В качестве первого шага — хирургическая резекция аденомы гипофиза трансназальным транссфеноидальным доступом. При отсутствии хирургических перспектив или противопоказаниях к оперативному вмешательству (в связи с соматическим статусом или особенностями опухолевого роста) назначается первичная терапия — АС1. Больным акромегалией с небольшим повышением уровня ИРФ‑1 (менее чем в 2,5 раза от верхней границы нормы) в качестве первичной терапии может быть рекомендован каберголин.
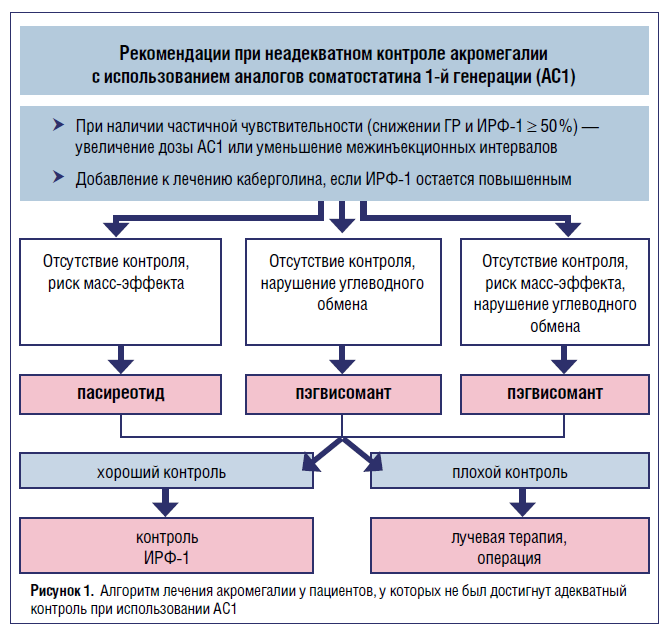
- Вторая линия лечения предполагает назначение АС1 при отсутствии контроля акромегалии после нерадикальной аденомэктомии. Пациентам с частичной чувствительностью к АС1 (снижение ГР и/ или ИРФ‑1 ≥ 50 %) рекомендуется поступательная эскалация дозы (или уменьшение межинъекционных интервалов), а также дополнительное назначение каберголина.
Если на фоне максимальных доз АС1 биохимический контроль не достигнут, эксперты предлагают индивидуализированное лечение с учетом наличия (или отсутствия) клинических признаков остаточной ткани и состояния углеводного обмена. Если остаточная опухолевая ткань не подлежит резекции, рекомендовано перевести пациента на АС 2-й генерации (пасиреотид ЛАР*). При симптоматическом сахарном диабете (или при развитии ятрогенной гипергликемии на пасиреотид) предлагается назначение пэгвисоманта. Если остаточная ткань опухоли небольших размеров и изначально нарушен углеводный обмен, показано добавление пэгвисоманта к АС 1-й генерации. - Если при подключении второй линии терапии биохимический контроль не достигнут, переходят к 3-й линии лечения — стереотаксической радиохирургии, хирургической реинтервенции или использованию темозоломида (см. рис. 1). Таким образом, благодаря эффективному хирургическому вмешательству, поступательному расширению линейки разнонаправленных лекарственных препаратов и использованию дифференцированного подхода к лечению различных патоморфологических вариантов ГР‑секретирующих аденом у врачей появилась реальная возможность обеспечить стойкий контроль заболевания с повышением качества и продолжительности жизни больных акромегалией.
* Пасиреотид не зарегистрирован в РФ
Список литературы находится в редакции
Читайте также
- Инновации — резерв эффективности эндокринологии Москвы
- СД: управление рисками у пациентов пожилого и старческого возраста
- Стоит вопрос: как сделать жизнь при диабете сладкой?
- Обучение как один из основных факторов комплексной терапии диабета
- Акромегалия: 10 вопросов о главном
- Чем московский пациент отличается от американского
- Леонид Соболев: ученый, опередивший время

















