Статьи
«Синдром разбитого сердца»: диагноз установлен — что дальше?
В «Современной Кардиологии» № 2 2024 г. мы рассказывали об этиологии синдрома такоцубо (СТ), или стрессиндуцированной кардиомиопатии (КМП), и основных методах диагностики1 . Предлагаемый сегодня материал посвящен рассмотрению патогенеза и современных направлений лечения этой патологии.
ПОЧЕМУ «РАЗБИВАЕТСЯ» СЕРДЦЕ?
Патогенез СТ представляет собой совокупность сложных и многофакторных процессов (рис. 1), взаимодействие которых до настоящего времени окончательно не установлено. Тем не менее можно выделить несколько ключевых составляющих: гиперпродукция катехоламинов (КХА), спазм коронарных артерий и микрососудистая дисфункция.
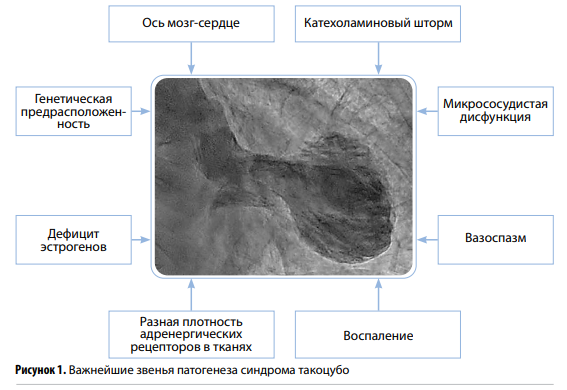
Согласно современным представлениям, деятельность симпатической нервной системы (СНС) имеет определяющее значение в возникновении СТ. В ответ на действие эмоционального и/ или физического стресса (как наиболее частого триггера) происходит активация гипоталамо-гипофизарно-надпочечниковой оси с запуском синтеза и секреции КХА — норадреналина (НА) и адреналина (Адр) — в мозговом веществе надпочечников. Кроме того, на фоне стресса НА в большом количестве высвобождается из симпатических адренергических нервных терминалей, плотность которых максимальна именно в апикальных отделах левого желудочка (ЛЖ). В исследовании I.S. Wittstein и соавт. у пациентов с СТ уровень Адр в крови составлял 1264 пг/мл, тогда как у больных с острым инфарктом миокарда—376 пг/мл; содержание же НА было равным 2284 и 1100 пг/мл соответственно. Известно, что высокая концентрация Адр в крови оказывает отрицательный инотропный эффект, однако при нормализации уровня нейромедиатора до референсных значений сократительная способность кардиомиоцитов восстанавливается. Этим можно объяснить преходящую дисфункцию миокарда ЛЖ при стресс-индуцированной КМП.
Одним из механизмов формирования СТ считается прямое токсическое действие КХА на миокард. Оно реализуется посредством избыточной стимуляции β-адренорецепторов кардиомиоцитов, в результате чего повышается активность аденилатциклазы за счет активации синтеза стимулирующего Gs-белка. Далее происходит трансформация аденозинтрифосфата (АТФ) в циклический аденозинмонофосфат (цАМФ), который активирует протеинкиназу C, фосфорилирующую кальциевые каналы, что способствует их открытию. Возникающий избыток ионов Ca2+ в кардиомиоцитах содействует ускорению окислительных процессов, накоплению активных форм кислорода. В результате развиваются апоптоз/некроз кардиомиоцитов и, как следствие,—сократительная дисфункция миокарда.
В качестве второго патогенетического пути предполагается так называемое катехоламиновое оглушение, впервые описанное в начале 2000-х гг. Суть механизма заключается в том, что в ответ на гиперпродукцию НА/Адр возникает десенсибилизация β-рецепторов. В ответ на это синтезируется не Gs-, а ингибирующий Gi-белок, что ведет к снижению насосной функции миокарда и одновременно его защиты от токсического воздействия КХА. Последние помимо влияния на β-рецепторный аппарат кардиомиоцитов принимают участие в формировании оксидативного и нитросативного стресса, воспалительных изменений и нарушений внутриклеточных метаболических процессов, на фоне чего образуется дефицит энергии в кардиомиоцитах. Все это также вносит вклад в снижение сократительной способности миокарда.
Большое внимание уделяется также феномену микрососудистого спазма. В ряде исследований продемонстрировано повышение при СТ содержания эндотелина — неселективного вазоконстриктора, способного провоцировать спазм коронарных сосудов с последующими ишемией и «оглушением» миокарда. Роль микровазоспазма подтверждается выявлением КХА-индуцированного апоптоза эндотелиальных клеток мелких сосудов при гистологическом исследовании миокардиальных биоптатов пациентов с СТ. В пользу данной теории свидетельствует и общность черт стресс-индуцированной КМП и микрососудистой стенокардии (МС), в основе которой лежат микроваскулярная дисфункция и нарушения перфузии миокарда. Оба заболевания наблюдаются преимущественно у женщин в постменопаузе, а провоцирующим фактором болевого приступа при МС часто служат отрицательные эмоции; кроме того, как при СТ, так и при МС обструктивное поражение коронарных артерий зачастую отсутствует.
Учитывая тот факт, что СТ страдают главным образом женщины в постменопаузальном периоде, нельзя не сказать о патогенетической роли эстрогенов. Хорошо известно, что эти гормоны обладают кардиопротективными свойствами, которые достаточно подробно изучены.
Уменьшение концентрации эстрогенов приводит к ослаблению вагусного влияния на вегетативный центр гипоталамуса, что повышает чувствительность СНС при ее активации. Ряд публикаций свидетельствуют о том, что женщины >55 лет имеют 5-кратно повышенный риск развития стресс-индуцированной КМП по сравнению с более молодыми. В настоящее время в научной среде ведутся исследования эффектов заместительной гормональной терапии в плане предотвращения развития кардиоваскулярных заболеваний. Тем не менее на данный момент убедительные доказательства ее положительного влияния отсутствуют.
Следует подчеркнуть, что действие КХА занимает ведущее место среди патофизиологических звеньев СТ. Таким образом, его патогенез можно рассматривать как совокупность реакций со стороны сердечнососудистой системы в ответ на катехоламиновый шторм. Это подтверждается наблюдениями, в которых СТ возникает у пациентов с феохромоцитомой, а также в условиях острого повреждения головного мозга: оба патологических состояния также ассоциированы с избытком КХА. Кроме того, описаны случаи ятрогенного СТ после введения симпатомиметических препаратов в больших количествах (например, добутамина при стресс-ЭхоКГ; высоких доз Адр). Однако все еще остается открытым вопрос о том, почему в одних ситуациях стресс провоцирует СТ, в других же — при наличии даже сильного стрессового воздействия рассматриваемая патология не развивается. По-видимому, в подобных случаях имеет значение генетическая предрасположенность к возникновению заболевания.
КАК НУЖНО ЛЕЧИТЬ?
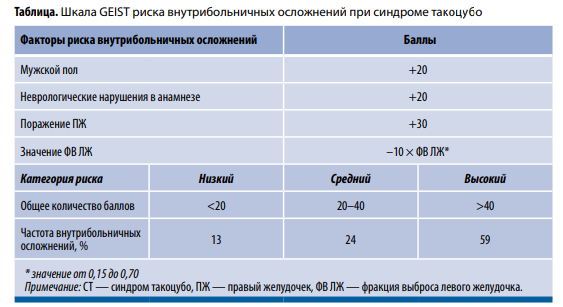
На сегодняшний день не существует установленных клинических рекомендаций по лечению СТ. Терапевтические подходы определяются конкретной клинической ситуацией и вероятностью развития осложнений (рис. 2). На базе данных международного многоцентрового регистра разработана балльная шкала GEIST, оценивающая риск возникновения внутрибольничных осложнений у пациентов со стресс-индуцированной КМП (табл.). В зависимости от количества баллов больных классифицируют на группы низкого (<20 баллов), среднего (20–40) или высокого (>40 баллов) риска таких осложнений.

Поскольку клиническая картина СТ часто напоминает таковую острого коронарного синдрома (ОКС) на его начальном этапе, рекомендуется вести пациентов согласно стандартам лечения, принятым для этой нозологической формы. После исключения ОКС, учитывая преимущественно обратимый характер стресс-индуцированной КМП, в большинстве случаев оказываются достаточными тщательное наблюдение в отделении интенсивной терапии на протяжении острого периода и мероприятия, направленные на поддержание основных жизненных функций.
Медикаментозное лечение СТ включает β-адреноблокаторы (ББ), ингибиторы ангиотензинпревращающего фермента (ИАПФ) или блокаторы рецепторов ангиотензина II (БРА). Кроме того, возможно назначение диуретических препаратов, нитратов и ингибиторов минералокортикоидов при наличии показаний. Следует заметить, что, хотя рационально считать ББ патогенетической терапией с учетом их способности предупреждать токсическое влияние КХА, до настоящего времени фактически отсутствуют данные, подтверждающие эффективность представителей этой фармгруппы как в остром периоде болезни, так и в долгосрочной перспективе. Так, C. Templin и соавт. (2015) выявили, что применение ИАПФ/ БРА ассоциируется с улучшением выживаемости пациентов в течение 1 года, тогда как никаких доказательств преимуществ ББ получено не было.
В исследовании, проведенном P. Petursson и соавт. (2024) с использованием данных регистра SWEDEHEART (The Swedish Web-system for Enhancement and Development of Evidence-based care in Heart disease Evaluated According to Recommended Therapies; 1724 пациента), изучалось влияние различных опций медикаментозной терапии на показатели смертности при стресс-индуцированной КМП. Установлено, что назначение таких средств, как инотропы, дигоксин и диуретики, ассоциировалось с повышенной частотой смертности, в то время как прием ИАПФ, статинов и антикоагулянтов (нефракционированный гепарин и низкомолекулярные гепарины) — напротив, со снижением случаев летальных исходов. Вместе с тем ББ, БРА, а также антитромбоцитарные препараты не оказывали значимого влияния на уровень смертности пациентов с СТ. Анализируя полученные результаты, авторы подчеркивают, что инотропные средства (допамин, добутамин) были ассоциированы с самой высокой 30-суточной смертностью среди всех препаратов. Эти данные в очередной раз подтверждают значимую роль КХА в патогенезе заболевания. Считается, что у пациентов со стресс-индуцированной КМП, нуждающихся в инотропной поддержке, наиболее рационально отдавать предпочтение левосимендану, поскольку он относится к сенситизаторам кальция и имеет иной механизм действия, либо использовать механическую поддержку кровообращения и дыхания (внутриаортальная баллонная контрпульсация, экстракорпоральная мембранная оксигенация, временное вспомогательное устройство для ЛЖ). Необходимо также напомнить, что у больных с СТ и обструкцией выходного тракта ЛЖ использование диуретиков, дигоксина, инотропных препаратов противопоказано. В таких случаях возможно назначение β1 -селективных ББ с коротким периодом полувыведения. Что касается статинов и антиагрегантов, то в настоящее время они считаются показанными при сопутствующей ИБС. На рис. 2 схематично представлено лечение стрессиндуцированной КМП.
В соответствии с имеющимися данными у страдающих «синдромом разбитого сердца» частота возникновения тромба в полости ЛЖ варьирует от 2 до 8 %. Таким лицам рекомендована антикоагулянтная терапия в течение ≥3 мес до полного разрешения тромбоза. Некоторые исследователи считают целесообразным профилактическое назначение антикоагулянтов при наличии следующих критериев: апикальный вариант СТ, фракция выброса ЛЖ ≤30 %, наличие других сердечно-сосудистых заболеваний в анамнезе, повышенный уровень С-реактивного белка, уровень тропонина I >10 нг/мл и количество лейкоцитов при поступлении >10 × 10³/мкл.
ЧЕГО ОЖИДАТЬ ДАЛЬШЕ?
Прогноз при СТ обычно благоприятный. Большинство пациентов полностью восстанавливаются в течение нескольких недель или месяцев. Однако важно помнить, что в острый период имеется серьезный риск развития внутрибольничных осложнений (жизнеугрожающие аритмии, кардиогенный шок и т.д.), аналогичных таковым при ОКС. Существует мнение, что одним из факторов, предопределяющих долгосрочный прогноз, служит характер триггера. Как уже указывалось, при спровоцированном физическим фактором СТ риск смертности в 3 раза выше, чем при его возникновении на фоне эмоционального стресса. Частота рецидивов по одним источникам составляет 11,4 % в течение 4 лет после первого обращения, согласно другим сведениям — 4,7–5,0 % на протяжении 10-летнего наблюдения. В этой связи отдельные авторы предлагают рассматривать наличие неврологического или психического заболевания в качестве предиктора рецидива стресс-индуцированной КМП.
Таким образом, СТ остается недостаточно изученной проблемой современной медицины, что указывает на необходимость дальнейших научных изысканий. Получение новых детальных знаний о патогенетических механизмах, лежащих в основе болезни, позволит разработать эффективную стратегию лечения, что, в свою очередь, поможет минимизировать риск осложнений.
Список литературы находится в редакции
Читайте также
- Идиопатический рецидивирующий перикардит: распознавание, лечение, мониторинг
- «Осложнение на сердце»: миокардит и его негативные последствия
- Модификация факторов риска и профилактика развития тромбоэмболических событий при фибрилляции предсердий
- Что может дать кардиологу внеклеточная ДНК?
- В повседневную практику - Клиническая задача СК №4-24

















